高三年级化学上学期半期考试题
化 学 试 题
可能用到的相对原子质量 Fe 56 A 127 Cu64 C12 O16 Mg24 H1 Be9 Si28
S32 Na23
一、选择题(每小题只有一个选项符合题意,每小题3分,本题共66分)
1.闪电时空气中有臭氧生成。下列说法中正确的是 ( )
A.O3和O2互为同位素 B.O2比O3稳定
C.等体积O3和O2含有相同质子数 D.O3与O2的相互转化是物理变化
2.下列表述正确的是 ( )
①人造刚玉熔点很高,可作高级耐火材料,主要成分是二氧化硅
②化学家采用玛瑙研钵磨擦固体反应物进行无溶剂合成,玛瑙的主要成分是硅酸盐
③提前建成的三峡大坝使用了大量水泥,水泥是硅酸盐材料
④夏天到了,游客佩载由添加氧化亚铜的二氧化硅玻璃制作的变色眼镜来保护眼睛
⑤太阳能电池可采用硅材料制作,其应用有利于环保、节能
A.①②③ B.②④ C.③④⑤ D.③⑤
3.某金属氧化物在光照下可生成具有很强氧化能力的物质,能用来消除空气或水体中的污
染物。下列有关该金属氧化物的应用的叙述不正确的是 ( )
A.将形成酸雨的SO2氧化为SO3
B.将家居装修挥发出的甲醛氧化为CO2和H2O
C.将医药废水中的苯酚氧化成H2O和CO2
D.将电镀废水中的氰根离子CN-氧化成CO2和N2
4.下列离子方程式正确的是 ( )
A.CuCl2溶液与Na反应:Cu2++2Na=2Na++Cu
B.F2与NaOH溶液反应:F2+4OH-====2F-+O2+2H2O
C.AgNO3溶液中加入过量氨水:Ag++2NH3·H2O====Ag(NH3)2++2H2O
D.Fe3O4与稀NHO3反应:Fe3O4+8H+====Fe2++2Fe3++4H2O
5.下表中,对陈述I、II的正确性及两者间是否具有因果关系的判断都正确的是 ( )
| 选项 | 陈述I | 陈述II | 判断 |
| A | 工业生产硫酸用水吸收SO3 | SO3可与水反应 | I对,Ⅱ对;有 |
| B | Cl2和SO2混合后可用于漂白纸浆 | Cl2和SO2都有较好的漂白作用 | I对,Ⅱ错,无 |
| C | 金属钠具有强还原性 | 钠在自然界里只能以化合态存在 | I对,Ⅱ对;无 |
| D | 石墨常用作电解池的电极 | 石墨的化学性质稳定且导电性好 | I对,Ⅱ对;有 |
6.氢元素与其他元素形成的二元化合物称为氢化物,下面关于氢化物的叙述正确的是( )
![]() H
H
A.一个D2O分子所含的中子数为8 B.NH3的结构式为H—N—H
C.还原性:H2Se<HCl<HF D.热稳定性:H2S>Hl
7.将5.4gAl投入200.0mL2.0mol·L-1的某溶液中氢气产生,充分反应后有金属剩余。该溶
液可能为 ( )
A.HNO3溶液 B.Ba(OH)2溶液 C.H2SO4溶液 D.HCl溶液
8.下列各组热化学方程式中,化学反应的△H前者大于后者的是 ( )
①C(s)+O2(g)=CO2(g); △H1 C(s)+1/2O2(g)=CO(g); △H2
②S(s)+O2(g)=SO2(g); △H3 S(g)+O2(g)=SO2(g); △H4
③H2(s)+1/2O2=H2O(g); △H5 2H2(g)+O2(g)=2H2O(1); △H6
④CaCO3(s)=CaO(s)+CO2(g); △H7 CaO(s)+H2O(1)=Ca(OH)2(s); △H8
A.① B.④ C.②③④ D.①②③
9.一定能在下列溶液中大量共存的离子组是 ( )
A.含有大量Al3+的溶液:Na+、NH4+、SO42-、Cl-
B.c(H+)=1×1013mol·L-1的溶液:Na+、Ca2+、SO42-、CO32-
C.含大量Fe3+的溶液:Na+、Mg2+、NO3-、SCN-
D.含有大量NO3-的溶液:H+、Fe2+、SO42-、Cl-
10.将aLNH3通过灼热的装有铁触媒的硬质玻璃管后,气体体积变为bL(气体体积均在同温同压下测定),该bL气体中NH3的体积分数是 ( )
A.![]() B.
B.![]() C.
C.![]() D.
D.![]()
11.下列反应中生成物总能量高于反应物总能量的是 ( )
A.碳酸钙受热分解 B.乙醇燃烧
C.铝粉与氧化铁粉末反应 D.氧化钙溶于水
12.某非金属单质A和氧气发生化合反应生成B。B为气体,其体积是反应掉氧气体积的两倍(同温同压)。以下对B分子组成的推测一定正确的是 ( )
A.有1个氧原子 B.有2个氧原子 C.有1个A原子 D.有2个A原子
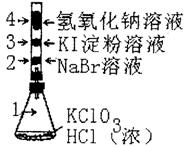
13.已知常温下氯酸钾与浓盐酸反应放出氯气,现按下图进行卤素的性质实验。玻璃管内装有分别滴有不同溶液的白色棉球,反应一段时间后,对图中指定部位颜色描述正确的是
|
|
14.下列物质能通过化合反应直接制得的是:
①FeCl2 ②H2SO4 ③NH4NO3 ④HCl
A.只有②③④ B.只有②③ C.只有①②④ D.全部
|
A.反应速率:两者相同
B.消耗硝酸的物质的量:前者多,后者少
C.反应生成气体的颜色:前者浅,后者深
D.反应中转移的电子总数:前者多,后者少
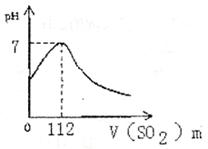
16.在标准状况下,向100mL氢硫酸溶液中通入二
氧化硫气体,溶液pH变化如图所示,则原氢硫
酸溶液的物质的量浓度为 ( )
A.0.5mol/L B.0.05mol/L
|
17.右图是气体制取装置,下列能用此装置
制取气体并能“隋开随用、随关随停”
的是 ( )
A.大理石和稀硫酸制取CO2
B.锌粒和稀硫酸制氢气
C.浓盐酸和二氧化锰制取氯气
D.电石和水制取乙炔
18.将氯气用导管通入较浓的NaOH和H2O2的混和液中,在导管口与混和液的接触处有闪烁的红光出现。这是因为通气后混和液中产生的ClO-被H2O2yc还原,发生激烈反应,产生能量较高的氧分子,它立即转变为普通氧分子,将多余的能量以红光放出。
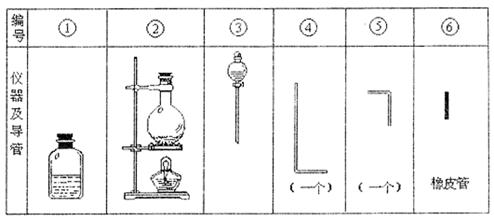
|
A.组装氯气发生器时,应选用的仪器及导管是③②⑤(数字为表中仪器及导管编号)
B.实验进行中,按气流方向从左到右的顺序,气体流红的各仪器及导管的编号依次是②④⑥⑤①
C.仪器①的橡皮塞上应有2个孔.
D.实验时仪器①中ClO-与H2O2反应的离子方程式是:ClO-+H2O2=Cl-+O2↑+H2O
19.已知Ba(AlO2)2可溶于水。右图表示的是向Al2(SO4)3溶液中逐滴加入Ba(OH)2溶液时,生成沉淀的物质的量y与加入Ba(OH)2的物质的量x的关系。下列有关叙述正确的是
( )
A.a~b时沉淀的物质的量:Al(OH)3比BaSO4多
B.c~d时溶液中离子的物质的量:AlO2-比Ba2+多
C.a~d时沉淀的物质的量:BaSO4可能小于Al(OH)3
D.d~e时溶液中离子的物质的量:Ba2+不可能等于OH-
|
A.+1638kJ·mol-1
B.-1638kJ·mol-1
C.-126kJ·mol-1
D.+126kJ·mol-1
21.已知反应:①101kPa时,2C(s)+O2(g)=2CO (g);△H=-221kJ/mol
②稀溶液中,H+(aq)+OH-(aq)=H2O(1);△H=-57.3kJ/mol
下列结论正确的是
A.碳的燃烧热大于110.5kJ/mol
B.①的反应热为221kJ/mol
C.稀硫酸与稀NaOH溶液反应的中和热为-57.3kJ/mol
D.稀醋酸与稀NaOH溶液反应生成1mol水,放出57.3kJ/热量
22.硫代硫酸钠可作为脱氯剂,已知25.0mL0.100mol·L-1Na2S3O3溶液恰好把224mL(标准状况下)Cl2完全转化为Cl-离子,则S2O32-将转化成 ( )
A.S2- B.S C.SO32- D.SO42-
二、填空题
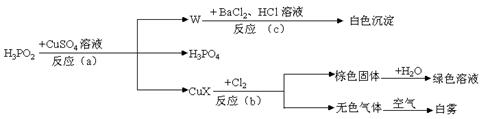
23.(14分)次磷酸(H3PO2)是一种强还原性弱酸,它能发生下列反应:
|
(1)CuX中X是表示一种元素,这种元素是 。
(2)反应(a)的化学方程式为 ,其中被氧化的元素是 ,还原产物是 (写物质的名称)。
(3)反应(c)的离子方程式为 。
(4)反应(b)中,当有1molCuX被氧化时,转移的电子数目为 个。
24.(14分)某研究小组进行与NH3有关的系列实验。
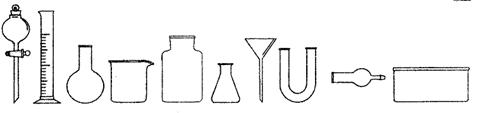
(1)从下图中挑选所需仪器,画出制取干燥NH3的装置简图(添加必要的塞子、玻璃导管、胶皮管。固定装置和尾气处理装置不用画),并标明所用试剂。 。
|
(2)将NH3通入溴水中,有N2生成,反应的化学方程式为 。
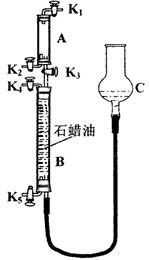
(3)为验证“同温同压下,相同体积的任何气体都含有相同数目的分子”,该小组同学设计了如下图所示的装置,图中B管的容积是A管的2倍,活塞K1、K2、K3、K4、K5均关闭(固定装置和尾气处理装置略;HCl和NH3均不溶于石蜡油,也不与之反应;装置气密性好)。
①在A管中充满与大气压强相等的干燥HCl气体。操作是 。
|
与A管同压的干燥NH3。
②缓缓开启K3,A管中的现象是
。
要达到实验目的,当反应完成并恢复到室
温时,B管中预期的现象是
。
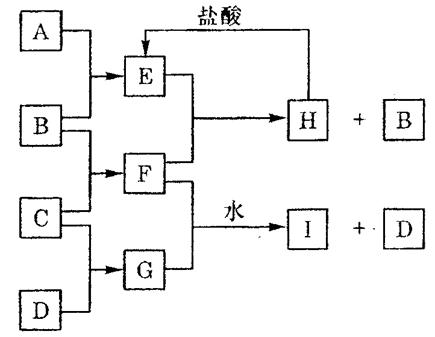
25.(10分)A、B、C、D是按原子序数由小到大排
列的第二、三周期元素的单质。B、E均为组成空
气的成分。F的焰色反应呈黄色。在G中,非金属
元素与金属元素的原子个数比为1:2。在一定条件
下,各物质之间的相互转化关系如下(图中部分产
物未列出):请填写下列空白:
|
(1)A是 ,C是 。
(2)H与盐酸反应生成E的化学方程式是 。
(3)E与F反应的化学方程式是 。
(4)F与G的水溶液反应生成I和D的离子方程式是 。
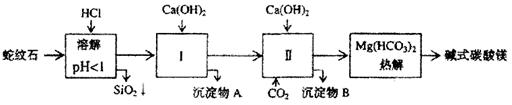
26.(17分)蛇纹石矿可以看作由MgO、Fe2O3、Al2O3、SiO2组成。由蛇纹石制取碱式碳酸镁的实验步骤如下:
|
(1)蛇纹石矿加盐酸溶解后,溶液里除了Mg2+外,还含有的金属离子是
(2)进行I操作时,控制溶液pH=7—8(有关氢氧化物沉淀的pH见右表)
| 氢氧化物 | Fe(OH)3 | Al(OH)3 | Mg(OH)2 |
| 开始沉淀pH | 1.5 | 3.3 | 9.4 |
Ca(OH)2不能过量,若Ca(OH)2过量可能会导致 溶解、 沉淀。
(3)从沉淀混合物A中提取红色氧化物作颜料,先向沉淀物A中加入 (填入物质的化学式),然后 (依次填写实验操作名称)。
(4)物质循环使用,能节约资源。上述实验中,可以循环使用的物质是
(填写物质化学式)。
(5)现设计一个实验,确定产品aMgCO3·bMg(OH)2·cH2O中a、b、c的值,请完善下列实验步骤(可用试剂:浓硫酸、碱石灰):
①样品称量 ②高温分解 ③ 或
④MgO称量
(6)18.2g产品完全分解后,产生6.6gCO2和8.0gMgO,由此可知,产品的化学式中:
a= b= C=
27.(21分)(1)合成氨工业生产中所用的α—Fe催化剂的主要成分是FeO、Fe2O3。当催化剂中Fe2+与Fe3+的物质的量之比为1:2时,其催化剂活性最高。以Fe2O3为原料制备上述催化剂,可向其中加入适量炭粉,发生如下反应:
2Fe2O3+C=4FeO+CO2↑。为制得这种活性最高的催化剂,应向480gFe2O3粉末中加入炭粉的质量为 g。
(2)2gCu2S和CuS的混合物在酸性溶液中用400mL0.075mol/LKMnO4溶液处理,发生反应如下:
MnO4-+Cu2S+H+→Cu2++SO2++Mn2++H2O
MnO4-+CuS+H+→Cu2++SO2++Mn2++H2O
反应后煮沸溶液,赶尽SO2,剩余的KMnO4恰好与350mL0.1mol/L(NH4)2Fe(SO4)2溶液完全反应(KMnO4的还原产物为Mn2+)。
则Cu2S和CuS的混合物中Cu2S的质量分数为 。
(3)已知:N2(g)+2O2(g)=2NO2(g);△H=+67.7kJ/mol
N2H4(g)+O2(g)=N2(g)+2H2O(g); △H=-534kJ/mol
N2O(1)=H2O(g); △H=+44kJ/mol
发射卫星用肼(即N2H4)的气体为原料,以NO2气体为氧化剂,两种物质反应生成氮气和液态水,试写出该反应的热化学方程式: 。
(4)用24.5%硫酸溶液(密度为1.20g/cm3)配制100ml 0.20mol/L硫酸溶液时,要用到的玻璃仪器有:容量瓶、酸式滴定管、烧杯、胶头滴管和 .使用容量瓶时应先检查其是否 ;用刚洗净的酸式滴定管量取24.5%硫酸溶液时,应先 ,然后量取 mL 24.5%硫酸溶液进行配制.
(5)现有足量铝屑、含1molH2SO4的浓硫酸、含1.5molNaOH的氢氧化钠溶液和水。①若用上述原料制取氢气,有以下两个方案:
方案一:用铝屑和氢氧化钠溶液制取氢气
方案二:用铝屑、浓硫酸和水制取氢气
你认为最好的方案是 其理由是: 。
②制取氢氧化铝可以有几种不同的方法。若用上述原料最多能制得 gAl(OH)3.
28.(8分)钇(Y)元素是激光和超导的重要材料。我国蕴藏着丰富的含钇矿石(YxeBe2Si2O10)。现将4.68g矿样与过量的NaOH共熔,反应后加适量水溶解,过滤。滤渣中有Y(OH)3、Fe2O3(反应中Fe由+2价变为+3价),滤液中有Na2SiO3、Na2BeO2等。将滤液配成1L溶液,测知pH值为13(C(OH)=0.1mol/L),往此滤液中加入3.3mol/L盐酸100mL,结果pH值为1(C(H)=0.1mol/L),反应过程如图:
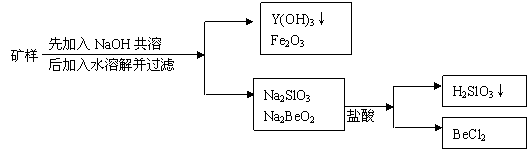 |
求Y元素的相对原子质量及X值。
参考答案
1.B 2.D 3.A 4.C 5.D 6.B 7.D 8.C 9.A 10.C
11.A 12.A 13.A 14.D 15.B 16.D 17.B 18.B 19.B 20.B
21.A 22.D
23.(1)氢(2分)。
(2)6H2O+3H3PO2+4CuSO4=3H3PO4+4CuH+4H2SO4(3分),次磷酸中的磷元素(2分),
氢化亚铜(2分)
(3)SO42-+Ba2+=BaSO4↓(2分)
(4)1.806×1024(3分)
|
(2)2NH3+3Br2====6HBr+N2(2分)
(3)打开K1、K2,从K2处通入干燥的HCl气体,直到K1处有白雾出现,关闭K1、K2(4分)。②生成大量的白烟(2分)。B管中充满石蜡油(2分)。
25.(1)A:碳(或C)(2分) C:钠(或Na)(2分)
(2)Na2CO3+2HCl=2NaCl+H2O+CO2↑(2分)
(3)2CO2+2Na2O2=2Na2CO3+O2(2分)
(4)Na2O2+S2-+2H2O=4OH-+S↓+2Na(2分)
26.(1)Fe3+ (1分)Al3+(1分)
(2)Al(OH)3(1分)、Mg(OH)2(1分)
(3)NaOH (1分) 过滤(1分)、洗涤(1分)、灼烧(1分)
(4)CO2(2分)
(5)将分解产生的气体用浓硫酸吸收水,测出水蒸汽的质量(2分)或将分解产生的气体用浓硫酸吸收水后再用碱石灰吸收CO2,测出CO2的质量(2分)
(6)3(1分)、1(1分)、3(1分)
27.(1)6克(3分)
(2)40%(3分)
(3)2N2H4(g)+2NO2(g)=3N2(g)+4H2O(1);△H=-1311.7kJ/mol(3分)
(4)玻璃棒(1分);漏水(1分);用24.5%硫酸润洗(2分);6.67(2分)
(5)方案一(1分),生成氢气比方案二多且实验操作简便(2分),156(3分)
28.YxFeBe2Si2O10中元素化合价代数和为零,所以
![]() (2分)
(2分)
因滤液1.0L pH=13所以[OH-]=10-1mol·L-1 nOH-=10-1×1.0=0.10mol
加入盐酸后为1.1L pH=1 所以[H+]=10-1nH+=10-1×1.1=0.11mol
故SiO32-、BeO22-消耗的盐酸为
3.3mol·L-1×0.1L-0.11mol-0.10mol=0.12mol
由Y2Fe2Si2O10——2Na2SiO3+2Na2BeO2——12HCl
1 12
0.01 0.12
所以矿石的式量为:![]()
Y的相对原子质量为(468-56-2×9-2×28-10×16)÷2=89(6分)