高三年级化学上学期月考试题
化 学 试 题
本试卷分选择题和非选择题两部分,共8页,满分150分,考试用时120分钟。
注意事项:
1.答卷前,考生务必用黑色字迹的钢笔或签字笔将自己的姓名、考号填写在答题卡上。
2.选择题每小题选出答案后,用2B铅笔把答题卡上对应题目的答案标号涂黑;如需改
动,用橡皮擦干净后,再选涂其它答案;不能答在试卷上。
3.非选择题必须用黑色字迹的钢笔或签字笔作答,答案必须写在另发的答题卷各题目
指定区域内的相应位置上;如需改动,先划掉原来的答案,然后再写上新的答案;
不准使用铅笔和涂改液,不按以上要求作答的答案无效。
4.考生必须保持答题卡的整洁,考试结束后,将本试卷和答题卡一并收回。
可能用到的相对原子质量:H:1 O:16 C:12 N:14 F:19 Cl:35.5 Br:80 Si 28
Na:23 Mg:24 Al:27 K:39 Cu:64 Ca:40 Fe:56 Zn:65 Ag:108 Cr 52
第Ⅰ卷(选择题,70分)
一、选择题(每题只有一个正确答案,每题2分,共30分)
1.下列变化属于物理变化的是 ( )
A.氧气在放电条件下变成臭氧 B.加热胆矾成白色无水硫酸铜
C.漂白的草帽久置与空气中变黄 D.氢氧化铁胶体加入硫酸镁产生沉淀
2.下列物质中,属于高分子化合物的是 ( )
A.硝化甘油 B.油脂 C.棉花 D.蔗糖
3.科学家发现C60后,近年又合成了许多球形分子(富勒烯),如C50、C70、C120、C540等,
有关他们的叙述正确的是 ( )
①互为同素异形体 ②属于同一种物质 ③富勒烯和足量氧气充分反应,最终产物不同
④富勒烯都可以发生加成反应 ⑤富勒烯在苯中溶解度比在乙醇中溶解度大
A.①②③④⑤ B.①③④⑤ C.①④⑤ D.①③④⑤
4.下列数量的各物质所含原子个数按由大到小的顺序排列的是 ( )
①0.5mol氨气 ②标准状况下22.4L氦 ③4℃时9mL水 ④02mol磷酸钠
A.①④②③ B.④③②① C.②③④① D.①④③②
5.沼气是一种能源,它的主要成分是CH40.5molCH4完全燃烧生成CO2和H2O时,放出
445kJ热量,则下列热化学方程式中正确的是 ( )
A.2CH4 (g)+4O2 (g) = 2CO2 (g)+4H2O(l) △H=+890kJ·mol-1
B.CH4 (g)+2O2 (g) = CO2 (g)+2H2O(l) △H=+890kJ·mol-1
C.CH4 (g)+2O2 (g) = CO2 (g)+2H2O(l) △H=-890kJ·mol-1
D.1/2 CH4 (g)+O2 (g) = 1/2CO2 (g)+H2O(l) △H=-890kJ·mol-1
6.两个体积相同的容器,一个盛有一氧化氮,另一个盛有氮气和氧气,在同温同压下两容
器内的气体一定具有相同的 ( )
A.原子总数 B.质子总数 C.中子总数 D.质量
7.已知某溶液中存在较多的H+、SO42-、NO3-,则溶液中还可能大量存在的离子组是( )
A.Al3+、Na+、Cl B.Na+、NH4+、F
C.Mg2+、Cl-、Fe2+ D.Mg2+、Ba2+、Br-
8.下列各组物质中:①Cl2 O7 HclO; ②SO2 H2 SO4; ③NO2 HNO3; ④SiO2 H2 SiO2;
⑤Mn2 O7 HMnO4,前者是后者的酸酐,正确的是 ( )
A.②③ B.③④ C.④⑤ D.①③④
9.金属钛(Ti)的氧化物TiO2既不溶于硫酸、盐酸和硝酸,也不溶于强碱。但溶于氢氟酸
形成无色溶液,下列对该反应的理由成立的是 ( )
A.氢氟酸具有强烈的腐蚀性 B.氢氟酸具有强氧化性
C.有水生成 D.生成的TiF4是一种弱电解质
10.废切削液中含2%~5%的NaNO2,直接排放会造成环境污染,下列试剂中能使其转化为
不引起二次污染的N2的是 ( )
A.FeCl3 B.NH4 Cl C.NaCl D.浓H2 SO4
11.硝酸盐受热易分解,某金属硝酸盐R(NO3) 11受热分解后,若生成的二氧化氮和和氧气的
体积比为4:1,则反应前后金属R的化合价的变化是 ( )
A.不变 B.降低 C.升高 D.不能确定
12.下列关于胶体的叙述不正确的是 ( )
A.布朗运动是胶体微粒特有的运动方式,可以据此把胶体和溶液、悬浊液区别开来
B.光线透过胶体时,胶体发生丁达尔现象
C.用渗析的方法净化胶体时,使用的半透膜只能让较小的分子、离子通过
D.胶体微粒具有较大的表面积,能吸附阳离子或阴离子,故在电场作用下会产生电泳
现象
13.下列反应(未配平)表现了H2 O2具有弱酸性的是 ( )
A.H2 O2-H2 O+O2↑ B.Na2 O2 +HCl-NaCl+H2 O2
C.H2 O2 +SO2-H2 SO4 D.Ag2 O+H2 O2-Ag+H2 O+O2↑
14.最近有人用一种称为“超酸”的化合物H(CB11 H6 Cl6)和C60反应,使C60获得一个质子,
得到一种新型离子化合物[HC60]+[CB11 H6 Cl6]-。这个反应看起来很陌生,但反应类型却
跟下列一个化学反应相似,你认为该反应是 ( )
A.Mg+2HCl == MgCl2 +H2↑ B.NaOH+HCl = NaCl+H2 O
![]() C.NH3 +HCl =NH4 Cl D.H2 O+CH3
COOH H3 O++CH3
COO-
C.NH3 +HCl =NH4 Cl D.H2 O+CH3
COOH H3 O++CH3
COO-
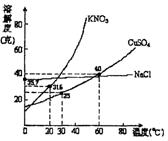
15.将60℃的硫酸饱和溶液100克,冷却到20℃,下列说法正确的是 ( )
A.溶液质量不变 B.溶剂质量发生变化
C.溶液为饱和溶液,浓度不变 D.有晶体析出,溶剂质量不变
二、选择题(每题有一个或两个正确答案,多选、错选得0分,漏选得2分,每题4分,共
40分)
16.设N4表示阿伏加德罗常数,下列叙述中正确的是 ( )
A.标况下,11.2L丙烷所含的共价键数为5NA
B.1.8g的NH4+离子中含有的电子数为NA
C.常温常压下,48gO3含有的氧原子数为NA
D.2.4g金属镁变为镁离子时失去的电子数为0.1NA
17.为确定某溶液的离子组成,进行如下实验:
①测定溶液的Ph,溶液显强碱性。
②取少量溶液加入稀盐酸至溶液呈酸性,产生无刺激性、能使澄清石灰水变浑浊的气体。
③在上述溶液中再滴加Ba(NO3) 2溶液,产生白色沉淀。
④取上层清液继续滴加Ba(NO3) 2溶液至无沉淀时,再滴加AgNO3溶液,产生白色沉淀。
根据实验以下推测正确的是 ( )
A.一定有SO32-离子 B.一定有CO32-离子
C.不能确定Cl-离子是否存在 D.不能确定HCO3-离子是否存在
18.体积为V mL、密度为d g/cm3溶液,含有相对分子质量为M的溶质m克,其摩尔浓度
为C mol/L,质量分数为W%,下列表示式中正确的是 ( )
A.![]() B.
B.![]()
C.![]() D.
D.![]()
19.已知Co2O3在酸性溶液中易被还原成Co2+、Co2O3、Cl2、FeCl3、I2的氧化性依次减弱。
下列反应在水溶液中不可能发生的是 ( )
A.3Cl2+6FeI2 ==== 2FeCl3+4FeI3
B.Cl2+FeI2 ==== FeCl2+I2
C.Co2O3+6HCl ==== 2CoCl2+Cl2↑3H2O
D.2Fe3++2I- ==== 2Fe2++I2
20.向100mL含有等物质的量的NaCN、NaSCN和NaI混合液中滴入0.1mol液溴后,测得
有一半CN-已被氧化,则原溶液中NaSCN的物质的量浓度为多少? (已知①还原性
I->SCN->CN->Br- ②SCN- 和CN-的氧化产物为(SCN) 2和(CN) 2) ( )
A.4mol/L B.2mol/L C.1mol/L D.0.8mol/L
|
A.40℃时,将35克食盐溶于100克水中,
降温至0℃时,可析出氯化钠晶体
B.20℃时,硝酸钾饱和溶液的质量分数是31.6%
C.60℃时,200克水中溶解80克硫酸铜
达饱和,当降温至30℃时,可析出30
克硫酸铜晶体
D.30℃时,将35克硝酸钾和35克食盐
同时溶于100克水中,蒸发时,先析出的是氯化钠
22.如果定义有机物的同系一系列结构式符合A(W)NB(其中n=0,1,2,3……的化合物。
式中A、B是任意一种基因(或氢原子),W为2价有机基团,又称为该同系列的系差。
同系列化合物的性质往往呈现规律性变化。下列四组化合物中,不可称为同系列的是)
( )
A.CH3CH2CH2CH3 CH3CH2CH2CH2CH3 CH3CH2CH2CH2CH2CH3
B.CH3CH=CHCHO CH3CH=CHCH=CHCHO CH3 (CH=CH) 3CHO
C.CH3CH2CH3 CH3CHClCH2CH3 CH3CHClCH2CHClCH3
D.ClCH2CHClCCl3 ClCH2CHClCH2CHClCCl3 ClCH2CHClCH2CHClCH2CHClCCl3
23.在下列离子方程式中正确的是 ( )
A.醋酸和小苏打溶液反应:H++HCO3-=CO2↑+H2O
B.硫氢化钠的水解:HS-+H2O = H3O++S2-
C.铁与三氯化铁溶液反应:Fe+Fe3+=2Fe2+
D.铝与氢氧化钠溶液反应:2Al+2OH-+2H2O=2AlO2-+3H2↑
24.已知t℃时,某物质的不饱和溶液a克中含溶质m克,若该溶液蒸发b克水并恢复到t℃
时,析出溶质m1克,若原溶液蒸发c克水并恢复到t℃时,则析出溶质m2克,用S表示
该物质在t℃时的溶解度,下式中正确的是 ( )
A.![]() B.
B.![]()
C.![]() D.
D.![]()
25.下列有机物互为同分异构体的有 ( )
![]()
![]()
![]()
![]()
![]()
![]() H
F
H
H
H
CH3
H
F
H
H
H
CH3
![]()
![]()
![]()
![]()
![]()
![]() ① C === C ② C === C ③ C === C
① C === C ② C === C ③ C === C
H CH3 F CH3 H F
![]()
![]()
![]()
![]()
![]()
![]() H3C
CH3
H3C F
F
CH3
H3C
CH3
H3C F
F
CH3
![]()
![]()
![]()
![]()
![]() ④ C === C ⑤ C === C ⑥ C === C
④ C === C ⑤ C === C ⑥ C === C
F F H3C F H3C F
A.①②③ B.④⑤⑥ C.①②③④⑤⑥ D.②③
第Ⅱ卷(非选择题,共80分)
26.(10分)(1)把淀粉溶液溶于沸水中,制成淀粉胶体,回答下列问题。
①鉴别水溶液和胶体可以利用的方法是 。
②60℃左右时,在淀粉胶体中加入淀粉酶,充分反应。然后把反应后的全部液体装入半透膜袋里,系紧袋口,并把它悬挂在盛有蒸馏水的烧杯里。从半透膜里析出的物质是 ,该操作的名称是 。
(2)把少量的饱和氯化铁溶液滴入沸水中,制成Fe(OH)3胶体,回答下列问题。
③试写出上述反应的化学方程式 。
④向Fe(OH)3胶体中滴入硫酸直到过量,是描述此过程的实验现象
。
27.(8分)将32.64g铜与140ml一定浓度的硝酸反应,铜完全溶解产生的NO和NO2混合气体在标准状况下的体积为11.2L。请回答:
(1)NO的体积为 L,NO2的体积为 L。
(2)待产生的气体全部释放后,向溶液加入![]() a mol·L-1的NaOH溶液,恰好使溶液中的
a mol·L-1的NaOH溶液,恰好使溶液中的![]() 全部转化成沉淀,则远硝酸溶液的浓度为
mol/L。
全部转化成沉淀,则远硝酸溶液的浓度为
mol/L。
28.(共10分)有A、B、C、D、E、F、G,7瓶不同物质的溶液,它们各是Na2CO3、Na2SO4、
KCl、AgNO3、MgCl2、Ca(NO3)2和Ba(OH)2溶液中的一种。为了鉴别,各取少量溶液进行两两混合,实验结果如表所示。表中“↓”表示生成沉淀或微溶化物,“-”表示观察不到明显变化,试回答下面问题。
(1)A的化学式是 ,G的化学式是 。判断理由是 。
(2)回答下列问题:
①写出B的电子式: 。
②写出C溶于水的电离方程式: 。
③写出用惰性电极电解F(熔融)在阳极的电极反应: 。
| A | B | C | D | E | F | G | |
| A | - | - | - | - | ― | - | ↓ |
| B | - | - | - | - | ↓ | ↓ | ↓ |
| C | - | - | - | ↓ | ↓ | ↓ | |
| D | - | ↓ | - | ↓ | ↓ | ↓ | |
| E | - | ↓ | - | ↓ | - | ↓ | - |
| F | - | ↓ | ↓ | ↓ | ↓ | - | ↓ |
| G | ↓ | ↓ | ↓ | ↓ | - | ↓ | - |
四、(本题包括2大题,共30分)
|
试回答:
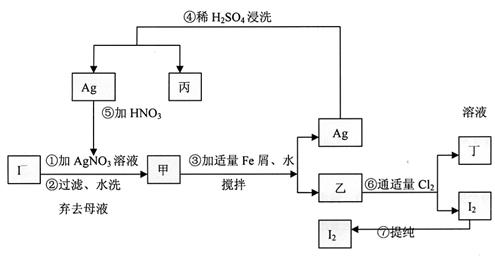
(1)乙、丁中溶质的分子式:乙 ,丁 。
(2)第④步操作中用稀H2SO4浸洗的目的是 (填写字母编号)
a.除去未反应的NO3- b.除去未反应的I-
c.除去未反应的Fe d.除去碱性物质
(3)第⑦步操作可供提纯的两种方法是 和 (不要求写具体步骤)。
(4)实验室检验I2的方法是 。
(5)甲物质见光易变黑,其原因是(用化学方程式表示) 。
(6)(1)溶解银的硝酸应该用 硝酸(填浓或稀)。原因是
。
30.(共16分)
Ⅰ(6分)矿泉水一般是由岩石风化后被地下水溶出其可溶部分生成的。风化作用是指矿物与水和CO2同时作用的过程。例如:以下是黑云母(一种硅酸盐)这种矿物风化成高岭石![]() (一种硅酸盐)的反应为:
(一种硅酸盐)的反应为:
![]() (未配平),回答下列问题:
(未配平),回答下列问题:
(1)把上述反应方程式配平的系数依次为
(2)上述反应发生的理由是 。
(3)地球化学中,通常用热重分析法研究矿物在受热时质量变化以确定其组成。加热黑云母到673K—1123K区间内分解为相应的氧化物,试计算黑云母失重的百分比为 (计算结果保留三位有效数字)
Ⅱ(10分)某化学反应的反应物和产物如下:
![]()
(4)该反应的氧化物是 。
(5)如果该反应方程式中HBrO3和O2的系数都是1,则
①HF的系数是 。
②在此方程式中,转移的电子数为 mol,被H2O还原的BrF3为 mol。
(6)如果没有对该方程式中的某些系数作限定,可能的配平系数有许多组。原因是
。
五、(本题包括2大题,共22分)
31.(10分)回答下列问题(不要求写出计算过程,)
(1)为减少大气污染,一些城市公共汽车逐步使用CNG(压缩天然气)清洁燃料,实验测得0.16g该气体燃料,完全燃烧生成224ml CO2(标准状况)和0.36g液态水,并放出8.903kJ的热量。请写出:CNG的化学式 ,其完全燃烧的热化学方程式
。
(2)拆开1mol H—H键,1mol N—H键,1mol N≡N键分别需要的能量是436kJ、391kJ、946kJ,则生成1molNH3的反应热为 。
(3)已知:H2O(g)=H2O(l) △H=Q1KJ/mol
C2H5OH(g)=C2H5OH(l) △H=Q2KJ/mol
C2H5OH(g)+3O2(g)=2CO2(g)+3H2O(g)△H=Q3KJ/mol;则23g酒精液体完全燃烧的反应热为 。(最后恢复到室温)
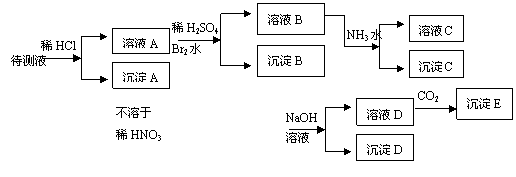
32.(12分)某待测溶液中可能含有Fe2+、Fe3+、Ag+、Al3+、Ba2+、Ca2+、NH4+等离子,进行如下实验(所加酸、碱、氨水、溴水CO2都是过量的)。
|
根据实验结果:
(1)判定待测液中有无Ba2+、Ca2+离子: 。理由是: 。
(2)写出沉淀D的分子式: 。
(3)写出从溶液D生成沉淀E的反应的离子方程式: 。
(4)写出从溶液B生成沉淀C的反应的离子方程式: 。
参考答案
一、选择题(每题只有一个正确答案,每题2分,共30分)
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 |
| 答案 | D | C | C | D | C | A | A | C | D | B | A | A | B |
| 题号 | 14 | 15 | 16 | 17 | 18 | 19 | 20 | 21 | 22 | 23 | 24 | 25 | |
| 答案 | C | B | AB | BC | B | A | D | D | C | D | C | BD |
三、(本题包括3大题,共28分)
26.(10分)
(1)①让一束可见光分别照射两瓶无色液体,在另一侧可见到一条光亮的通路的为淀粉胶体。(2分,其他合理答案也得2分)
②麦芽糖(2分,其他答案得0分),渗析(2分,其他答案得0分)。
③FeCl3+3H2O=Fe(OH)3(胶体)+3HCl(2分,其他答案得0分)。
④有红褐色沉淀生成(1分),硫酸过量时,沉淀溶解生成棕黄色溶液(1分)
27.(8分)(1)5.8L 5.4L (各2分)
(2)![]() (4分)
(4分)
28.(共10分)
(1)KCl AgNO3(2分,每个1分),与其他溶液混合时只生成一种沉淀的是KCl,且生成的是AgCl,所以A是KCl,G是AgNO3(2分)
(2)①Na2SO4的电子式(2分) ②MgCl2=Mg2++Cl-(2分)
③![]() (2分)
(2分)
四、(本题包括2大题,共30分)
29.(14分)(1)FeI2 FeCl3(2分,每个1分);(2)c(2分)
(3)升华、凝华、萃取、分液、减压蒸馏(2分,每个1分)
(4)将I2加在淀粉溶液中,溶液显蓝色(2分)
|
(5)2AlI===== 2Ag +I2 (2分)(6)稀(2分),减少过程中产生NOx的量;节生硝酸物质的量(2分,每个1分)
30.(共16分)
Ⅰ(6分)(1)2、14、1、2、6、14、4、1(2分,其他答案得0分)。(2)强酸制备弱酸或H2CO3的酸性强于H4SiO4或H4SiO4是更弱的酸或更弱的电解质(2分,但答H2SiO3得0分,其他合理答案地2分)。
(3)4.33%(2分,其他答案得0分)。
Ⅱ(10分)(4)HbrO3和O2(2分,每个1分);(5)①9(2分)
②6、4/3(4分,每个2分);(6)氧化产物有HbrO3和O2两个,无法确定两者的系数(比);
五、(本题包括2大题,共22分)
31(10分)
(1)CH4(2分),CH4(g)+2O2(g)==CO2(g)+2H2O(l) △H=-890.3Kj/mol(2分)
(2)-46KJ/mol(3分)
(3)(3Q1-Q2+Q3)/2 KJ/mol(3分)
32.(12分)
(1)Ba2+、Ca2+离子至少有一种(2分,答有Ba2+离子、有Ca2+离子和两种离子都有得2分;只答有Ba2+或Ca2+离子或Ba2+、Ca2+离子都有得0分);理由:硫酸钡、硫酸钙都不溶于水(2分)(2)Fe(OH)3(2分);
(3)![]() (2分)
(2分)
(4)![]() (4分,每个2分)
(4分,每个2分)