高三年级化学上学期月考试题
化 学 试 题(12.18)
本试卷分选择题和非选择题两部分,共8页,满分150分,考试用时120分钟。
注意事项:
1.答卷前,考生务必用黑色字迹的钢笔或签字笔将自己的姓名、考号填写在答题卡上。
2.选择题每小题选出答案后,用2B铅笔把答题卡上对应题目的答案标号涂黑;如需改
动,用橡皮擦干净后,再选涂其它答案;不能答在试卷上。
3.非选择题必须用黑色字迹的钢笔或签字笔作答,答案必须写在另发的答题卷各题目
指定区域内的相应位置上;如需改动,先划掉原来的答案,然后再写上新的答案;
不准使用铅笔和涂改液,不按以上要求作答的答案无效。
4.考生必须保持答题卡的整洁,考试结束后,将本试卷和答题卡一并收回。
相对原子质量:H:1 O:16 C:12 N:14 F:19 Cl:35.5 Br:80 Si 28 Na:23 Mg:24 Al:27 K:39 Cu:64 Ca:40 Fe:56 Zn:65 Ag:108 Cr 52
第Ⅰ卷(选择题,70分)
一、选择题(每题只有一个正确答案,每小题3分,共30分)
1.化学与科技、社会、生产密切结合,下列有关说法不正确的是
A.“乙醇汽油”的广泛使用能有效减少有害气体的排放
B.“无磷洗涤剂”的推广使用,能有效减少水体富营养化的发生
C.“无氟冰箱”取代“含氟冰箱”,对人类的保护伞——臭氧层起到保护作用
D.“海水淡化”可以解决“淡水供应危机”,向海水中加入净水剂明矾可以使海水淡化
2.将石墨置于熔融的钾或气态的钾中,石墨会吸收钾而形成钾石墨,其结成可以是C8K、C24K、C36K和C48K。在钾石墨中,钾元素处于石墨层中间,因石墨层之间被胀大,层间的距离增加。下列对钾石墨的叙述中,不正确的是
A.钾石墨中可能存在K+ B.钾石墨与水相遇,可能发生化学反应
C.钾石墨导电性比石墨强 D.C8K、C24K、C36K和C48K同属于同素异形体
3.沼气是一种能源,它的主要成分是CH40.5molCH4完全燃烧生成CO2和H2O时,放出
445kJ热量,则下列热化学方程式中正确的是 ( )
A.2CH4 (g)+4O2 (g) = 2CO2 (g)+4H2O(l) △H=+890kJ·mol-1
B.CH4 (g)+2O2 (g) = CO2 (g)+2H2O(l) △H=+890kJ·mol-1
C.CH4 (g)+2O2 (g) = CO2 (g)+2H2O(l) △H=-890kJ·mol-1
D.1/2 CH4 (g)+O2 (g) = 1/2CO2 (g)+H2O(l) △H=-890kJ·mol-1
4.甲、乙两种物质的溶解度曲线如下图所示:下列说法一定正确的是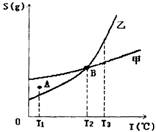
A.A点表示示T1℃时甲的溶液已饱和,乙的溶液未饱和
B.B点表示T2℃时甲、乙两物质的溶液均达饱和且两溶液的物质的量浓度相等
C.将T3℃(时甲、乙两物质的饱和溶液分)分别降温至T2℃,析出的乙比析出的甲多
D.若乙中含有少量的甲,可用重结晶的方法提纯乙
5.下列各组离子在指定条件下,一定能大量共存的是
A.PH为1的无色溶液:K+、Fe2+、SO42-、NO3-、Cl-
B.能使碘化钾淀粉试纸变蓝的溶液:Na+、NH4+、S2-、Br-
C.水电离出的c(H+)=10-12mol/L的溶液:Ba2+、Na+、NO3-、Cl-
D.加入铝条有氢气放出的溶液:Na+、NH4+、HCO3-、NO3-
6.下列实验操作正确的是
A.用湿润的pH试纸测定某溶液的pH
B.使用碱式滴定管盛装KMnO4溶液滴定Na2SO3溶液
C.将3滴浓硫酸滴入蓬松的脱脂棉中搅拌加热,再在其中加入新制的Cu(OH)2悬浊液并加热至沸腾,可证明纤维素的水解
D.用热水加热乙醛和银氨溶液的混合液做乙醛的银镜实验
7.化学工作者一直关注食品安全,发现有人将工业染料“苏丹红1号”非法用作食用色素。苏丹红是一系列人工合成染料,其中“苏丹红4号”的结构式如下:
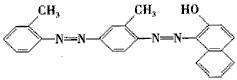
下列关于“苏丹红4号”说法正确的是
A. 不能发生加成反应 B. 属于芳香烃
C. 可以使酸性高锰酸钾溶液褪色 D. 属于甲苯同系物
8.有温度相同、体积也相同的三个密闭容器a、b、c,今在a中充入1molN2和3molH2,在b中充入3molNH3,在c中充入2molN2和6molH2,经过足够长时间后,三容器均达到平衡状态,则平衡时三个容器中NH3的体积百分含量最大的是( )
A.a大 B.b大 C.c大 D.无法确定
9.不具有放射性的同位素称之为稳定同位素.稳定同位索分析法在近20年来植物生理学、生态学和境科学研究中获得广泛应用。如在陆地态系统研究中2H、13 C、15 N、18O、34S等常用作环境分析指示物下列说法正确的是
A.34S原子核内中子数为16
B.1H216O在相同条件下比1H218O更易蒸发
C.13C和15N原子核内的质子数相差2
D.2H+的酸性比1H+的酸性更强
10.. 据报道,N5是破坏力极强的炸药之一,18O2是比黄金还贵重的物质。下列说法正确的是
A. 18O2中含18个中子 B. 原子半径:N<18O
C. N5和N2互为同位素 D. 2N5 = 5N2是化学变化
二、选择题(每题有一个或两个正确答案,多选、错选得0分,漏选得2分,每题4分,共40分)
11.制印刷电路时常用氯化铁溶液作为“腐蚀液”,发生的反应为2FeCl3+Cu=2FeCl2+CuCl2 。向盛氯化铁溶液的烧杯中同时加入铁粉和铜粉,反应结束后,下列结果不可能出现的是
A.烧杯中有铜无铁 B.烧杯中有铁无铜 C.烧杯中铁铜都有 D.烧杯中铁铜都无
12.右图是NaCl晶体的一个晶胞结构模型。KO2的晶体结构与NaCl相似,KO2可以看作是Na+的位置用K+代替,Cl-位置用O2-代替,则关于KO2晶体结构的描述正确的是
A.与K+距离相等且最近的O2-共有8个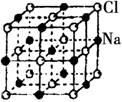
B.与K+距离相等且最近的O2-构成的多面体是8面体
C.与K+距离相等且最近的K+有8个
D.一个KO2晶胞中摊得的K+ 和O2- 粒子数均比为1:2
13.X、Y、Z为短周期元素,X原子的最外层只有一个电子,Y原子的最外层电子数比内层电子总数少4,Z原子的最外层电子数是内层电子总数的三倍。下列有关叙述正确的是
A.X、Y、Z三种元素可形成化合物X3YZ4
B.X、Y两元素形成的化合物只能为离子晶体
C.Y、Z 两元素形成的化合物熔点较低
D.氢化物的稳定性:Y<X
14.最近有人用一种称为“超酸”的化合物H(CB11 H6 Cl6)和C60反应,使C60获得一个质子,得到一种新型离子化合物[HC60]+[CB11 H6 Cl6]-。这个反应看起来很陌生,但反应类型 跟下列一个化学反应相似,你认为该反应是 ( )
A.Mg+2HCl == MgCl2 +H2↑ B.NaOH+HCl = NaCl+H2 O
![]() C.NH3 +HCl =NH4 Cl D.H2 O+CH3 COOH H3 O++CH3 COO-
C.NH3 +HCl =NH4 Cl D.H2 O+CH3 COOH H3 O++CH3 COO-
15.将a g Fe2O3、Al2O3样品溶解在过量的200mL pH=1的硫酸溶液中,然后加入NaOH溶液使Fe3+、Al3+刚好完全沉淀,用去NaOH溶液100 mL,则NaOH溶液的浓度为
A.0.1 mol·L-1 B.0.2mol·L-1 C.0.4 mol.L-1 D.0.8mol·L-1
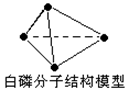 16阿伏加德罗常数约为NA列叙述中正确的是
16阿伏加德罗常数约为NA列叙述中正确的是
A.31g 白磷分子(P4)中含有P—P键个数为1.5NA
B.48gO2和48gO3所含分子数为3NA
C.1.0L 1mol/L氨水中,NH3·H2O的分子数为NA
D.20g 重水(D2O)中含有的中子数为8NA
17.下列离子方程式正确的是
A.向沸水中滴加FeCl3溶液制备Fe(OH)3胶体:Fe3++3H2O=Fe(OH)3↓+3H+
B.用小苏打治疗胃酸过多:HCO3-+H+=CO2↑+H2O
C.实验室用浓盐酸与MnO2反应制Cl2: MnO2+2H++2Cl-=Cl2↑+Mn2++H2O
D.漂白粉溶液中通入的二氧化硫2ClO++H2O+SO2=SO32-+2HClO
18.下列各组原子中,彼此化学性质一定相似的是
A. 原子核外电子排布为1S2的X原子与原子核外电子排布为1S22S2的Y原子
B. 原子核外M层上仅有两个电子的X原子与原子核外N层上仅有两个电子的Y原子
C.2P能级上只有一个电子对的X原子和3P能级上只有一个电子对的Y原子
D.最外层只有一个电子的X、Y原子
19.将等浓度的K2S溶液和NaHSO4溶液等体积混合,得到的溶液中离子浓度关系正确的是(CD)
A.c(K+)>c(Na+)> c(H+)>c(OH-)
B.c(Na+)+ c(K+)+ c(H+)= c(SO42-)+ c(HS-)+ c(OH-)+c(S2-)
 C.c(SO42-)> c(HS-)> c(OH-)> c(H+)
C.c(SO42-)> c(HS-)> c(OH-)> c(H+)
D.c(K+)=c(S2-)+ c(H2S)+c(HS-)+c(SO42-)
20.右图是温度和压强对X + Y ![]() 2Z 反应影响的示 意图。图中横坐标表示温度,纵坐标表示平衡混合气体中Z的体积分数。下列叙述正确的是
2Z 反应影响的示 意图。图中横坐标表示温度,纵坐标表示平衡混合气体中Z的体积分数。下列叙述正确的是
A.上述可逆反应的正反应为放热反应
B.X、Y、Z均为气态
C.X和Y中只有一种是气态,Z为气态
D.上述反应的逆反应的△H>0
第Ⅱ卷(共80分)
三、填空题(本题包括3小题,共30分)
21.10分)(1)有常用玻璃仪器组成的下列六种实验装置(根据需要可在其中加入液体或固体)
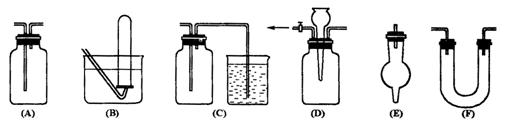
①能用做干燥二氧化硫气体的装置有 ;(填代号,下同)
②既能用于收集氯气又能用于收集一氧化氮气体的装置有 ;
③在氯气和铁反应实验中,能添加在制气和化合反应装置之间以除去氯气中氯化氢等杂质气体的装置有 ;
④在乙烯与溴水反应制二溴乙烷的实验中,能添加在制乙烯装置和加成反应装置之间,达到控制气流使其平衡目的的是 ;
⑤若用C装置做二氧化硫与烧杯中氢氧化钠溶液反应实验,则其中广口瓶的作用是 。
22.10分)(1)把淀粉溶液溶于沸水中,制成淀粉胶体,回答下列问题。
①鉴别水溶液和胶体可以利用的方法是 。
②60℃左右时,在淀粉胶体中加入淀粉酶,充分反应。然后把反应后的全部液体装入半透膜袋里,系紧袋口,并把它悬挂在盛有蒸馏水的烧杯里。从半透膜里析出的物质是 ,该操作的名称是 。
(2)把少量的饱和氯化铁溶液滴入沸水中,制成Fe(OH)3胶体,回答下列问题。
③试写出上述反应的化学方程式 。
④向Fe(OH)3胶体中滴入硫酸直到过量,是描述此过程的实验现象
23.(10分)
在足量的稀氯化亚铁溶液中,加入1~2滴液溴,振荡后溶液变为黄色。甲同学认为这不是发生化学反应所致,使溶液变黄色的物质是Br2;乙同学认为这是发生化学反应所致,使溶液变黄色的物质是Fe3+
(1)现提供以下试剂:
A.酸性高锰酸钾溶液 B.氢氧化钠溶液 C.四氯化碳 D.硫氰化钾溶液
请你判断哪位同学的推断是正确的,并用两种方法加以验证,写出选用的试剂编号及实验中观察到的现象:
| ________同学正确 | 选用试剂 | 实验现象 |
| 第一种方法 |
|
|
| 第二种方法 |
|
|
(2)若选用淀粉碘化钾溶液来判断哪位同学的推断是正确的,你认为是否可行?____
理由是:____________________________________________________________
根据上述实验推测,若在稀溴化亚铁溶液中通入氯气,首先被氧化的离子是__________
写出在稀溴化亚铁溶液中通入足量氯气时的离子方程式:_______________________
四、(本题包括2题,共20分)
24.(10分)有A、B、C、D、E、F六种元素,已知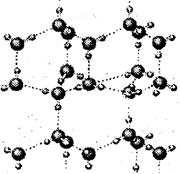 :它们位于三个不同短周期,核电荷数依次增大:A与E、B与F分别同主族;A、E分别都能与D按原子个数比1∶1或2∶l形成化合物;B、C分别都能与D按原子个数比1∶1或1∶2形成化合物。
:它们位于三个不同短周期,核电荷数依次增大:A与E、B与F分别同主族;A、E分别都能与D按原子个数比1∶1或2∶l形成化合物;B、C分别都能与D按原子个数比1∶1或1∶2形成化合物。
(1)写出只含有A、B、D、E四种元素的两种无水盐的化学式_____________、_____________。
(2)右图是A与D形成的一种化合物的晶体结构示意图,其中的虚线表示___________,与每个“构成粒子”相邻的粒子呈______________空间构型。A与D按原子个数比l∶l形成的化合物的电子式为__________________。
(3)人们通常把拆开1mol某化学键所吸收的能量看成该化学键的键能。键能的大小可以衡量化学键的强弱,也可以用于估算化学反应的反应热(△H),化学反应的△H等于反应中断裂旧化学键的键能之和与反应中形成新化学键的键能之和的差。下表列出了上述部分元素形成的化学键的键能:
| 化学键 | F—D | F—F | B—B | F—B | C—D | D—D |
| 键能/kJ·mol-1 | 460 | 176 | 347.7 | 347 | 745 | 497.3 |
①下列三种物质形成的晶体。熔点由高到低的顺序(用a、b、c表示):_________________
a.F与B形成的化合物 b.B与D形成的稳定化合物 c.F的单质
②试估算F单质品体的燃烧热:_____________________________________
25.(10分)
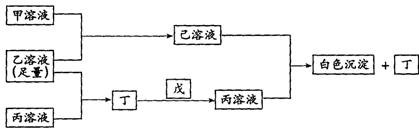 |
有A、B、C三种常见的短周期元素,它们的原子序数逐渐增大,B元素原子最外层电子数是C元素原子最外层电子数的一半,A元素最外层电子数比B多一个。甲、乙、丙是3种含氧酸的钠盐,甲中含B元素,乙中含C元素,丙中含A元素,甲、丙溶液pH>7,乙溶液pH<7;丁为气体,戊为淡黄色固体。甲、乙、丙、丁、戊、己六种物质之间的相互反应关系如下图:
请回答:
(1)写出C元素的核外电子排布式_____ ;
写出戊的电子式___________________;
(2)用有关化学用语解释:乙溶液呈酸性的原因______________________________;
丙溶液呈碱性的原因_____________________________;
(3)写出有关反应的离子方程式:
①乙溶液+丙溶液→丁______ ________________________;
②己溶液+丙溶液→丁_________ _____________________。
五、(本题包括2小题,共16)
26.(7分)
醛可以发生分子间的反应,生成羟基醇。如:
![]()
Ⅰ.根据上述信息,回答下列问题:
(1)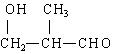 可由
与
两种醛合成。
可由
与
两种醛合成。
(2)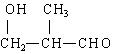 转化为
转化为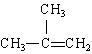 须依次经过 、
、
须依次经过 、
、
等较为合理的反应过程(填写反应类型名称)。
27.(9分)
已知烯烃在发生加成反应时,加成试剂中的氢总是加在含氢较多的不饱和碳上。
![]()
回答问题:
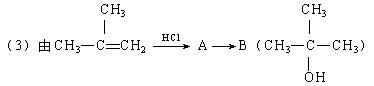
①写出A→B反应的化学方程式: (应注明反应条件)。
②写出生成A的反应化学方程式 (应注明反应条件)。
③的同分异构体(不包括A)共有 种。
五、计算题(14分)
28.
实验室用50ml浓盐酸跟足量的氯酸钾固体共热制取氯气,反应的化学方程式为(未配平):
KClO3 + HCl -- KCl + Cl2 ↑+ H2O
(1)配平上述反应化学方程式:
____ KClO3 +___ HCl ==__ KCl +__ Cl2 ↑+__ H2O
(2)浓盐酸在反应中显示出来的性质是 (填写编号)。
①只有还原性 ②还原性和酸性 ③只有氧化性 ④氧化性和酸性
(3)若产生0.1molCl2,则转移电子的物质的量为 mol.
(4)若反应中HCl的利用率只有50%,当氧化产物比还原产物多7.1g时,求浓盐酸的物质的量浓度
答案
21.(1)AEF (2)AB (3)AF(或AE) (4)D (5)除杂和防止倒吸
22. (10分)(1)①让一束可见光分别照射两瓶无色液体,在另一侧可见到一条光亮的通路的为淀粉胶体。(2分,其他合理答案也得2分)
②麦芽糖(2分,其他答案得0分),渗析(2分,其他答案得0分)。
(2) ③FeCl3+3H2O=Fe(OH)3(胶体)+3HCl(2分,其他答案得0分)。
④有红褐色沉淀生成(1分),硫酸过量时,沉淀溶解生成棕黄色溶液(1分)
23. (1)每个1分共5分
| ___乙__同学正确 | 选用试剂 | 实验现象 |
| 第一种方法 | C | 有机层无色 |
| 第二种方法 | D | 溶液变红 |
(2)不可以,因为Br2和Fe3+都能把I氧化成I2(2分)
Fe2+;(1分) 2 Fe2++4Br-+3C12====2Fe3++2Br2+6Cl- (2分)
24. (1)NaHCO3 (1分)CH3COONa(1分)(或其它有机酸的盐)
(2)氢键(1分) 正四面体(1分) HOOH( 2分)
(3)①acb (2分)②990.7kJ/mol(2分)
25.、(每空2分)(1) 1S22S83S23P4
 (2)NaHSO4=Na++H++SO42-、NaHSO4在水溶液中完全电离出氢离子使溶液呈酸性
(2)NaHSO4=Na++H++SO42-、NaHSO4在水溶液中完全电离出氢离子使溶液呈酸性
![]() CO32-+H2O HCO3-+OH-、CO32-水解使溶液呈碱性(每空方程式1分,叙述1分)
CO32-+H2O HCO3-+OH-、CO32-水解使溶液呈碱性(每空方程式1分,叙述1分)
(3)2H++CO32-=H2O+CO2↑;(方程式2分)
2Al3++3CO32-+3H2O=2Al(OH)3↓+3CO2↑(方程式2分)
26. (1)HCHO (2分);CH3CH2CHO (2分)
(2)消去;加成;消去 (3分)
27.(9分)
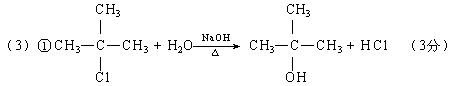
② 略 ③3 (3分)
28. (1). 1、6、6、3、3 (2)② (3)0.5 (4)10mol/L
29.4mol/L、6mol/L