高三年级化学上学期第二次质量检测
化 学 试 题
可能用到的相对原子质量:H 1 He 4 Li 7 C 12 N 14 O 16 Na 23 Mg 24
S 32 Cl 35.5 Ca 40 Fe 56 Cu 64 Ag 108
第Ⅰ卷(共48分)
一、选择题(本题包括8小题,每小题3分,共24分。每小题只有一个选项符合题意)
1.长征2号火箭承担运载“神六”的使命。氢化锂、氘化锂、氚化锂可以作为启动长征2号
(CZ2F)火箭发射的优良炸药。下列说法正确的是 ( )
A.LiH,LiD,LiT的摩尔质量之比为1:2:3
B.它们都是强氧化剂
C.H、D、T之间互称同素异形体
D.它们都是强还原剂
2.下列化学用语表达正确的是 ( )
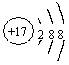
A.S2—的结构示意图: B.乙炔的结构简式CHCH
![]()
![]()
C.NaCl的电子式: D.硝基苯的结构简式:
3.下列有关说法正确的是 ( )
A.CaCl2、聚苯乙烯、HD均为化合物
B.CH2O2、C3H6O2、C4H8O2互为同系物
C.明矾、冰醋酸、硫酸钡均为电解质
D.SiO2、NaCl、S8、Cu均能表示物质分子组成
4.根据所学知识,下列有关胶体的说法中正确的是 ( )
A.将饱和的FeCl3溶液加热至沸,制得Fe(OH)3胶体
B.将磁性物质制成胶体粒子作为药物的载体,可在磁场作用下送到病灶
C.化工生产上可利用丁达尔效应将油漆粒子均匀地沉积在镀件上
D.将氯化钠分散在酒精中,不可能形成胶体
5.从下列事实所列出的相应结论正确的是 ( )
| 实 验 事 实 | 结 论 | |
| A | Cl2的水溶液可以导电 | Cl2是电解质 |
| B | SO2通入硝酸钡溶液出现白色沉淀 | BaSO3不溶于强酸 |
| C | NaHCO3溶液与NaAlO2溶液混合产生白色沉淀 | 酸性:HCO3->H3AlO3 |
| D | 常温下白磷可自燃而氮气须在放电时才与氧气反应 | 非金属性:P>N |
6.通过复习总结,你认为下列对化学知识概括合理的是 ( )
A.氧化物不可能是还原产物,只可能是氧化产物
B.一种元素可能有多种氧化物,但同种化合价只对应一种氧化物
C.原子晶体、离子晶体、金属晶体、分子晶体中都一定存在化学键
D.原子晶体熔点不一定比金属晶体高,分子晶体熔点不一定比金属晶体低
7.下列分子中,所有原子都满足最外层为8电子结构的是 ( )
A.CO2 B.SiH4 C.SF6 D.PCl5
8.现有t℃时质量分数为a %的KNO3溶液m g,将其分成质量比为1∶2的甲、乙两份溶液。甲溶液蒸发5 g水,恢复到原温度时析出晶体2 g;乙溶液蒸发12 g水,恢复到原温度时析出晶体5 g。则t℃时,KNO3溶解度为 ( )
A.41.7 g B.50 g C.43 g D.60 g
二、选择题(本题包括8小题,每小题3分,共24分。每小题只有一个选项符合题意)
9.钡在氧气中燃烧时的得到一种钡的氧化物晶体,起结构如下图所示,有关说法正确的是
( )
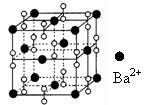 A.该晶体晶胞结构与CsCl相似
A.该晶体晶胞结构与CsCl相似
B.晶体的化学式为Ba2O2
C.该晶体属于离子晶体
D.与每个Ba2+距离相等且最近的Ba2+共有20个
10.NA代表阿伏加德罗常数的值,下列说法正确的是 ( )
A.4 g重水(D2O)中所含质子数为0.2NA
B.在通常状况下,22.4 LH2和4 gHe均含有NA个分子
C.8.0 g Cu2S和CuO的混合物中约含有铜原子数为0.1NA
D.常温常压下,0.1mol铁与0.1molCl2充分反应,转移的电子数约为0.3NA
11.已知反应: ( )
①101kPa时,2C(s)+O2(g)=2CO(g);ΔH=-221kJ/mol
②稀溶液,H+(aq)+OH-(aq)=H2O(l);ΔH=-57.3kJ/mol
下列结论正确的是
A.碳的燃烧热等于110.5kJ/mol
B.①的反应热为221kJ/mol
C.稀硫酸与稀NaOH溶液反应生成2mol水的反应热为ΔH=-114.6kJ/mol
D.稀醋酸与稀NaOH溶液反应生成1mol水,放出57.3kJ热量
12.下列各组离子,在指定的环境中一定能大量共存的是 ( )
A.在c(H+)/c(OH-)=1×1012的溶液中:I-、Cl-、HCO3—、Na+
B.在能使pH试纸变红色的溶液中:Na+、S2—、NO3—、CO32—
C.在加入铝粉能产生H2的溶液中:NH4+、Fe2+、SO42—、Cl—、
D.由水电离出的c(H+)=1×10-12mol·L-1的溶液中:K+、Cl-、NO3—、Na+
13.下列反应的离子方程式正确的是 ( )
A.碳酸氢铵溶液与足量氢氧化钠溶液反应:NH4++OH-=NH3·H2O
B.向明矾溶液中逐滴加入Ba(OH)2溶液至SO42-恰好沉淀完全:
2Al3++3SO42-+3Ba2++6OH-=2Al(OH)3↓+3BaSO4↓
C.1 mol/L的NaAlO2溶液和2.5 mol/L的HCl等体积互相均匀混合:
2AlO2-+5H+ = Al(OH)3↓+H2O
D.向硫酸亚铁溶液中加入过氧化氢溶液:2Fe2++2H++H2O2=2Fe3++2H2O
14.短周期的三种元素分别为X、Y和Z,已知X元素的原子最外层只有一个电子;Y元
素原子的M电子层上的电子数是它K层和L层电子总数的一半;Z元素原子的L电子
层上的电子数比Y元素原子的L电子层上电子数少2个.则这三种元素所组成的化合
物的化学式不可能是 ( )
A.![]() B.
B.![]() C.
C.![]() D.
D.![]()
15.标准状况下,用1L水吸收aL氨气后制得浓度为12. 0 mol·L-1、密度为0.915 g·cm-3的氨水。则a的值约为(本题中水的密度以1.00g·cm-3计) ( )
A.12 B.268.8 C.378 D.915
16.Cu2S与一定浓度的HNO3反应,生成Cu(NO3)2、CuSO4、NO2、NO和H2O,当NO2和NO的物质的量之比为1∶1时,实际参加反应的Cu2S与HNO3的物质的量之比为( )
A.1∶7 B.1∶9 C.1∶5 D.2∶9
第Ⅱ卷(共52分)
三、(本题包括2小题,共16分)
17.(2分)下列实验操作或设计正确的是 。
A.中和热测定实验中使用大小相同的两个烧杯和容积相等的两个量筒。
B.利用溴水或酸性高锰酸钾证明亚硫酸钠具有氧化性。
C.为确定Na2HPO4与CaCl2溶液反应后生成的白色沉淀是难溶的Ca3(PO4)2 ,还是难溶的CaHPO4,可取反应后的上层清液,测定其pH来判断。
D.用测定熔点的方法确定某物质是纯净物还是混合物。
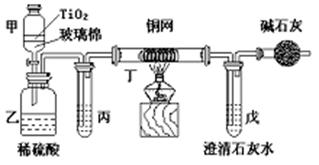
18.电镀厂曾采用有氰电镀工艺,处理有氰电镀的废水时,可在催化剂TiO2作用下,先用NaClO将CN-离子氧化成CNO-,再在酸性条件下继续被NaClO氧化成N2和CO2。环保工作人员在密闭系统中用下图装置进行实验,以证明处理方法的有效性,并通过测定二氧化碳的量确定CN-被处理的百分率。
|
将浓缩后含CN-离子的污水与过量NaClO溶液的混合液共200 mL(其中CN-的浓度为0.05 mol·L-1)倒入甲中,塞上橡皮塞,一段时间后,打开橡皮塞和活塞,使溶液全部放入乙中,关闭活塞。回答下列问题:
(1)(2分)在NaClO与CN-离子第一步反应过程中,被还原的元素是
(2)(2分)甲中反应的离子方程式为 ,
(2分)乙中反应的离子方程式为 。
(3)(6分)乙中生成的气体除N2和CO2外,还有HCl及Cl2等副产物。丙中加入的除杂试剂是饱和食盐水,其作用是 ,
丁在实验中的作用是 ,装有碱石灰的干燥管的作用是 。
(4)(2分)戊中盛有含Ca(OH)2 0.02mol的石灰水,若实验中戊中共生成0.82 g沉淀,则该实验中测得CN-被处理的百分率等于 。
四、(本题包括4小题,共24分)
19.(1)(3分)配平以下氧化还原反应方程式:
![]()
(2)(3分)家用液化气中主要成份之一是丁烷,当10 kg丁烷完全燃烧并生成二氧化碳和液态水时,放出热量5×105 kJ,试写出丁烷燃烧反应的热化学方程式:
。
20.(6分)同族元素的同类物质的结构、性质既有相似性,也有特殊性。回答下列问题:
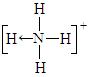 (1)已知酸性FCH2COOH>CH3COOH,试推断:①BrCH2COOH、②ClCH2COOH、③FCH2COOH的酸性由强到弱的顺序(填序号)_________________。
(1)已知酸性FCH2COOH>CH3COOH,试推断:①BrCH2COOH、②ClCH2COOH、③FCH2COOH的酸性由强到弱的顺序(填序号)_________________。
(2)已知P4、NH4+、N4H44+的空间构型均为四面体,NH4+的结构式为
(→表示共用电子对由N原子单方面提供)。
请画出N4H44+的结构式_____________________。
21.(6分)A、B两元素,A的原子序数为X,A、B所在周期的元素数目分别为m和n,如A、B同在ⅠA族,当B在A的上周期时,B的原子序数为(1)____ ;
如A、B同在ⅦA族,当B在A的上周期时,B的原子序数为(2)__ ;当B在A的下周期,B的原子序数为(3) _ 。
22.(6分)国务院强调,“南水北调”工程必须坚持节水、治污和生态环境保护与工程建设相协调,以水资源合理配置为主线,把节水、治污、生态环境保护与调水作为一个完整的系统来分析的原则。在调水工程中,沿途工业污水的任意排放是造成水质恶化的最大隐患。检测某工厂废液中,含有大量的Mg2+、Al3+、Cu2+、Ag+。试分析回答下列问题:
(1)该废液中可能大量存在的一种阴离子是 (填序号)。
A.S042- B.NO3- C.Cl— D.CO32-
(2)经检测废液中铝元素的含量较高,需将其与其它三种离子分开,请选用合适的试剂,写出铝元素与该试剂反应时的离子方程式 。
(3)为了回收废液中的金属银,某同学设计了如下图所示的方案:
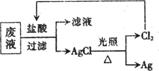 |
若依该方案获得Agl08g,为保证不污染环境和Cl2的循环利用,理论上应提供标准状况下的H2体积为 L。
五、计算题(本题包括2小题,共12分)
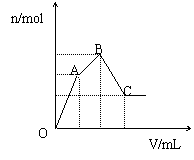 23.向100mL 3 mol·L-1的NH4Al(SO4)2溶液中逐滴加入
23.向100mL 3 mol·L-1的NH4Al(SO4)2溶液中逐滴加入
1 mol·L-1 Ba(OH)2溶液.
(1)(3分)写出当沉淀的总物质的量为最大值时的离子方
程式(用一个式子表示):
.
(2)(4分)随着Ba(OH)2溶液体积V的变化,沉淀总物质的量n的变化
如图所示.写出B点和C点所对应的Ba(OH)2溶液的体积:B mL,C mL.
24.硝酸工业生产中的尾气可用纯碱溶液吸收,有关的化学反应为:
2NO2 + Na2CO3 → NaNO2 + NaNO3 + CO2↑ ①
NO + NO2 + Na2CO3 → 2NaNO2 + CO2↑ ②
(1)(2分)根据反应①,每产生22.4L(标准状况下)CO2,吸收液质量将增加__________g。
(2)(3分)现有1000g 质量分数为21.2%的纯碱吸收液,吸收硝酸工业尾气,每产生22.4L(标准状况下)CO2时,吸收液质量就增加44g。计算吸收液中NaNO2 和NaNO3 的物质的量之比
参考答案
一、单项选择题(本题包括8小题,每小题3分,共24分。)
1.D 2.D 3.C 4.B 5.C 6.D 7.A 8.B
二、不定项选择题(本题包括8小题,每小题3分,共24分。)
9.C 10.C 11. C 12.D 13. D 14.B 15.C 16.A
三、(本题包括2小题,共16分,每空2分)
17.CD
18.(1)Cl(+1)
(2)CN-+ClO-![]() CNO-+Cl- 2CNO-+2H+ +3ClO-
CNO-+Cl- 2CNO-+2H+ +3ClO-![]() N2↑+2CO2↑+3Cl-+H2O
N2↑+2CO2↑+3Cl-+H2O
(3)除去HCl气体 去除Cl2 防止空气中CO2进入戊中影响测定准确度
(4)82%
四、(本题包括5小题,共24分)
19.(1)5 2 3 10 1 2 8H2O (3分)
(2)C4H10(g)+13/2O2(g)→4CO2(g)+5H2O(l); △H= —2900kJ/mol(3分)
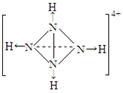
20.(1)③②①(3分) (2)(3分)
21.x-n, x-m, x+n (6分)
22.(1)B (2) Al3++4OH-=AlO2-+2H2O (3)11.2L(6分)
五、(本题包括2小题,共12分)
23.(1)Al3++2SO42-+NH4++2Ba2++4OH-=Al(OH)3↓+2BaSO4↓+NH3·H2O(3分)
(2)600mL(2分);750mL(2分)
24.(1)(2分)48
(2)(3分)①2NO2+Na2CO3→NaNO2+NaNO3+CO2↑ △m=48g
NO+NO2+ Na2CO3→2NaNO2+ CO2↑ △m=32g
设由NO2与纯碱反应产生的CO2为a mol
由NO和NO2与纯碱反应产生的CO2为b mol
![]()
![]() a+b=1
a=0.75mol
a+b=1
a=0.75mol
48a+32b=44 b=0.25mol
n(NaNO2)∶n(NaNO3)=5∶3