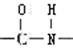高三年级化学基本理论考试试题
化学试卷
一、选择题(本题包括10小题,每小题3分,共30分。每小题只有一个选项是符合题意。)
1.遇有下列情况,及时处理有误的是 ( )
A.误食重金属盐,立即喝生牛奶或蛋清
B.皮肤不慎沾有苯酚,立即用酒精擦洗
C.金属钠着火,立刻用砂子覆灭
D.晚间进入厨房,闻有很浓的煤气味,立即开灯检查
2.下列各原了或离子的电子排布式错误的是 ( )
A.Si 1s22s22p2 B.O2- 1s22s22p6
C.Na+ 1s22s22p6 D.Al 1s22s22p63s23p1
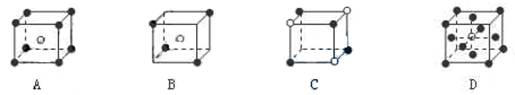
3.有下列离子晶体的空间结构示意图。图中●和化学式中M分别代表阳离子,图中○和化学式中N分别代表阴离子,则化学式为MN2的晶体结构为 ( )
|
4.氨气分子空间构型是三角锥形,而甲烷是正四面体形,这是因为 ( )
A.两种分子的中心原子子杂化轨道类型不同,NH3为sp2型杂化,而CH4是sp3型杂化。
B.NH3分子中N原子形成三个杂化轨道,CH4分子中C原子形成4个杂化轨道。
C.NH3分子中有一对未成键的孤对电子,它对成键电子的排斥作用较强。
D.氨气分子是极性分子而甲烷是非极性分子。
5.在密闭容器里,A与B反应生成C,其反应速率分别用vA、vB、vC表示,已知2 vB =3 vA、
3 vC = 2vB,则此反应可表示为 ( )
A.2A + 3B = 2C B.A + 3B = 2C
C.3A + B = 2C D.A + B =C
6.下图各容器中盛有海水,铁在其中被腐蚀时由快到慢的顺序是 ( )
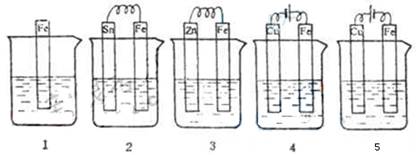
A.4>2>1>3>5 B.2>1>5>3>4
C.5>4>2>3>1 D.3>5>2>4>1
7.实验室用乙醇和浓硫酸混合加热制得的乙烯气体中含少量SO2(记为混合气体①),碳与浓硫酸共热生成的气体中有CO2和SO2(记为混合气体②)。欲除去这两种混合气体中的SO2,下列说法正确的是 ( )
A.都可通过盛有酸性KMnO4溶液的洗气瓶
B.都可通过盛有NaOH溶液的洗气瓶
C.①可用酸性KMnO4溶液洗气,②可用NaOH溶液洗气
D.①可用NaOH溶液洗气,②可用酸性KMnO4溶液洗气
|
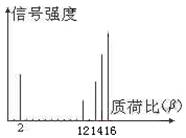
样品的质荷比如下图(假设离子均带一个单位正电
荷,信号强度与该离子多少有关),则该有机物可
能是: ( )
A.CH3OH B.C3H8
|
9.某有机物的分子结构如下表示: CH ,该分子中最多可以有多少个原子共平面: ( )
A.19 B.20 C.21 D.22
10.在实验室里可按右图所示装置干燥收集气体R, 并吸收多余的R气,则R是( )
A.CH4 B.HCl 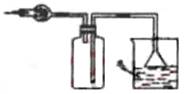
C.Cl2 D.NH3
二、选择题(本题包括10小题,每小题4分,共40分。每小题有一个或两个选项符合题意。若正确答案只包含一个选项,多选时,该题为零分;若正确答案包含两个选项,只选一个且正确的得2分,选两个且都正确的得4分,但只要选错一个,该小题就为零分)
11.95年美国教授Lagow合成了一种链式炔碳:……—C≡C—C≡C—C≡C……。该物质的一个分子中含300~500个碳原子,性质很活泼。则下列说法错误的是: ( )
A.该物质的溶点比金刚石低
B.该物质可以使溴水褪色
C.该物质属于炔烃
D.该物质与金刚石互为同素异形体
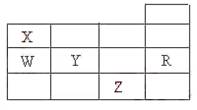
|
A.常压下五种元素的单质中,Z单质的沸点最高
B.Y、Z的阴离子电子层结构都与R原子的相同
C.W的氢化物的沸点比X的氢化物的沸点高
D.Y元素的非金属性比W元素的非金属性强
![]() 13.可以充分说明反应P (g)
+ Q (g) R (g) + S
(g)在恒温下已达到平衡的是 ( )
13.可以充分说明反应P (g)
+ Q (g) R (g) + S
(g)在恒温下已达到平衡的是 ( )
A.反应容器内的压强不随时间改变
B.反应容器内P、Q、R、S四者共存
C.P的生成速率和S的生成速率相等
D.反应容器内的气体总物质的量不随时间变化 ( )
14.已知在1×105Pa、298k条件下,2 mol氢气燃烧生成水蒸气放出484kJ热量,下列热化学方程式正确的是 ( )
A.H2O(g) = H2(g) +![]() O2(g);△H = +242kJ·mol-1
O2(g);△H = +242kJ·mol-1
B.2H2 (g) + O2(g) + 2H2O (l);△H =-484kJ·mol-1
C.H2(g) +![]() O2(g)
= H2O (g);△H = +242kJ·mol-1
O2(g)
= H2O (g);△H = +242kJ·mol-1
D.2H2 (g) + O2(g) = 2H2O (g);△H =-484kJ·mol-1
15.pH值相等的盐酸(甲)和醋酸(乙),分别与锌反应,若最后锌已全部溶解且放出气体一样多,为此下列说法正确的是 ( )
A.反应开始时的速率:甲 = 乙
B.反应所需时间:甲<乙
C.反应开始时,酸的物质的量浓度:甲<乙
D.反应结束时,pH值:甲<乙
16、如图,Ⅰ是恒压密闭容器,Ⅱ是恒容密闭容器。其它条件相同时,在Ⅰ、Ⅱ中分别加入3mol Z,起始时容器体积均为V L,发生如下反应并达到平衡(X、Y状态未知):aX(?)+2Y(?)![]() 3Z(g)。此时Ⅱ中X、Y、Z的物质的量之比为3:2:2,则下列说法一定正确的是 ( )
3Z(g)。此时Ⅱ中X、Y、Z的物质的量之比为3:2:2,则下列说法一定正确的是 ( )
 A.若X、Y均为气态,则平衡时气体平均摩尔质量:Ⅰ>Ⅱ
A.若X、Y均为气态,则平衡时气体平均摩尔质量:Ⅰ>Ⅱ
B.若X、Y不均为气态,则平衡时X的产率:Ⅰ>Ⅱ
C.若X、Y均为气态,则从起始到平衡所需时间:Ⅰ>Ⅱ
D.若X为固态,Y为气态,到达平衡后若在Ⅱ中再加入1molZ,则新平衡时Z的体积分数变小
17.在0.1mol/L的Na2S溶液中,下列判断正确的是( )
A.c(OH-) = 2c(H2S)+ c(HS-)+ c(H+)
B.c(Na+)=2c(S2-)+ 2 c(HS-)+ 2 c(H2S)
C.c(Na+)>c(S2-)> c(HS-)> c(OH-)> c(H+)
D.c(Na+)+ c(H+)=c(S2-)+ c(HS-)+ c(OH-)
18.甲基丙烯酸甲酯是世界上年产量超过100万吨的高分子单体,旧法合成的反应是:
![]() (CH3)2C=O + HCN (CH3)2
C(OH)CN
(CH3)2C=O + HCN (CH3)2
C(OH)CN
![]() (CH3)2C(OH)CN
+ CH3OH + H2SO4 CH2=C (CH3)COOCH3
+ NH4HSO4
(CH3)2C(OH)CN
+ CH3OH + H2SO4 CH2=C (CH3)COOCH3
+ NH4HSO4
![]() 90年代新法的反应是:CH3C≡CH + CO + CH3OH CH2=C (CH3)COOCH3与旧法比较,新法的优点是: ( )
90年代新法的反应是:CH3C≡CH + CO + CH3OH CH2=C (CH3)COOCH3与旧法比较,新法的优点是: ( )
A.原料无爆炸危险 B.原料都是无毒物质
C.没有副产物,原料利用率高 D.对设备腐蚀性较小
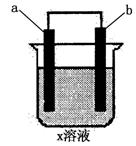
19.下列对如图所示装置实验现象的描述正确的是 ( )
| b电极 | a电极 | x溶液 | 实验现象 | |
| A | 石墨 | 石墨 | CuCl | a极质量增加,b极放出无色气体 |
| B | Fe | 石墨 | KNO | a极质量增加,b极放出无色气体 |
| C | Fe | Cu | CuSO | a极质量增加,b极质量减少 |
| D | 石墨 | 石墨 | HCl | a、b极都放出无色气体 |
20.2005年9月始,“禽流感”在全球部分地区爆发,引起了人们继“非典型性肺炎”之后的世界范围内的恐慌。做好环境消毒是预防“禽流感”的重要措施,常用的消毒剂是ClO2或Cl2等的稀溶液,其中ClO2溶液的消毒效果较好。已知ClO2常温下呈气态,其分子构型与水分子的分子构型相似,在自然环境中ClO2最终变为Cl-,下列有关说法中正确的是 ( )
A.ClO2的分子结构呈V型,属非极性分子
B.ClO2中氯元素显+4价,具有很强的氧化性,其消毒效率(以1 mol物质得电子的数目表示)是Cl2的5倍
C.ClO2、Cl2的稀溶液用于环境消毒,具有广谱高效的特点,对人畜无任何危害
D.常用Na2SO3在H2SO4的酸性条件下,还原NaClO3来制ClO2,这一反应的化学方程式可表示为Na2SO3 + 2NaCl3 + H2SO4= 2Na2SO4 + 2ClO2↑+ H2O
第二卷 非选择题(共80分)
三、(本题含3小题,共31分)
21.(8分)今有①CH3COOH、②HCl、③H2SO4三种溶液,用序号回答下列问题
(1)当它们pH相同时,其物质的量浓度由大到小排列是 。
(2)当它们的物质的量浓度相同时,其pH由大到小排列是 。
(3)中和同一烧碱溶液,需同浓度的三种酸溶液的体积关系为 。
(4)体积和浓度相同的①、②、③三溶液,分别与同浓度的烧碱溶液恰好完全反应,反需烧碱溶液的体积关系为 。
22.(12分)Ⅰ.中学课本中介绍了如下实验:把一端弯成螺旋状的铜丝放在酒精灯外焰加热,待铜丝表面变黑后立即把它插入盛有约2 mL乙醇的试管里,反复操作几次。
请你评价若用上述方法制取乙醛存在哪些不足:
_____________________________________________________________________
Ⅱ.课外活动小组甲,自行设计了下图装置进行乙醇的催化氧化实验并制取乙醛,图中铁架台等装置已略去。请回答下列问题:
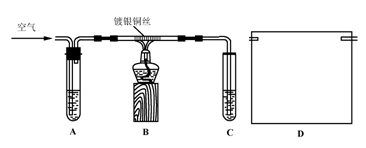
(1)实验前,首先检查装置的气密性,然后分别向试管A中加入乙醇,C中加入水;
(2)实验时,先加热B装置中的玻璃管,约1分钟后鼓入空气,此时铜丝即呈红热状态。若把酒精灯撤走,控制一定的鼓气速度,铜丝能长时间保持红热直到实验结束。
①乙醇的催化氧化反应是________反应(填“放热”或“吸热”),该反应的化学方程式为______________________________________________________;
②通入空气的速度过快或过慢都不利于反应的进行,控制气体流速的实验操作现象是:________________________________________________________;
Ⅲ.课外活动小组乙,在研究了课外活动小组甲的方案后,认为该方案中有不足和不安全的地方。
(3)课外活动小组乙对甲的方案提出改进意见:
①将甲装置浸在70~80℃的水浴中,目的是____________________________;
②装置B、C之间接上丁装置,请你在上面方框中,画出D的装置图。
(4)如果在装置B、C之间不增加D装置,提出你对实验改进的意见:____________。
|
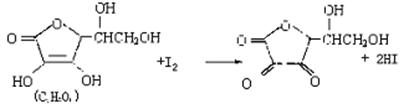
(1)下列说法中正确的是( )
A.上述反应为取代反应 B.滴定时可用淀粉溶液作批示剂
C.滴定时可用甲基橙作指示剂 D.锥形瓶不能用待测橙汁润洗
(2)上述实验前要配制7.50×10-3mol/L的标准碘溶液100mL。除玻璃棒外,还需要的玻璃仪器有 等(填编号)
A.容量瓶 B.烧杯 C.维形瓶 D.烧瓶
(3)标准碘液放入 (填仪器名称),滴定时,眼睛注视 ,直到滴定终点。滴定至终点的现象是 。
(4)滴定过程中能否剧烈摇动锥形瓶 (填能或不能),为什么
。
(5)若经数据处理,滴定中消耗的标准碘溶液的体积是15.00mL,锥形瓶中注入的待测橙汁是20.00mL,则此橙汁中维生素C的含量是 mg/L该橙汁 (填“是”或“不是”)纯天然的新鲜橙汁
四、(本题含3小题,共29分)
24.(7分)在密闭容器中,通入AmolN2和BmolH2,在一定条件下达到平衡,容器中还剩余CmolN2,
(1)生成NH3的物质的量为 ; (2)平衡时H2的转化率为 ;
(3)若把容器体积减小一半,则正反应速率 ,逆反应速率 ,
N2转化率 。(填“变大”、“变小”、“不变”)
25.(12分)亚氯酸钠(NaClO2)是一种重要的含氯消毒剂,主要用于水的消毒以及砂糖、油脂的漂白与杀菌。以下是过氧化氢法生产亚氯酸钠的工艺流程图:
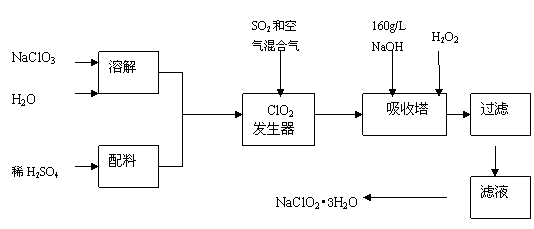

已知:①NaClO2的溶解度随温度升高而增大,适当条件下可结晶析出NaClO2•3H2O。②纯ClO2易分解爆炸,一般用稀有气体或空气稀释到10%以下安全。
(1)160 g/L NaOH溶液的物质的量浓度为 。若要计算该溶液的质量分数,
还需要的一个条件是 (用文字说明)。
(2)发生器中鼓入空气的作用可能是 (选填序号)。
(a)将SO2氧化成SO3,增强酸性; (b)稀释ClO2以防止爆炸;
(c)将NaClO3氧化成ClO2
(3)吸收塔内的反应的化学方程式为 。
吸收塔的温度不能超过20℃,其目的是防止H2O2分解,写出H2O2分解的化学方程式
。
(4)在碱性溶液中NaClO2比较稳定,所以吸收塔中应维持NaOH稍过量,判断NaOH是
否过量的简单实验方法是 。
(5)吸收塔中为防止NaClO2被还原成NaCl,所用还原剂的还原性应适中。除H2O2外,还可以选择的还原剂是 (选填序号)。
(a) Na2O2 (b) Na2S (c)FeCl2 (d)PbO(悬浊液)
(6)从滤液中得到NaClO2•3H2O粗晶体的实验操作依次是 (选填序号)。
A.蒸馏 B.蒸发 C.灼烧 D.过滤 E.冷却结晶
要得到更纯的NaClO2•3H2O晶体必须进行的操作是 (填操作名称)。
26.(10分)已知—NH3连在苯环上显碱性![]() 连在苯环上显中性,化学式为C7H7NO2的有机物中其分子结构中有一个苯环,两个侧链(间位),符合下列条件的结构简式为:
连在苯环上显中性,化学式为C7H7NO2的有机物中其分子结构中有一个苯环,两个侧链(间位),符合下列条件的结构简式为:
(1)既有酸性又有碱性 ;
(2)只有酸性 ;
(3)只有碱性 ;
|
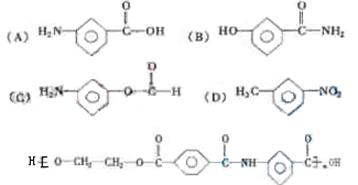
(5)由于—COOH能跟—NH2形成 ,所以可用乙二醇、对苯二甲酸跟上述既显酸性又显碱性的物质发生反应,生成高分子化合物[(C17H13NO5)]n。该化合物为高强度纤维材料,其结构简式为 。
五、(本题含2小题,共20分)
27.(7分)我国研制的长征捆绑式火箭在第一、二级发动机中用“偏二甲(基)肼”和四氧化二氮作为液体燃料。
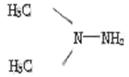
①已知偏二甲(基)肼的相对分子质量为60,其中含碳40%,含氢13.33%,其余为氮;又知其分子中有一个氮原子不与氢原子相连。写出偏二甲(基)肼分子的化学式和结构简式:化学式 ,结构简式 。
②在发动机中偏二甲(基)肼在四氧化二氮中充分燃烧,写出该燃烧反应的化学方程式(反应中所有的氮元素均转化为N2) 。
28.(13分)乙醛是重要的化工原料和化学试剂。实验室可用乙醇制乙醛,工业上目前使用两种方法制取乙醛:(1) 乙炔水化法 (2) 乙烯氧化法。两种制法制乙醛的有关信息见下表:
| 物质 项目 | 乙炔水化法 | 乙烯氧化法 |
| 原料 | 乙炔、水 | 乙烯、空气 |
| 反应条件 | HgSO4、100℃~125℃ | PdCl2~CuCl2 100℃~125℃ |
| 平衡转化率 | 乙炔转化率 90% | 乙烯转化率 80% |
| 日产量 | 2.5t(某设备条件下) | 3.6t(相同设备条件下) |
| 原料来源生产工艺 | CaCO3 CaC2 | 石油裂解气 |
(1) 写出下列化学方程式:
实验室乙醇制乙醛__________________________________________________
乙炔水化法制乙醛__________________________________________________
(2) 将乙醛滴入新制的氢氧化铜悬浊液并加热,其现象是____________________________,反应的化学方程式为_____________________________________________。
(3) 比较两种乙醛的工业制法,从化学反应速率的角度分析,在相同的条件下,较快的是__________(填字母)
(A) 乙炔水化法 (B) 乙烯氧化法
(4)乙烯由石油裂化气进一步催化裂解而来。裂解气中各成分的体积百分含量分别为:甲烷5%、乙烯40%、丙烯10%、丁二烯7%、硫化氢2%、氢气36%。如将上述裂解气通入溴水中,观察到的现象为__________________________________________。经溴水充分吸收,剩余气体经干燥后的平均相对分子质量为____________(精确到0.1)。
(5) 现代工业上乙烯氧化法有逐步取代乙炔水化法的趋势,试通过表中提供的信息,说出其中的两个原因:_________________________________、____________________________
参考答案
1.D 2.A 3.B 4.C 5.A 6.A 7.D 8.D 9.C 10.D
11.C 12.D 13.C 14.AD 15.AC 16.CD 17.AB 18.CD 19.C 20.D
21.(8分)(1)①>②>③,(2)①>②>③,(3)①=②=2③,(4)①=②=③/2(每空2分)
22.(12分)Ⅰ.操作麻烦、乙醇转化率低 (1分)
Ⅱ.(2)①放热 (1分)
2CH3CH2OH+O2![]() 2CH3CHO+2H2O (2分)
2CH3CHO+2H2O (2分)
②观察甲中单位时间内的气泡数 (2分)
Ⅲ.(3)①使生成乙醇蒸汽的速率加快 (2分)
②见下图(左) (2分)
(4)将试管丁浸在冰水中,产物不用水吸收而是直接冷却 (2分)
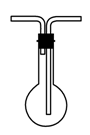
23.(11分)(1)B D(2分) (2)A B (2分)
(3)酸式滴定管(1分);锥形瓶(1分);溶液呈蓝色(1分)
(4)不能(1分);维生素C易被空气氧化(1分))
(5)990(1分);不是(1分)
24.(7分)
(1)2(A-C)mol (2分) (2)3(A-C)/B (2分)
(3)变大 (1分) 变大 (1分) 变大(1分)
25.(12分)(1)4mol/L(1分),该溶液的密度(1分);(2)b(1分);
(3)2NaOH+2ClO2+H2O2=2 NaClO2+2 H2O2+O2(2分);2H2O2=2H2O2+O2↑(1分);
(4)连续测定吸收塔内溶液的pH(1分);
(5)a d(2分);
(6)BED(2分),重结晶(1分)。
|
(每空2分)
27.(7分)①偏二甲(基)肼分子式为:C2H8N2(2分)
|
(2分)
![]() ②(3分)C2H2N2 + 2N2O 2CO2↑+ 4H2O↑+3N2↑
②(3分)C2H2N2 + 2N2O 2CO2↑+ 4H2O↑+3N2↑
28.(13分)
(1)2CH3CH2OH+O2
![]() 2CH3CHO+2H2O (2分);
2CH3CHO+2H2O (2分);
CH≡CH+H2O![]() CH3CHO (2分)
CH3CHO (2分)
(2) 有红色沉淀生成(1分);
CH3CHO+2Cu(OH)2 ![]() CH3COOH +Cu2O +2H2O
(2分)
CH3COOH +Cu2O +2H2O
(2分)
(3)B (1分)
(4) 溴水褪色 (1分); 3.7 (2分)
(5) 乙炔水化法使用HgSO4 作催化剂,毒性大;乙烯氧化法日产量高,反应快;原料气乙炔要经过多步反应制得,且消耗大量的电能,热能,较难获得;原料乙烯来源于石油裂解气,消耗总能量 比乙炔少,且易获得。(2分)