高三化学第一学期教学质量检测
高三化学
可能用到的相对原子质量:
H 1 C 12 N 14 O 16 Cl 35.5 Ba 137
第一部分 选择题(共70分)
一、选择题(本题包括10小题,每小题3分,共30分。每小题只有一个选项符合题意)
1.下列是生活中常见的物质,其中pH>7的是
A.食醋 B.味精水溶液 C.橙汁 D.蔗糖溶液
2.下列可用于测定溶液pH且精确度最高的是
A.pH计 B.酸碱指示剂 C.精密pH试纸 D.广泛pH试纸
3.下列叙述不正确的是
A.金刚砂的成分是Al2O3,可用作砂纸、砂轮的磨料
B.水晶和玛瑙的主要成分都是SiO2
C.含硅的钢具有良好的导磁性
D.利于环保、节能的太阳能电池可用硅材料制作
4.下列说法中正确的是
A.月球上存在大量3He,3He原子核有3个质子
B.34S原子核内的中子数为16
C.H216O在相同条件下比H218O更易蒸发
D.2H+的酸性比1H+的酸性更强
5.下列分子中存在π键和非极性键的是
A.H2 B.C2H2 C.H2O D.CO2
6.下列事实不能用勒夏特列原理解释的是
A.打开冰镇啤酒瓶把啤酒倒入玻璃杯,杯中立即泛起大量泡沫
B.加热后的纯碱水洗油污比冷碱水效果好
C.FeCl3滴入沸水中,煮沸片刻得到红褐色胶体
D.镀层破损后,马口铁(镀锡的铁)比白铁(镀锌的铁)更易腐蚀
7.室温时,下列混合溶液的pH一定小于7的是
A.相同物质的量浓度的醋酸溶液和氢氧化钠溶液等体积混合
B.相同物质的量浓度的盐酸和氨水等体积混合
C.pH=3的硫酸溶液和pH=11的氨水等体积混合
D.pH=3的盐酸和pH=11的氢氧化钡溶液等体积混合
8.下列化学反应的离子方程式正确的是
A.用食醋除去水壶内的水垢:CaCO3+2H+=Ca2++CO2↑+H2O
B.硫化钠溶液呈碱性的原因:S2-+2H2O![]() H2S+2OH-
H2S+2OH-
C.钢铁发生吸氧腐蚀时,正极上发生的电极反应: 2H2O+O2+4e-==4OH-
D.氢氧化钡溶液与稀硫酸反应:Ba2++SO42—+H++OH-==BaSO4↓+H2O
9.下列对一些实验事实的理论解释不正确的是
| 选项 | 实 验 事 实 | 理 论 解 释 |
| A. | N原子的第一电离能大于O原子 | N原子2p能级半充满 |
| B. | CO2为直线形分子 | CO2分子的键角为180° |
| C. | 金刚石的熔点低于石墨 | 金刚石是分子晶体,石墨是原子晶体 |
| D. | HF的沸点高于HCl | HF分子之间存在氢键,而HCl没有 |
10.我市积极打造广东省能源基地,正在建设核能、火力、风力等发电站。下列有关说法正确的是
A.原电池是将化学能转化为电能的一种装置
B.在25℃、101KPa ,1mol物质燃烧时所放出的热量,叫做该物质的燃烧热
C.核能是可再生的新能源 D.风力是二级能源
二、选择题(本题包括10小题,每小题4分,共40分。每小题有一个或两个选项符合题意。若正确答案包括两个选项,只先一个且正确得2分,但只要选错一个就得0分)
11.水是宝贵的自然资源。下列关于水的说法正确的是
A.在干燥时水的晶体是干冰
B.水分子是极性分子,分子之间存在氢键
C.在0.1mol·L-1 NaOH溶液中,水电离的c(OH-)= 0.1mol·L-1
D.将水加热,Kw增大,pH不变
12.下列各组离子中,一定能大量共存的是:
A.加入铝粉有氢气产生的溶液中:Na+、SO42-、C1-、K+
B.PH = 0的无色溶液中:Na+、K+、MnO4-、NO3-
C.在0.1mol/L的盐酸溶液中:Fe2+、Na+、ClO-、Ca2+
D.在c(H+)/c(OH-)= 1×1013的溶液中:NH4+、Ca2+、C1-、K+
13.常用的锌锰干电池在放电时总反应可表为:
Zn(s) + 2MnO2(s) + 2NH4+ = Zn2+ + Mn2O3 + 2NH3 + H2O
放电时负极区发生反应的物质或微粒是:
A.MnO2 B.MnO2和NH4+ C.Zn D.Zn2+和NH3
14.下列是某研究性学习小组对南宋沉船“南海一号”的有关说法,正确的是
A.船上存在大量的铝制餐具 B.船上的瓷器属于硅酸盐产品
C.船体制造时采用了大量的塑料 D.海底淤泥的覆盖减慢了船体的变质速率
15.下列关于元素周期表和元素周期律的说法错误的是
A.Fe元素位于元素周期表的p区
B.第三周期元素从Na到Cl,电负性、非金属性逐渐增强
C.第IA族元素从Li到Cs,原子半径依次减小、第一电离能依次增大
D.元素周期表中从IIIB族到IIB族10个纵行的元素都是金属元素
16.我国采用长征三号甲运载火箭成功发射了 “嫦娥一号” 卫星。肼(N2H4)是火箭发动机的一种燃料,反应时N2O4为氧化剂,反应生成N2和水蒸气。已知:
N2(g)+2O2(g)===N2O4(g) △H=+8.7kJ/mol
N2H4(g)+O2(g)==N2(g)+2H2O(g) △H= -534kJ/mol
下列表示肼和N2O4反应的热化学方程式,正确的是
A.2N2H4(g) + N2O4(g) = 3N2(g) + 4H2O(g) △H=–1076.7 kJ/mol
B.N2H4(g) + 1/2N2O4(g) =3/2N2(g) + 2H2O(g) △H=–542.7 kJ/mol
C.2N2H4(g) + N2O4(g) = 3N2(g) + 4H2O(g) △H=–542.7 kJ/mol
D.2N2H4(g) + N2O4(g) = 3N2(g) + 4H2O(l) △H=–1059.3 kJ/mol
17.类推的方法在化学学习与研究中有广泛的应用,但有时会得出错误的结论,因此类推出的结论最终要经过实践的检验才能确定是否正确。以下几种类推结论中正确的是
A.CaCO3的溶解度小于Ca(HCO3)2,推出Na2CO3溶解度小于NaHCO3
B.NH3的沸点高于PH3,推出CH4沸点高于SiH4
C.H2SO4为强酸,推出HClO4为强酸
D.CO2的晶体是分子晶体,推出SiO2的晶体是分子晶体
18.下列各溶液中,微粒的物质的量浓度关系正确的是
A.0.1mol·L-1H2S溶液:c(H+)>c(OH-)
B.0.1 mol·L-1 NH4Cl溶液:c(H+)=c(OH-)
C.在0.1 mol·L-1CH3COONa溶液中:c(OH-)=c(CH3COOH)+c(H+)
D.向醋酸钠溶液中加入适量醋酸,得到的酸性混合溶液:
c(Na+)>c(CH3COO-)>c(H+)>c(OH-)
19.下列实验设计能达到实验目的的是
| 实验目的 | 实验步骤及现象 | |
| A | 检验亚硫酸钠试样是否变质 |
|
| B | 检验某卤代烃是否是氯代烃 |
|
| C | 证明酸性条件下H2O2氧化性比I2强 |
|
| D | 除去氯化钠晶体中少量硝酸钾 |
|
20.青霉素是医学上一种常用的抗生素,在体内经酸性水解后,得到青霉氨基酸,其结构简式如右图所示 (分子中-SH与—OH具有类似性质)。
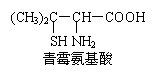 下列关于青霉氨基酸的推断,不合理的是
下列关于青霉氨基酸的推断,不合理的是
A.青霉氨基酸具有两性
B.青霉氨基酸能发生酯化反应
C.青霉氨基酸分子中所有碳原子均在同一直线上
D.1mol青霉氨基酸与足量的金属钠反应生成1mol H2
第二部分 非选择题(共80分)
三、(本题包括3小题,共29分)
21.(5分)下列有关化学实验的基本操作及安全知识的叙述,不正确的是 (填序号)。
A.用托盘天平称取10.50g干燥的NaCl固体
B.附着于试管内壁的苯酚,可用酸液洗涤
C.用重结晶法可以除去硝酸钾中混有的少量氯化钠
D.用渗析法分离淀粉中混有的NaNO3杂质
E.实验时,不慎打翻燃着的酒精灯,可立即用湿抹布盖灭火焰
F.切割白磷时,必须用镊子夹取,置于桌面上的玻璃片上,小心用刀切割
G.配制浓硫酸和浓硝酸的混合酸时,将浓硫酸沿器壁慢慢加入到浓硝酸中,并不断搅拌
H.用分液漏斗分液时,下层液体从分液漏斗下端管口放出,关闭活塞,换一个接收容器,上层液体继续从分液漏斗下端管口放出
I.配制一定浓度的氯化钾溶液1000mL,准确称取氯化钾固体,放入到1000ml的容量瓶中,加水溶解,振荡摇匀,定容即可。
22.(8分) 下图为中学常见仪器的部分结构(有的仪器被放大)。
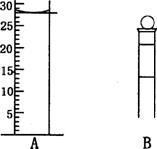
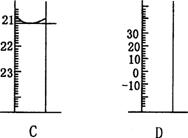
(1)B常用于实验室配制溶液,则该仪器名称为 。
(2)C图中液面所示溶液的体积为 mL。
(3)用上述四种仪器中的某种测量一液体的体积,平视时读数为NmL,仰视时读数为MmL,若M>N,则所使用的仪器是 (填字母标号)。
(4)若用C在实验室中测定盐酸溶液的物质的量浓度,简述除去气泡的实验操作
。
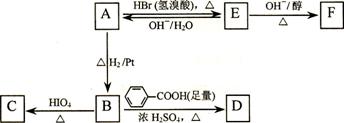
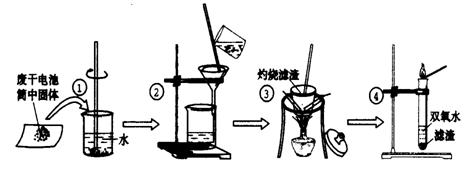 23.(16分) 某同学用废干电池内的黑色固体(可能含有MnO2、NH4Cl、ZnCl2等物质)进行如图所示实验:
23.(16分) 某同学用废干电池内的黑色固体(可能含有MnO2、NH4Cl、ZnCl2等物质)进行如图所示实验:
(1) 操作②名称是 ,该过程玻璃棒的作用: 。
(2) 操作④加入③中所得滤渣,试管中迅速产生能使带火星的木条复燃的气体,由此推测滤渣含有MnO2,试管中发生反应的化学方程式: ;MnO2在反应中是 剂。
(3) 操作③灼烧滤渣中的黑色固体时,产生一种使澄清石灰水变浑浊的气体,由此推测滤渣中除含有MnO2外,还存在的物质为: 。
(4) 已知氯化锌与稀氨水反应先生成Zn(OH)2白色沉淀,Zn(OH)2可以溶于稀氨水生成可溶性的[Zn(NH3)4](OH)2;下列是该同学对操作②的滤液成分进行探究的过程:
①检验NH4Cl:取少量滤液加入NaOH固体,并加热,产生一种使湿润的红色石蕊试纸
变 色的刺激性气体。
②检验ZnCl2:取少量滤液逐滴滴入稀氨水,有白色沉淀;滴入过量稀氨水后白色沉淀
溶解。这两步反应的离子方程式是: ; 。
四、(本题包括3小题,共30分)
24.(8分) 能源问题是人类社会面临的重大课题,甲醇是未来重要的能源物质。一定条件下,在体积为2 L的密闭容器中,1mol一氧化碳与2mol氢气反应生成甲醇(催化剂为Cu2O/ZnO):
CO(g)+2H2(g)![]() CH3OH(g) △H<0
CH3OH(g) △H<0
根据题意完成下列各题:
(1)反应达到平衡时,平衡常数表达式K= ,升高温度,K值 (填“增大”、“减小”或“不变”)。
(2)在500℃,10min反应达平衡,此时甲醇的物质的量浓度为0.3mol/L,从反应开始到平衡,氢气的平均反应速率v(H2)= 。
(3)在其它条件不变的情况下,把反应处于平衡体系的容器的体积压缩为1 L,下列有关该体系的说法正确的是 。
A.氢气的浓度减少 B.正反应速率加快,逆反应速率减慢
C.甲醇的物质的量增加 D.重新平衡时c(CO)/c(CH3OH)不变
25. (10分) 短周期元素A、B、C、D的原子序数依次递增,A、B、C其原子的最外层电子数之和为9。A与B、C、D位于相邻周期,C原子最外层电子数是A原子次外层电子数的2倍或者是B原子最外层电子数的4倍。化合物BD是一种重要的调味品。试解答下列有关问题:
(1)B在周期表中的位置:第 周期、第 族。
(2)A、C的单质以及它们之间反应生成的化合物在常温时状态相同,形成的晶体类型也相同,则晶体类型是 ;熔点由高到低的顺序为 (填元素符号或化学式)。
(3)工业生产B、D单质的原理是电解法。电解BD饱和溶液制取单质D的阳极反应式
为 ,电解熔融的BD制取单质B的化学方程式为 。
26.(12分) “卤块”的主要成分为MgCl2(含Fe2+、Fe3+、Mn2+等杂质离子),以它为原料,按如下工艺流程图,可制得“轻质氧化镁”。 如果要求产品尽量不含杂质离子且成本较低,流程中所用试剂或pH控制可参考下列附表确定。
 | |||||||
| |||||||
| |||||||
| |||||||
|
![]()
![]()
|
|
|
![]() 加盐酸 加X 加Y
加盐酸 加X 加Y
|
表一:生成氢氧化物沉淀的pH 表二:化学试剂价格表
| 物质 | 开始沉淀 | 沉淀完全 | 试剂 | 价格(元/吨) | |
| Fe(OH)3 | 2.7 | 3.7 | 漂液(含NaClO25.2%) | 450 | |
| Fe(OH)2 | 7.6 | 9.6 | H2O2(30%) | 2400 | |
| Mn(OH)2 | 8.3 | 9.8 | NaOH(固98%) | 2100 | |
| Mg(OH)2 | 9.6 | 11.1 | Na2CO3(固95%) | 600 | |
| 卤块(MgCl2,30%) | 310 |
(注)Fe(OH)2呈絮状,不易从溶液中除去,除Fe2+通常将它氧化成为Fe3+后,生成Fe(OH)3而除之。
请填写以下空白:
(1)在步骤②中加入的试剂X,最佳选择应是 简述原因:
;试剂X的作用是 。
(2)在步骤③中加入的试剂应是 ,控制pH=9.8的目的是
。
(3)有同学提出控制pH=9.6更为合适,你认为是否正确 (填正确、不正确)并说明理由: 。
五、(本题包括2小题,共21分)
27.(10分)
已知: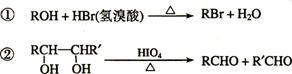
C、H、O三种元素组成的的有机物A,其相对分子质量为88,分子中C、H、O原子个数比为2:4:1 。A中含有碳氧双键,与A相关的反应如下:
⑴.A的分子式为___________。
⑵A有2个不同的含氧官能团,其名称是 。.
⑶.写出E → F的反应类型: _______ ____。
⑷.写出C和F的结构简式:C ___________ 、 F ___________。
28.(11分)常温下在20mL 0.1 mol/L Na2CO3溶液中逐滴加入0.1mol/L HCl溶液40mL,溶
![]()
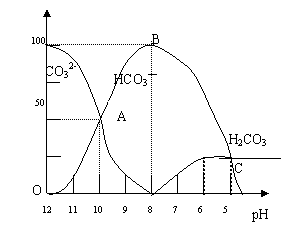 液的pH逐渐降低,此时溶液中含碳元素的微粒物质的量浓度的百分含量(纵轴)也发生变
液的pH逐渐降低,此时溶液中含碳元素的微粒物质的量浓度的百分含量(纵轴)也发生变
化(CO2因逸出未画出),如下图所示:
回答下列问题:
(1)20 mL 0.1mol/LNa2CO3溶液呈碱性的
原因是(用离子方程式表示) ;
其溶液中所有阳离子和阴离子的浓度有何关系?
(用等式表示) 。
(2)某同学认为该溶液中Na2CO3的水解是微
弱的,发生水解的CO32-离子不超过其总量的10%。
请你设计简单实验证明该同学的观点是否正确 。
(3)若向20mL 0.1mol/LNa2CO3溶液中加入BaCl2粉末3.328×10-7g时开始产生沉淀X,则Ksp(X)= 。
(4)请写出OAB段的离子方程式 ;当混合液pH= 时,开始放出CO2气体。
高三化学参考答案及评分标准
一、选择题:1.B 2.A 3.A 4.C 5.B 6.D 7.B 8.C 9.C 10.A
二、选择题:11. B 12.AD 13.C 14. BD 15. AC 16.A 17.C 18. AC 19.D 20.C
三、(本题包括3小题,共29分)
21.(5分) ABFHI (选对1个得分,错选1个倒扣1分,本题不给负分)
22.(8分,每空2分)(1)容量瓶(2)21.10(2分,没有4位数0分)(3)C
(4)将胶管弯曲使玻璃尖嘴斜向上,用两指捏住胶管,轻轻挤压玻璃珠,使溶液
从尖嘴流出。(2分)
23.(16分,每空2分)(1)过滤,引流作用。
(2)2H2O2 ![]() 2H2O + O2↑,催化。 (3)炭(或碳、或C)
2H2O + O2↑,催化。 (3)炭(或碳、或C)
(4)①蓝。②Zn 2+ +2NH3·H2O= Zn (OH)2↓+2 NH4 +;
Zn (OH)2+ 4 NH3·H2O= [Zn (NH3) 4]2++2OH-+4H2O。
四、(本题包括3小题,共30分)
24.(8分)(1)K=c(CH3OH)/c(CO)·c2(H2) ,减小。(各2分)
(2)0.06 mol·(L·min)-1 (2分)(3)AC(2分)
25.(10分)(1)3,IA(各1分)(2)原子晶体,C>SiC>Si(各2分)
|
(3) 2Cl- -2e-=Cl2↑, 2NaCl(熔融)====2Na+Cl2↑(各2分)
26.(12分)(1)(共6分)漂液(NaClO)。 漂液(NaClO)和H2O2都能使Fe2+氧化为Fe3+,但漂液(NaClO)的成本比H2O2低很多。 使Fe2+氧化为Fe3+(各2分)
(2)(共3分)NaOH (2分) 使Fe2+、Fe3+、Mn2+等杂质离子都能生成氢氧化物沉淀以便过滤除去。(1分)
(3)(共3分)不正确 (2分) 由表中数据可知,pH=9.8时Mg2+也部分生成Mg(OH)2,影响产率,但因卤块价格便宜,损失一些以保证产品(MgO)的纯度,是可行的。(1分)
五、(本题包括2小题,共21分)
27.(10分,每空各2分)⑴.C4H8O2 ⑵. 羰基、羟基 ⑶. 消去反应
⑷. CH3CHO ![]()
28.(共11分)
(1)CO32-+H2O ![]() HCO3-+OH—(2分);
HCO3-+OH—(2分);
c(Na+)+c(H+)=2c (CO32-)+c(HCO3-)+c (OH-)(1)
(2)用pH试纸(或pH计)测常温下0.1mol·L-1 Na2CO3溶液的pH,(1分)若pH<12,则该同学的观点正确;若pH>12,则该同学的观点不正确。(1分)(共2分)
(3) 8.0×10-9(2分) (4) CO32-+H+=HCO3- ; 6 (各2分)