高三化学第一轮综合测试试卷(五)
可能用到的相对原子质量:H:1 Na:23 Mg:24 Al:27 Fe:56 K:39 Cu:64 Ag:108 C:12 O:16 S:32 Cl:35.5 Br:80
一、选择题(本题包括15小题,每小题4分,共60分,每小题只有一个正确答案):
( A )1.
在一定条件下,某密闭容器中发生了如下反应:2SO2(g) + O2 (g) ![]() 2SO3(g) (正反应放热),反应达平衡后,SO2、O2、SO3的物质的量之比为3:2:5。保持其它条件不变,升温后达到新平衡时,SO2、O2的物质的量分别为1.4mol和0.9mol,此时容器内SO3的物质的量应为
2SO3(g) (正反应放热),反应达平衡后,SO2、O2、SO3的物质的量之比为3:2:5。保持其它条件不变,升温后达到新平衡时,SO2、O2的物质的量分别为1.4mol和0.9mol,此时容器内SO3的物质的量应为
A. 1.8mol B. 2mol C. 2.2mol D. 2.4mol
( B )2.
反应 2NH3(g) + CO2(g) ![]() CO(NH2)2(s) + H2O(g)
已达平衡。若增大压强,平衡移动,但混合气体的平均相对分子质量不变。下列说法正确的是
CO(NH2)2(s) + H2O(g)
已达平衡。若增大压强,平衡移动,但混合气体的平均相对分子质量不变。下列说法正确的是
A. 原混合气体的平均相对分子质量为28 B. 原混合气体的平均相对分子质量为30
C. 起始时,NH3与CO2的体积比为13:14 D. 起始时,NH3与CO2的体积比为14:15
( A )3. 下列反应中,氧化剂与还原剂物质的量的关系为1∶2的是
A. O3+2KI+H2O==2KOH+I2+O2 B. 2CH3COOH+Ca(ClO)2==2HClO+Ca(CH3COO)2
C. I2+2NaClO3==2NaIO3+Cl2 D. 3Cl2+6KOH =5KCl+KClO3+3H2O
(B )4. 在一定温度下,向容积固定不变的密闭容器里充入amolNO2发生如下反应:2NO2(g)![]() N2O4(g),达到平衡后,再向该容器充入a mol NO2,达平衡后与原平衡比较正确的是
N2O4(g),达到平衡后,再向该容器充入a mol NO2,达平衡后与原平衡比较正确的是
A. 平均相对分子质量减小 B. NO2的转化率提高
C. 压强为原来的2倍 D. 颜色变浅
( C )5.在1L 1mol / L的氨水中,说法正确的是
A.含1 mol NH3分子 B.含NH3和NH3·H2O之和为1 mol
C.含NH3、NH4+ 和NH3·H2O之和为1 mol D.含NH3·H2O为1 mol
( D )6. 下列物质中,常温下能起反应产生气体的是
A.铁和浓硫酸 B. 铝和浓硝酸 C.铜和稀盐酸 D. 铜和浓硝酸
( A )7. 在一定条件下发生下列反应,其中属于盐类水解反应的是
A. NH4++2 H2O ![]() NH3·H2O + H3O+ B. HCO3—+H2O
NH3·H2O + H3O+ B. HCO3—+H2O ![]() H3O++CO32—
H3O++CO32—
C. HS-+H+====H2S D.
Cl2+H2O ![]() H++Cl-+HClO
H++Cl-+HClO
( C )8. 下列事实不能说明亚硝酸是弱酸的是
A. NaNO2溶液的pH值大于7 B. HNO2与同浓度的盐酸溶液作对比导电实验,灯泡很暗
C. HNO2不与NaCl反应 D. 室温下0.1 mol /L HNO2溶液的pH = 2.1
( D )9. 25℃时,在浓度为1 mol/L的(NH4)2SO4、(NH4)2CO3、(NH4)2Fe(SO4)2的溶液中,测得
c(NH4+)分别为a、b、c(单位为mol/L)。下列判断正确的是
A. a = b = c B. a > b > c C. a > c > b D. c > a >b
( C )10. 物质的量浓度相同的三种盐 NaX、NaY 和 NaZ 的溶液,其中pH值依次为 8、9、10则 HX、HY、HZ 的酸性由强到弱的顺序是
A. HX、HZ、HY B. HZ、HY、HX C. HX、HY、HZ D. HY、HZ、HX
( C )11. Na2CO3溶液中,存在多种分子和离子,下列关系式中不正确的是
A. c(OH-)=c(HCO3-)+c(H+)+2c(H2CO3) B. c(Na+)> c(CO32-)> c(OH-)>c(HCO3-)>c(H+)
C. c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3) D. c(OH-)+c(HCO3-)+2c(CO32-)=c(H+)+c(Na+)
( A )12.下列溶液一定是碱性的是
A.溶液中c(OH-)>c(H+) B.pH>7的溶液
C.溶液中含有OH- D.pH=3的CH3COOH与pH=11的NaOH溶液等体积混合
( B )13.下列各组离子中,在溶液中不能大量共存的是
A.S2-、NO3-、CO32-、K+ B.Al3+、Na+、S2-、SO42-
—1—
C.Al3+、NH4+、K+、SO42- D.Fe3+、Ca2+、H+、NO3-
( D )14.下列各组数据关系中,前者比后者大的是
A.纯水100℃和25℃时的pH
B.Na2CO3溶液中的HCO3-和OH-数目
C.常温下,pH=11的KOH溶液和pH=11的CH3COOK溶液中由水电离出的c(OH-)
D.100mL0.1mol·L-1的CH3COOH溶液与10mL0.1mol·L-1的CH3COOH溶液的H+数目
( B )15.CH3COOH与CH3COONa等物质的量混合配制成的稀溶液,pH为4.7。下列说法错
误的是
A.CH3COOH的电离作用大于CH3COONa的水解作用
B.CH3COONa的水解作用大于CH3COOH的电离作用
C.CH3COOH的存在抑制了CH3COONa的水解
D.CH3COONa的存在抑制了CH3COOH的电离
二、填空题(本题共2小题,每空3分,共27分)
16. ⑴在一体积为10L的容器中,通人一定量的CO和H2O,在850℃时发生如下反应:
CO(g)十H2O(g)
![]() CO2(g)十H2
(g) (正反应放热),CO和H2O浓度变化如下左图,则
0—4min的平均反应速率v(CO)=_ 0.03 _ mol/(L·min)
CO2(g)十H2
(g) (正反应放热),CO和H2O浓度变化如下左图,则
0—4min的平均反应速率v(CO)=_ 0.03 _ mol/(L·min)
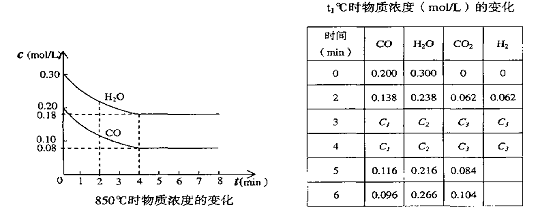
⑵t℃(高于850℃)时,在相同容器中发生上述反应,容器内各物质的浓度变化如上表。
①表中3min—4min之间反应处于平衡 状态;C1数值大于 0.08 mol/L (填大于、小于或等于)。
②反应在4min—5min之间,平衡向逆方向移动,可能的原因是___ d ____ (单选);
表中5min—6min之间数值发生变化,可能的原因是__ a ________(单选)。
a.增加水蒸气 b.降低温度 c.使用催化剂 d.增加氢气浓度
17.现有S2-、SO32-、NH4+、Al3+、HPO42-、Na+、SO42-、AlO2-、Fe3+、HCO3-、Cl-等离子,请按要求填空:
⑴在水溶液中,该离子水解呈碱性的是:S2-,SO2-,HPO2-,AlO-,HCO- 。
⑵在水溶液中,该离子水解呈酸性的是:NH+,Al3+,Fe3+ 。
⑶既能在酸性较强的溶液里大量存在,又能在碱性较强的溶液里大量存在的离子有:
Na+,Cl-,SO2- 。
⑷既不能在酸性较强的溶液里大量存在,又不能在碱性较强的溶液里大量存在的离子有:
HPO2-,HCO- 。
三、推断题(每空3分,共21分):
18.A、B、C、D、E5瓶透明溶液,分别是HCl、BaCl2、NaHSO4、Na2CO3和AgNO3中的一种。已知:
① A与B反应有气体生成; ② B与C反应有沉淀生成;
—2—
③ C与D反应有沉淀生成; ④ D与E反应有沉淀生成;
⑤ A与E反应有气体生成; ⑥ 在②和③的反应中生成的沉淀是同一种物质。
请填空:
⑴在②和③的反应中,生成的沉淀物质的化学式(分子式)是__ AgCl__。
⑵A是_ NaCO_ ,B是__ HCl__,C是_ AgNO__,D是_ BaCl_ ,E是_ NaHSO__。
⑶A与E反应的离子方程式是__2H++CO2-===CO+HO↑ 。
四、选择题(每小题有一个或两个正确答案):
( B )19.实验室配制硫酸铁溶液时,先把硫酸铁晶体溶解在稀硫酸中,再加水稀释至所需浓度,如此操作的目的是
A.防止硫酸铁分解 B.抑制硫酸铁水解C.提高溶液的pH D.提高硫酸铁的溶解度
( C )20.下列说法中正确的是
A.HCO3-在水溶液中只电离,不水解 B.硝酸钠溶液水解后呈中性
C.可溶性的铝盐都能发生水解反应 D.可溶性的钠盐都不发生水解反应
( B )21.下列叙述中,正确的是
A.由极性键构成的一定是极性分子 B.由非极性键构成的一定是非极性分子
C.非极性分子中一定不含极性键 D.极性分子中一定不含非极性键
( C )22.NH4Cl溶液的pH和稀HCl的pH值均为5,其中由水电离出的c(H+)分别为amol/L和bmol/L,则a与b的关系正确的是
A.a=b B.a<b C.a>b D.不能确定
( )23.在10mL0.1mol/L的醋酸中逐滴加入0.1mol/L的氢氧化钠溶液,当滴至混合液恰好呈中性时,消耗氢氧化钠溶液的体积
A.等于10mL B.小于10mL C.大于10mL D.无法判断
(CD)24.物质的量浓度相同的下列各溶液等体积混合后,溶液的pH大于7的是
A.NaHCO3、HCl、NaCl B.K2CO3、H2SO4
C.Na2CO3、CH3COONa、HNO3 D.NaOH、CH3COONa、HCl
( A )25.将氨水逐滴加入到稀盐酸中,使溶液成中性,则此时
A.c(NH4+)==c(Cl-) B.c(NH4+)>c(Cl-)
C.c(NH4+)<c(Cl-) D.c(NH4+)与c(Cl-)之间关系不确定
( B )26.将pH=3的盐酸溶液和pH=11的氨水等体积混合后,溶液中离子浓度关系正确的是
A.c(NH4+)>c(Cl-)>c(H+)>c(OH-) B.c(NH4+)>c(Cl-)> c(OH-)>c(H+)
C.c(Cl-)>c(NH4+)>c(H+)>c(OH-) D.c(Cl-)>c(NH4+)>c(OH-)>c(H+)
(AB)27.将相同物质的量浓度的某弱酸HX溶液与NaX溶液等体积混合,测得混合溶液中c(Na+)>c(X-),则下列关系错误的是
A.c(OH-)<c(H+) B.c(HX)<c(X-)
C.c(X-)+c(HX)==2c(Na+) D.c(HX)+c(H+)==c(Na+)+c(OH-)
(BD)28.一元酸HA溶液中,加入一定量强碱MOH溶液后,恰好完全反应,反应后的溶液中,下列判断正确的是
A.c(A-)≥c(M+) B.c(A-)≤c(M+)
C.若MA不水解,则c(OH-)<c(H+) D.若MA水解,则c(OH-)>c(H+)
( B )29.已知反应A2(g) + 2B2(g)
![]() 2AB2(g)
的△H<0,下列说法正确的是
2AB2(g)
的△H<0,下列说法正确的是
A.升高温度,正向反应速率增加,逆向反应速率减小
B.升高温度有利于反应速率增加,从而缩短达到平衡的时间
C.达到平衡后,升高温度或增大压强都有利于该反应平衡正向移动
D.达到平衡后,降低温度或减小压强都有利于该反应平衡正向移动
( C )30. 某温度下在密闭容器中发生如下反应:2M(g)+N(g)![]() 2E(g)。若开始时只充入2mol
2E(g)。若开始时只充入2mol
—3—
E(g),达平衡时,混合气体的压强比起始时增大了20%;若开始时只充入2mol M和1mol N 的混合气体,达平衡时M的转化率
A.20% B.40% C.60% D.80%
( A )31. 0.1 mol·L-1盐酸分别跟20 mL NaOH和20 mL NH3·H2O反应,都消耗了20 mL
盐酸,这表明NaOH溶液和氨水的关系
A. 物质的量浓度相同 B. 氢氧根离子浓度相同
C. pH相同 D. 溶液中离子浓度相同
五、填空题:
32.写出下列物质发生水解反应的离子方程式:
①Na2S ;
②CuSO4 ;
③NaH2PO4 ;
④CH3COONH4 ;
⑤Al2(SO4)3和NaHCO3 ;
⑥CuSO4和Na2S 。
33. 配平下列化学方程式,将化学计量数填入空格内并回答有关的问题:
⑴如果不小心把白磷沾到皮肤上,可用冷的硫酸铜溶液冲洗,化学方程式为
[ 2 ]P +[ 5 ]CuSO4+[ 8 ]H2O===[ 5 ]Cu+[ 2 ]H3PO4+[ 5 ]H2SO4
其中还原剂是 P ,还原产物是 Cu 。
⑵白磷也可与热的CuSO4溶液反应,其化学方程式为:
[ 11 ]P+[ 15 ]CuSO4+[ 24 ]H2O===[ 5 ]Cu3P+[ 6 ]]H3PO4+[ 15 ]H2SO4
其中氧化剂是 P、CuSO4 ,若有1molCuSO4参加反应,则它氧化的P的物质的量是 0.2mol 。
⑶配平下列反应的离子方程式:
[ 2 ]Fe(OH)3+[5-n]ClO-+[2n ]OH-===[ 2 ]FeO4n-+[5-n]Cl-+[n+3]H2O
已知有3.21g Fe(OH)3参加反应,其转移了5.4×1022个电子,则n= 2 ,FeO4n-中铁的化合价为 +6 ,根据上述情况推测, FeO4n-能和下列 B、C 物质反应(只填序号):
A. KMnO4 B. SO2 C. H2S D. O2
⑷AsH3是一种很强的还原剂,室温下,它能在空气中自燃,其氧化产物为As2O3.补填空白处的物质,并配平化学方程式:
[ 2 ]AsH3+[ 3 ]O2===[ 1 ]As2O3+[ 3 ] HO (填物质的化学式)。
六、实验题:
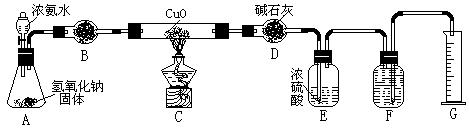 |
24.氨气与灼热的氧化铜反应生成铜、氮气和水。利用下图所示实验装置可测定氨分子的组成(图中夹持、固定装置部分均略去)。回答下列问题:
⑴写出氨气与氧化铜反应的化学方程式:2NH + 3CuO 3Cu + N+ 3HO 。
⑵在A的锥形瓶中放入NaOH固体的目的是利用NaOH的碱性和遇水放热的性质,使NH·HO 分解后逸出 。
—4—
⑶在干燥管B中不能选用的干燥剂是 C (填序号);
A.碱石灰 B.生石灰 C.五氧化二磷 D.氢气化钠
⑷在C的玻璃管中观察到的现象是:黑色固体变成了亮红色 。
⑸E装置中盛装浓硫酸的目的是:吸收多余的NH ;
⑹待实验完毕后,若实验测得N2的体积(折算成标准状况)a L,则被还原的氧化铜的物质的量为:3a/22.4mol;若测得干燥管D增重b g, 则氨分子中氮、氢的原子个数比为(用含a、b字母的代数式表示)9a/11.2b 。
⑺上述实验中,如果省去B装置,测定氨分子组成的N、H原子个数的比值将会(填“增大”、“减少”或“无影响”)减少 ,理由是:因为由NH带出的水蒸气进入D装置,导致H原子的个数增加。
—5—
第一轮综合测试试卷(五)(答案)
一、选择题(本题包括15小题,每小题4分,共60分,每小题只有一个正确答案):
1.A 2.B 3.A 4.B 5.C 6.D 7.A 8.C 9.D 10.C 11.C 12.A 13.B 14.D 15.B
二、填空题(本题共2小题,每空3分,共27分)
16. ⑴_ 0.03 _ mol/(L·min)
⑵①平衡 ;大于 。
②__ d _____(单选),
__ a ________(单选)。
17.⑴S2-,SO32-,HPO42-,AlO2-,HCO3- 。
⑵NH4+,Al3+,Fe3+ 。
⑶Na+,Cl-,SO42- 。
⑷HPO42-,HCO3- 。
三、推断题(每空3分,共21分):
18.⑴__ AgCl__。
⑵A是_ Na2CO3 __,B是__ HCl__,C是_ AgNO3__,D是_ BaCl2 _,E是_ NaHSO4__。
⑶2H++CO32-===CO2+H2O↑ 。
四、选择题(每小题只有一个或两个正确答案):
19.B 20.C 21.B 22.C 23.B 24.CD 25.A 26.B 27.AB 28.BD 29.B 30.C 31.A
五、填空题:
32.(略)
33. ⑴[ 2 ]P +[ 5 ]CuSO4+[ 8 ]H2O===[ 5 ]Cu+[ 2 ]H3PO4+[ 5 ]H2SO4; P , Cu 。
⑵[ 11 ]P+[ 15 ]CuSO4+[ 24 ]H2O===[ 5 ]Cu3P+[ 6 ]]H3PO4+[ 15 ]H2SO4
P、CuSO4 ,0.2mol 。
⑶[ 2 ]Fe(OH)3+[5-n]ClO-+[2n ]OH-===[ 2 ]FeO4n-+[5-n]Cl-+[n+3]H2O
n= 2 ,+6 , B、C
⑷[ 2 ]AsH3+[ 3 ]O2===[ 1 ]As2O3+[ 3 ] H2O 。
六、实验题:
24.⑴2NH3 + 3CuO ![]() 3Cu + N2 + 3H2O 。
3Cu + N2 + 3H2O 。
⑵利用NaOH的碱性和遇水放热的性质,使NH3·H2O 分解后逸出 。
⑶ C (填序号);
⑷黑色固体变成了亮红色 。
⑸吸收多余的NH3 ;
⑹3a/22.4mol;9a/11.2b 。
⑺减少 ,因为由NH3带出的水蒸气进入D装置,导致H原子的个数增加。