高三化学第二学期周练试题(四)
可能用到的相对原子质量:H—1,C—12,N—14,O—16,Na—23,Li—7,Si—28
S—32,Cl—35.5,K—39,Al—27,Co—59
第I卷(选择题 共64分)
一、单项选择题(本题包括8小题,每小题4分,共32分。每小题只有一个选项符合题意)
1.2006年3月,温家宝指出“抓好资源节约,建设环境友好型社会”,这是我国社会和经济长期发展的重要保证。你认为下列行为与之相悖的是
A. 研制对目标昆虫有毒杀作用的新型、可降解杀虫剂
B.研制开发以水代替有机溶剂的化工涂料
C.大力发展农村沼气,将废弃的秸秆转化为清洁高效的能源
D.以聚苯乙烯全面代替木材,生产包装盒、快餐盒等以减少木材使用,保护森林
2.下列事实中,能说明氯元素原子得电子能力比硫元素原子强的是 ①HCl的溶解度比H2S大 ②盐酸的酸性比氢硫酸(H2S水溶液)酸性强 ③HCl的稳定性比H2S大 ④HCl的还原性比H2S强 ⑤HClO的酸性比H2S强 ⑥Cl2与铁反应生成FeCl3,而S与铁反应生成FeS ⑦Cl2能与H2S反应生成S ⑧在元素周期表中Cl处于S同周期的右侧 ⑨还原性:Cl-< S2-
A.③④⑤⑦⑧⑨ B.③⑥⑦⑧ C.③⑥⑦⑧⑨ D.①②③④⑤⑥⑦⑧⑨
3.下列现象或应用不能用胶体知识解释的是
A.肾功能衰竭等疾病引起的血液中毒,可利用血液透析进行治疗
B.向牛油和氢氧化钠溶液共煮后的溶液中加入食盐后有固体析出
C.水泥、冶金工厂常用高压电除去工厂烟尘,减少对空气的污染
D.氯化铝溶液中加入碳酸钠溶液会出现白色沉淀
4.下列各溶液中,各离子可能大量共存的有
A.含有大量Ba2+的溶液中:HCO3-、Fe3+、Ag+、SO42-、SCN-
B.由水电离的c(OH-)=10-14mol·L-1 的溶液中:CH3COO-、 C6H5O-、Na+、K+
C.滴加无色酚酞试液后仍无色的溶液中:Na+、CO32-、K+、ClO-、AlO2-
D.加入铝粉后产生氢气的溶液中:NH4+、Na+、NO3-、Cl-、S2-
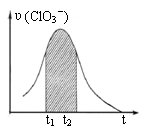 5.KClO3和KHSO3能发生反应:ClO3-+HSO3-→SO42-+ Cl-+ H+(未配平)。已知该反应的速率随c(H+)的增大而加快。右图为用ClO3-在单位时间内物质的量浓度变化表示的该反应υ-t图。下列说法正确的是
5.KClO3和KHSO3能发生反应:ClO3-+HSO3-→SO42-+ Cl-+ H+(未配平)。已知该反应的速率随c(H+)的增大而加快。右图为用ClO3-在单位时间内物质的量浓度变化表示的该反应υ-t图。下列说法正确的是
A.反应开始时速率增大不可能是c(H+)所致
B.纵坐标为υ(Cl-)的υ-t曲线与图中曲线不能完全重合
C.后期速率υ下降的主要原因是反应向逆反应方向进行
D.图中阴影“面积”可以表示t1-t2时间内c(Cl-)增大
![]() 6.一定条件下,电解较稀浓度的硫酸,其还原产物为双氧水,该原理可用于制取双氧水,其电解的化学方程式为:3H2O+3O2 O3+3H2O2。下列有关说法正确的是
6.一定条件下,电解较稀浓度的硫酸,其还原产物为双氧水,该原理可用于制取双氧水,其电解的化学方程式为:3H2O+3O2 O3+3H2O2。下列有关说法正确的是
A. 电解池的阳极生成双氧水,阴极生成臭氧
B.电解池中硫酸溶液的pH保持不变
C.产生臭氧的电极反应式为3H2O-6e-=O3+6H+
D.产生双氧水的电极反应式为2H2O-2e-= H2O2+2H+
7.下列说法中正确的是
A.在相同条件下,若将等量的硫蒸气和硫固体分别完全燃烧,后者放出热量多
B.由“C(石墨)=C(金刚石);△H=+1.9kJ·mol—1”可知,金刚石比石墨稳定
C.在稀溶液中:H+(aq)+OH—(aq)=H2O(l);△H=-57.3kJ·mol—1,若将含0.5mol H2SO4的浓硫酸与1mol NaOH溶液混合,放出的热量大于57.31 kJ
D.在101Kpa时,2g H2完全燃烧生成液态水,放出285.8kJ热量,氢气燃烧的热化学方程式表示为:2H2(g)+O2(g)=2H2O(l);△H=+285.8kJ·mol—1
8.实验是化学研究的基础,关于下列各实验装置图的叙述中,正确的是
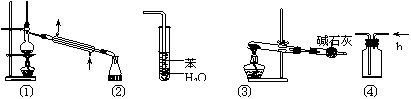
A.装置①常用于分离互不相溶液混合物
B.装置②可用于吸收HCl气体,并防倒吸
C.以NH4HCO3为原料,装置③可用于实验室制备少量NH3
D.装置④b口进气可收集CO2、NO等气体
二、不定项选择题(本题包括8小题,每小题4分,共32分。每小题有一个或两个选项符合题意。若正确答案只包括一个选项,多选时,该题为0分;若正确答案包括两个选项,只选一个且正确的得2分,选两个且都正确的得满分,但只要选错一个该小题就为0分)
9.碘是卤素中原子半径较大的元素,有时可呈现金属性。下列事实能说明该结论的是
A.HIO在水溶液中存在电离平衡:HIO![]() I++OH—
I++OH—
B.I(NO3)3晶体中含有I 3+离子
C.化合物HIO4具有酸性
D.IBr、ICl等卤素互化物为共价化合物
10.科学家预言超级原子的发现将会重建周期表,2005年1月美国科学家在《Science》上发表论文,宣布发现A1的超原子结构Al13和A114,并在质谱仪检测到稳定的Al13I-等。Al13、A114的性质很像现行周期表中的某主族元素,已知这类超原子当具有40个价电子时最稳定。下列说法不正确的是 ( )
A.A ll4与ⅡA族元素性质相似
B.A113超原子中A1原子间是通过离子键结合的
C.A113在气相中与HI反应的方程式可表示为:A l 13 + HI = HAl13I
D.A113与卤素性质类似
11.下面二维平面晶体所表示的化学式为AX3的是 ( )
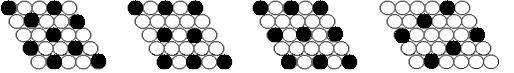
A. B. C. D.
12.25 ℃时,pH=3的盐酸a L分别与下列3种溶液充分混合后,溶液均呈中性: ① c(NH3·H2O)=10-3 mol·L-1的氨水b L;②c(OH-)=10-3 mol·L-1的氨水c L;③c(OH-)=10-3mol·L-1的Ba(OH)2溶液d L,试判断a、b、c、d的数量大小关系为
A.a=b>c>d B.b>a=d>c C.b>a>d>c D.c>a=d>b
13.新鲜水果、蔬菜、乳制品中富含的维生素C具有明显的抗衰老作用,但易被空气氧化。某课外小组利用碘滴定法测某橙汁中维生素C的含量,其化学方程式如下:
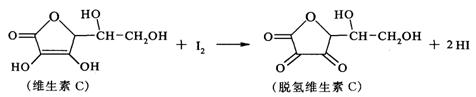
下列说法正确的是
A.上述反应为取代反应
B.维生素C在酸性条件下水解只得到1种产物
C.维生素C不可溶于水,可溶于有机溶剂
 D.维生素C的分子式为C6H8O6
D.维生素C的分子式为C6H8O6
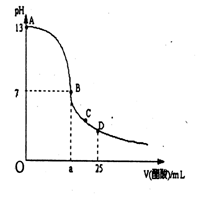
14.室温下,在25 mL 0.1 mol/LNaOH溶液中逐滴加入0.2 mol/L CH3COOH溶液,
曲线如下图所示,若忽略两溶液混合时的体积变化,有关粒子浓度关系比较错误的是
A.在A、B间任一点,溶液中一定都有
c(Na+)+ c(H+)= c(CH3COO-)+c(OH-)
B.在B点:a>12.5,且有
c(Na+)=c(CH3COO-)>c(OH-)=c(H+)
C.在C点:c(Na+)>c(CH3COO-) >c(H+)>c(OH-)
D.在D点:c(CH3COO-)+c(CH3COOH)= 0.2 mol/L
15.随着信息技术的迅猛发展,计算机在化学化工领域得到了广泛应用。下面四幅图是用计算机制作的在密闭容器里,在不同条件下进行反应:X(g) Y(g)达到平衡的图解。图中的“●”是X,“○”是Y。


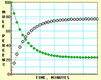

图Ⅰ 图Ⅱ 图Ⅲ 图Ⅳ
下列有关说法正确的是
A.图中的纵坐标表示物质的物质的量分数
B.四幅图中,图Ⅲ所示反应达到平衡时,X的转化率为60%
C.图Ⅰ和图Ⅱ所采用的不同条件是反应体系压强不同
D.图Ⅳ说明反应开始时是向正反应方向进行的
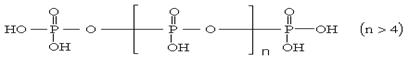 16.将多磷酸钠溶液通过氢型阳离子交换柱,进行Na+与H+的交换,得到多磷酸,其结构为:
16.将多磷酸钠溶液通过氢型阳离子交换柱,进行Na+与H+的交换,得到多磷酸,其结构为:
交换后的溶液用0.1mol·L-1的NaOH溶液滴定。在消耗NaOH溶液42.00mL和50.00mL时各有一个滴定终点。则下列判断正确的是
A.两端的__OH上的氢难电离 B.中间链上的__OH上的氢难电离
C.所有的__OH上的氢电离能力都一样 D.无法判断哪一部分__OH上的氢难易电离
第Ⅱ卷(选择题 共86分)
三、(本题包括2小题,共22分)
17.利用甲烷与氯气发生取代反应制取副产品盐酸的设想在工业上已成为现实.某化学兴趣小组拟在实验室中模拟上述过程,其设计的模拟装置如下:根据要求填空:
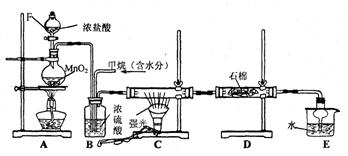
(1)B装置有三种功能:①______________;②_________________;③________________;
(2)设V(Cl2)/V(CH4)=x,若理论上欲获得最多的氯化氢,则x的取值范围是_______________.
(3)D装置中的石棉上均匀附着KI粉末,其作用是__________________________
(4)E装置的作用是____________(填编号);
A、收集气体 B、吸收氯气 C、防止倒吸 D、吸收氯化氢
(5)在C装置中,经过一段时间的强光照射,发现硬质玻璃管内壁有黑色小颗粒产生,写出置换出黑色小颗粒的化学方程式_____________________________________
(6)装置中除了有盐酸生成外,还含有有机物,从E中分离出盐酸的最佳方法为____________。该装置还有缺陷,原因是没有进行尾气处理,其尾气的主要成分是________________(填编号)
A.CH4 B.CH3Cl C.CH2Cl2 D.CHCl3 D.CCl4
18.实验室现有下列药品:①蒸馏水;②用HNO3酸化的AgNO3溶液;③熟石灰;④Na2CO3;⑤NaCl;⑥食醋;⑦废干电池(锌筒内填有炭粉、MnO2、NH4Cl、淀粉等糊状物)。某课外兴趣小组同学准备进行下列实验研究:
(1)利用上述药品制NaOH溶液的化学方程式是 。
(2)为制备NH3,可先从废干电池中制备NH4Cl。假设将废电池中的混合物溶于少量的水中,过滤除去不溶物,再蒸发滤液,并灼烧以制得干燥的NH4Cl晶体。你认为这一设想是否合理?答: ,其理由是 。
(3)他们在进行除去淀粉溶液中食盐的实验时,用鸡蛋壳膜自制了一个半透膜小袋,向其中装入混有NaCl的淀粉溶液,扎好袋口,这一实验的操作名称为 。要保证全部除去淀粉溶液里的食盐,实验中必须 。
(4)由于实验(2)中NH4Cl的制备较困难,且难以满足量的要求,现重新提供足量的浓氨水、浓NaOH溶液和NH4Cl晶体,请设计一个最简单的实验,以快速制得NH3。
①你设计的实验方案是
。
②请运用化学原理对你的方案予以解释 。
四、(本题包括2小题,共18分)
19.A、B、C、D、E都是短周期元素,原子序数依次增大,B、C同周期,C的非金属性最强,A、D同主族隔周期,E元素原子最外层的p亚层电子数是s亚层电子数的一半。A、B能形成两种液态化合物甲和乙,原子个数比分别为2∶1和1∶1。根据以上信息回答下列问题:
⑴甲、乙两分子中含有非极性共价键的物质的电子式是_______________ ,
C元素在周期表中的位置是__________________。
⑵C和D的离子中,半径较小的是__________(填离子符号)。
⑶将D的单质投入甲中,待D消失后再向上述溶液中加入E的单质,此时发生反应的化学方程式是_____________ ________ __ _____________
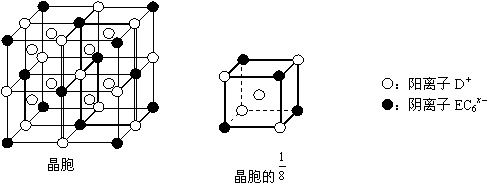
⑷C、D、E可组成离子化合物,其晶胞(晶胞是在晶体中具有代表性的最小重复单元)结构如下图所示,阳离子D+(用○表示)位于正方体的棱的中点和正方体内部;阴离子EC6x-(用●表示)位于该正方体的顶点和面心。该化合物的化学式是_________ 。
 |
![]() 20.有如下化学反应:2A(g)+B(g) 2C(g),△H<0。
20.有如下化学反应:2A(g)+B(g) 2C(g),△H<0。
(1)若将4molA和2molB在2L的容器中混合,经2s后测得C的浓度为0.6mol·L-1,用物质A表示的平均反应速率为____________;2s时物质B的浓度为_______________;
(2)若把amolA和bmolB充入一密闭容器中,达到平衡时它们的物质的量满足:
n(A)+n(B)=n(C),则A的转化率为_________________;
 (3)若将4molA和2molB加入体积可变的等压容器中,一定温度下达到平衡状态,测得气体总物质的量为4.2mol。此时,混合气体中C的体积分数为_____________;若再通入少量B气体,体系中A的体积分数_____________(填“增大”、“减小”或“不变”),若要使A的体积分数再达到与原平衡状态相同,可采取的措施有___________________________
。
(3)若将4molA和2molB加入体积可变的等压容器中,一定温度下达到平衡状态,测得气体总物质的量为4.2mol。此时,混合气体中C的体积分数为_____________;若再通入少量B气体,体系中A的体积分数_____________(填“增大”、“减小”或“不变”),若要使A的体积分数再达到与原平衡状态相同,可采取的措施有___________________________
。
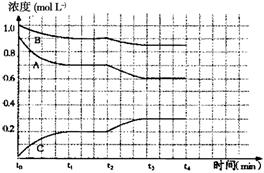
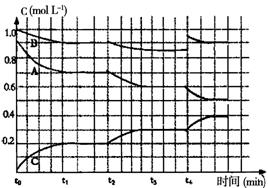
(4)右图是一定条件下该反应过程中,体系内各物 质浓度的变化情况。反应处于平衡状态的时间是________________,t2时曲线发生变化的原因是_______________________________ ,若在t4时将B的浓度增大0.lmol·L-1,请在上图中画出各物质浓度的变化情况。
五、(本题包括1小题,共10分)
21.A通常存在于钢铁中,它是由甲、乙两种化合物组成的混合物,甲和乙的含量、形状、分布对钢性能影响很大,使钢硬而脆,不宜进行机械加工。已知:(1)甲和乙的组成元素相同,均是由两种常见元素的原子以最简整数比构成的化合物,其相对分子质量分别为124、180。(2)C、D、H、I、J常温下为气体,H、I、J为单质,D是一种红棕色气体。(3)反应②为制备理想的绿色水处理剂Na2FeO4(高铁酸钠)的一种方法。(图中部分生成物没有列出。)请填写以下空白:
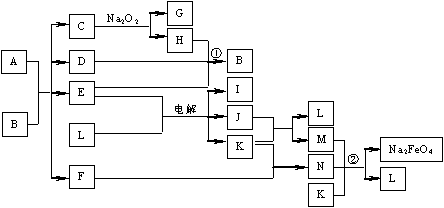
⑴写出C的电子式 。
⑵写出反应①的化学方程式 。反应②的离子方程式 。
⑶甲和乙的化学式分别为 、 ,若A中组成元素的物质的量之比为4∶9,则乙在A中的物质的量分数为 。
六、(本题包括2小题,共18分)
22.尼泊金酸的结构简式为: ![]()
(1)尼泊金酸的分子式为____________。
(2)尼泊金酸不具有的性质是_________(选填序号)。
a. 可溶于水 b. 通常状况下呈固态 c. 发生消去反应 d. 遇FeCl3溶液显紫色
(3)1 mol尼泊金酸与下列物质反应时,最多可消耗__________(选填序号)。
a. 4 mol H2 b. 2 mol NaHCO3 c. 2 mol Br2 d. 2 mol Na2CO3
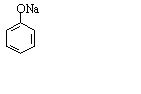
(4)将尼泊金酸与足量NaOH固体混合后灼烧,生成的有机物结构简式为_________________。
(5)尼泊金酸有多种同分异构体,写出以下含有苯环的同分异构体的结构简式:
ⅰ酯类___________________________;ⅱ醛类___________________________。
23.已知 (注:R,R’为烃基)
(注:R,R’为烃基)
A为有机合成中间体,在一定条件下发生消去反应,可能得到两种互为同分异构体的产物,其中的一种B可用于制取合成树脂、染料等多种化工产品。A能发生如下图所示的变化。
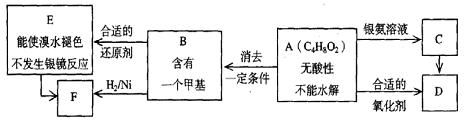 试回答(1)写出
试回答(1)写出
符合下述条件A的同分异构体结构简式(各任写一种):
a.具有酸性 b.能发生水解反应______________________
(2)A分子中的官能团是 ,D的结构简式是 。
(3)C→D的反应类型是___________,E→F的反应类型是___________
a.氧化反应 b.还原反应 c.加成反应 d.取代反应
(4)写出化学方程式:A→B 。
(5)写出E生成高聚物的化学方程式: 。
(6)C的同分异构体Cl与C有相同官能团,两分子Cl脱去两分子水形成含有六元环的C2,写出C2的结构简式:______________________________
七、(本题包括2小题,共18分)
24.能源是人类社会发展进步的物质基础。在当代,能源同信息、材料一起构成了现代文明的三大支柱。
(1)为了降低汽车尾气对大气的污染,江苏有关部门拟用甲醇替代液化石油气作为公交车的燃料。已知:在25℃、101kPa下,1g甲醇燃烧生成CO2和液态水时放热22.68kJ。请写出表示甲醇燃烧热的热化学方程式。
(2)测定工业甲醇中CH3OH的质量分数可按下法:取0.1000g工业甲醇样品,以适量H2SO4酸化后,加入20.00mL 0.2000mol/L的K2Cr2O7溶液,再用0.3000mol/L (NH4)2Fe(SO4)2标准溶液滴定,耗去此标准液20.00mL时,刚好到达滴定终点。
已知:CH3OH+Cr2O72-+8H+=CO2↑+2Cr3++6H2O
①写出H2SO4酸化的K2Cr2O7溶液与(NH4)2Fe(SO4)2溶液反应的离子方程式。
②求此工业甲醇中CH3OH的质量分数。
25.工业上利用焦炭在石灰窑中燃烧放热,使石灰石分解生产CO2。主要反应如下:
C+O2→CO2 ①, CaCO3→CO2↑+CaO ②
(1)含碳酸钙95%的石灰石2.0 t按②完全分解(设杂质不分解),可得标准状况下CO2的体积为_________________m3。
(2)纯净的CaCO3和焦炭混合物m g在石灰窑中完全反应,所得CO2的物质的量范围是_______________________。
(3)纯净的CaCO3和焦炭按①②完全反应,当窑内配比率![]()
![]() =2.2时,窑气中CO2的最大体积分数为多少?(设空气只含N2与O2,且体积比为4∶1,下同)
=2.2时,窑气中CO2的最大体积分数为多少?(设空气只含N2与O2,且体积比为4∶1,下同)
(4)某次窑气成分如下:O2 0.2%,CO 0.2%,CO2 41.6%,其余为N2。则此次窑内配比率![]() 为何值?
为何值?
高三化学周练(四)
可能用到的相对原子质量:H—1,C—12,N—14,O—16,Na—23,Li—7,Si—28
S—32,Cl—35.5,K—39,Al—27,Co—59
第I卷(选择题 共64分)
一、单项选择题(本题包括8小题,每小题4分,共32分。每小题只有一个选项符合题意)
1.D 2.C 3.D 4.B 5.D 6.C 7.C 8.C
二、不定项选择题(本题包括8小题,每小题4分,共32分。每小题有一个或两个选项符合题意。若正确答案只包括一个选项,多选时,该题为0分;若正确答案包括两个选项,只选一个且正确的得2分,选两个且都正确的得满分,但只要选错一个该小题就为0分)
9.AB 10.B 11.BC 12.B 13.BC 14.CD 15.A 16.A
第Ⅱ卷(选择题 共86分)
三、(本题包括2小题,共22分)
17.(1)控制气流速度;让气体混合均匀;干燥混合气体.
(2)大于或等于 (3)吸收过量的氯气 (4)C D
![]() (6)分液;A
B
(6)分液;A
B
18.(1)Ca(OH)2+Na2CO3=2NaOH+CaCO3↓(2分)
(2)不合理(1分),因为NH4Cl受热分解,故蒸发灼烧不可能得到NH4Cl晶体;同时,蒸发会使溶于水中的淀粉呈糊状物(2分)
(3)渗析(1分) 必须更换渗析用的蒸馏水,至渗析液中检不出Cl-(1分)
(4)①在浓氨水中滴加浓NaOH溶液或同时加入浓NaOH溶液和NH4Cl晶体(2分)
②氨水中存在以下平衡:NH4++OH-![]() NH3·H2O
NH3·H2O![]() NH3+H2O,当向浓氨水中滴加浓NaOH溶液时,由于c(OH-)的增加,促使上述平衡正向移动,从而放出NH3(2分)
NH3+H2O,当向浓氨水中滴加浓NaOH溶液时,由于c(OH-)的增加,促使上述平衡正向移动,从而放出NH3(2分)
四、(本题包括2小题,共18分)
19.(1)⑴![]() (1分) 第二周期、第ⅦA族
(2分)
(1分) 第二周期、第ⅦA族
(2分)
⑵ Na+ (1分)
⑶ 2Al+2NaOH+2H2O=2NaAlO2+3H2↑ (2分) ⑷ Na3AlF6
(2分)
20.(1)0.3mol·L-1·S-1 0.7mol·L-1(4分)
(2) ![]() ×100%(2分) 、(3)85.7%(2分)减小 (1分) 升高温度 充入A气体 减小压强(2分)
(4)t1-t2 t3-t4降低温度(2分) 图(2分)
×100%(2分) 、(3)85.7%(2分)减小 (1分) 升高温度 充入A气体 减小压强(2分)
(4)t1-t2 t3-t4降低温度(2分) 图(2分)
五、(本题包括1小题,共10分)
21.⑴![]()
⑵4NO2+O2+2H2O=4HNO3 2Fe(OH)3 +3ClO- + 4OH- = 2FeO42- +2Cl-+5H2O
⑶Fe2C Fe3C 25%
六、(本题包括2小题,共18分)
22.(1)C7H6O3(1分);(2)c(1分);
(3)c.d(2分);
(4)
 (2分);
(2分);
(5) ⅰ: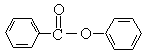 等(1分);ⅱ:
等(1分);ⅱ: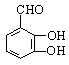 (1分)。
(1分)。
23.(1)a、CH3CH2CH2COOH b、CH3CH2COOCH3
(2)羟基、醛基 CH3COCH2COOH
(3)a; b、c
(4)CH3CHOHCH2CHO → CH3CH=CHCHO+H2O
(5) nCH3CH=CHCH2OH → [-CH-CH]n
(6)CH3CH2CH
七、(本题包括2小题,共18分)
24.(1)CH3OH(l)+3/2O2(g)=CO2(g)+2H2O(l) △H=-725.8kJ/mol(2分)
(2)①Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O (2分)
②96% (4分)
25.(1)425.6(1分);
(2)![]() mol< n(CO2)<
mol< n(CO2)<![]() mol(2分);
mol(2分);
(3)设n(C)=1mol mol,n(CaCO3)=2.2 mol,当空气O2中与C完全反应生成CO2时,所得窑气中CO2体积分数最大。
C + O2 → CO2 CaCO3→CO2↑+CaO
1 1 1 2.2 2.2
CO2体积分数=![]() ×100%=44.4%(3分);
×100%=44.4%(3分);
(4)设窑气为100mol,则n(N2)=100-41.6-0.2-0.2=58mol,总共有n(O2)=58/4=14.5mol;故参加反应的n(O2)=14.5mol-0.2mol=14.3mol;
2C + O2 → 2CO C + O2 → CO2 CaCO3→CO2↑+CaO
2 1 2 1 1 1 1 1
0.2 0.1 0.2 14.2 14.2 14.2 27.4 27.4
n(CaCO3)=27.4mol;n(C)=14.4mol;
∴![]() =1.90(4分);
=1.90(4分);