高三化学第二学期第2周周末训练题
综合训练(一) 编者:李玉屏 2008-02-29(限时120分钟)
第一部分 选择题(共70分)
一.选择题(本题包括10小题,每小题3分共30分,每小题只有一个答案正确)
1.居室装修用石材的放射性常用226 88Ra作为标准,居里夫人(Marie Curie)因对Ra元素的研究两度获得诺贝尔奖,下列叙述中正确的是
A.Ra元素位于元素周期表中第六周期ⅡA族
B.一个226 88Ra原子中含有138个中子
C.RaCl2的熔点比CaCl2高
D.Ra(OH)2是一种两性氢氧化物
2.下列说法中错误的是
A.磺化、硝化、水化、风化、钝化等都是化学变化
B.干馏、常压分馏、减压分馏都是物理变化
C.甘油不是油,纯碱不是碱,酚醛树脂不是酯,干冰不是冰
D.水煤气、裂解气、焦炉气、天然气都是混合物
3.阿伏加德罗常数为6.02×1023mol-1。下列叙述正确的是
A.在20℃,1.01×105Pa时,2.8gC2H4和CO的混合气体,含气体分子数为6.02×1022
B.1mol碳正离子(CH3+)中含电子数目为10×6.02×1023
C.0.5 LpH=1的H2SO4溶液中含6.02×1022个H+
D.标准状况下,11.2L 四氯化碳所含分子数为0.5×6.02×1023
4.2006年8月28日上午,我国首条纤维乙醇生产线——河南天冠集团3000吨级纤维乙醇项目,在镇平开发区开工奠基。这一项目打破了过去单纯以粮食类原料生产乙醇的历史,使利用秸秆类纤维质原料生产乙醇成为现实。下列有关说法中不正确的是
A.用这种纤维乙醇部分替代成品油,有助于缓解日益增长的成品油需求
B.这一项目不仅使秸秆类废物得到科学利用,而且能为国家节约大量粮食
C.乙醇能部分替代汽油作车用燃料是因为乙醇与汽油组成元素相同,化学成分相似
D.掺入10%燃料乙醇的乙醇汽油可以使汽车尾气中一氧化碳排放量下降
5.已知充分燃烧a g乙炔气体时生成1 mol二氧化碳气体和液态水,并放出热量b kJ,则乙炔燃烧的热化学方程式正确的是
A.2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l) △H =4b kJ/mol
B.C2H2(g)+![]() O2(g)=2CO2(g)+H2O(1) △H =-2b
kJ/mol
O2(g)=2CO2(g)+H2O(1) △H =-2b
kJ/mol
C.2C2H2(g)+5O2(g)=4CO2(g)+2H2O(1) △H =-2b kJ/mol
D.2C2H2(g)+5O2(g)=4CO2(g)+2H2O(1) △H = b kJ/mol
6.长征2号火箭承担运载“神六”的使命,氢化锂、氘化锂、氚化锂可以作为启动长征2号(CZ2F)火箭的优良炸药。下列说法正确的是
A、LiH、LiD、LiT的摩尔质量之比为1:2:3 B、它们都是强氧化剂
C、H、D、T之间互称为同素异形体 D、它们都是强还原剂
7.在配制一定物质的量浓度的盐酸溶液时,下列错误操作可使所配制溶液浓度偏高的是
A.用量筒量取浓盐酸时俯视读数 B.溶解搅拌时有液体飞溅
C.定容时俯视容量瓶瓶颈刻度线 D.摇匀后见液面下降,再加水至刻度线
 8.2007 年诺贝尔化学奖德国科学家格哈德 · 埃特尔对有关一氧化碳在金属铂表面的氧化过程的研究,催生了汽车尾气净化装置。净化装置中的催化转化器,可将 CO、NO、NO2 和碳氢化合物等转化为无害的物质,有效降低尾气对环境的危害。下列有关说法不正确的是
8.2007 年诺贝尔化学奖德国科学家格哈德 · 埃特尔对有关一氧化碳在金属铂表面的氧化过程的研究,催生了汽车尾气净化装置。净化装置中的催化转化器,可将 CO、NO、NO2 和碳氢化合物等转化为无害的物质,有效降低尾气对环境的危害。下列有关说法不正确的是
A.催化转化器中的铂催化剂可加快 CO 氧化
B.铂表面做成蜂窝状更有利于提高催化效果。
C.在铂催化下,NO、NO2 可被 CO 还原成 N2
D.碳氢化合物在铂催化下,被 CO 直接氧化成 CO2和 H2O
9.下列数据是对应物质的熔点
| Na2O | NaCl | AlF3 | AlCl3 |
| 920 | 801 | 1291 | 190 |
| BCl3 | Al2O3 | CO2 | SiO2 |
| -107 | 2073 | -57 | 1723 |
据此做出的下列判断中错误的是
A.铝的化合物的晶体中有的是离子晶体
B.表中只有BCl3和干冰是分子晶体
C.同族元素的氧化物可形成不同类型的晶体
D.不同族元素的氧化物可形成相同类型的晶体
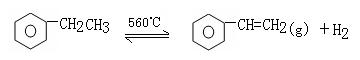 10.工业生产苯乙烯是利用乙苯的脱氢反应:
10.工业生产苯乙烯是利用乙苯的脱氢反应:
(g) (g) +Q
针对上述反应,在其它条件不变时,下列说法正确的是
A.加入适当催化剂,可以提高乙苯的转化率
B.在保持体积一定的条件下,充入较多的乙苯,可以提高乙苯的转化率
C.在加入乙苯至达到平衡过程中,混合气体的平均相对分子质量在不断增大
D.仅从平衡移动的角度分析,工业生产苯乙烯选择恒压条件优于恒容条件
二.选择题(本题包括10小题,每小题4分,共40分。每小题有一个或两个选项符合题意。)
11.据悉,奥运会上使用的发令枪所用的“火药”成分是氯酸钾和红磷,经撞击发出响声,同时产生白色烟雾。撞击时发生的化学方程式为: 5KClO3 + 6P=3P2O5 + 5KCl ,则下列有关叙述错误的是
A.上述反应是复分解反应
B.产生白色烟雾的原因是生成的P2O5白色固体小颗粒(烟)吸水性很强,吸收空气中的水分,生成磷酸小液滴(雾)
C.因红磷和白磷互为同分异构体,所以上述火药中的红磷可以用白磷代替
D.上述反应中消耗3molP时,转移电子的物质的量为15mol
12.NH4Cl是强酸弱碱盐,它在水溶液里的水解过程可用下图表示:
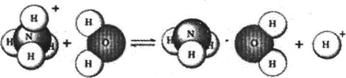
则下列有关NH4 Cl溶液里存在的微粒的叙述,正确的是
A.存在NH3·H2O,其结构式为: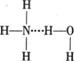
B.存在NH4+,其空间构型为正四面体
C.存在H3O+,其结构式为:![]()
D.不存在OH-
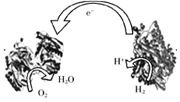 13.2006年,科学家们发明了一种能够给电子设备提供动力的生物燃料电池。该电池包括两个涂覆着酶的电极,它们处于充满空气和少量氢气的玻璃槽中。由于气体可以混合从而省去了昂贵的燃料隔离膜,其工作原理如图所示。下列说法正确的是
13.2006年,科学家们发明了一种能够给电子设备提供动力的生物燃料电池。该电池包括两个涂覆着酶的电极,它们处于充满空气和少量氢气的玻璃槽中。由于气体可以混合从而省去了昂贵的燃料隔离膜,其工作原理如图所示。下列说法正确的是
A.左边为该电池的负极
B.该电池可在高温环境下使用
C.该电池负极反应为:H2-2e-=2H+
D.该电池正极反应为:O2+4e-=2O2-
14.某溶液中只含有Na+、H+、OH-、A-四种离子,下列说法正确的是
A.若溶液中c(A-)== c(Na+),则溶液一定呈中性
B.溶液中不可能存在:c(Na+)>c (A-)>c(OH-)>c(H+)
C.若c(OH-)>c(H+),溶液中不可能存在:c(Na+)>c(OH-)>c(A-)>c(H+)
D.若溶质为NaA、HA,则一定存在: c(A-)>c(Na+)>c(H+)>c(OH-)
15.某无色溶液与NH4HCO3作用能产生气体,此溶液中可能大量共存的离子组是
A.Cl-、Mg2+、H+、Cu2+、SO42- B.Na+、Ba2+、NO3-、OH-、SO42-
C.MnO4-、K+、Cl-、H+、SO42- D.K+、NO3-、SO42-、OH-、Na+
16.将足量的CO2不断通入KOH、Ca(OH)2、KAlO2的混合溶液中,生成沉淀与通入CO2的量的关系可表示为:
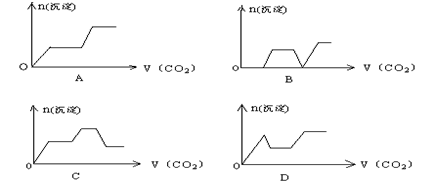
17.下列反应的离子方程式正确的是
A.等物质的量的Ba(OH)2与NH4HSO4在稀溶液中反应:
Ba2++2OH—+2H++SO42—=BaSO4↓+2H2O
B.氢氧化铁与足量的氢碘酸溶液反应:Fe(OH)3+3H+=Fe3++3H2O
C. 足量CO2通入饱和碳酸钠溶液:CO2+CO32—+H2O=2HCO3—
D.向碳酸氢钙溶液中滴入过量澄清石灰水:Ca2++HCO3—+OH— =CaCO3↓+H2O
18.某无色溶液可能由K2CO3、MgCl2、NaHCO3、BaCl2溶液中的一种或几种组成。向溶液
中加入烧碱溶液出现白色沉淀,加入稀硫酸也出现白色沉淀并放出气体。据此分析,下列判断中正确的是
①肯定有BaCl2; ②肯定有MgCl2; ③肯定有NaHCO3;
④肯定有Na2CO3或NaHCO3 ⑤肯定没有MgCl2
A.①②③ B.②④ C.①③ D.①③⑤
19.下列实验设计能达到实验目的的是
| 实验目的 | 实验步骤及现象 | |
| A | 检验亚硫酸钠试样是否变质 |
|
| B | 检验某卤代烃是否是氯代烃 |
|
| C | 证明酸性条件下H2O2氧化性比I2强 |
|
| D | 除去氯化钠晶体中少量硝酸钾 |
|
20.新鲜水果、蔬菜、乳制品中富含的维生素C,具有明显的抗衰老作用,但易被空气氧化。某课外小组利用碘滴定法测某橙汁中维生素C的含量,其化学方程式如下:
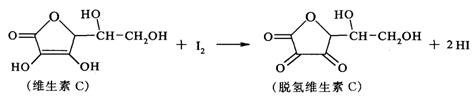
下列说法正确的是
A.上述反应为取代反应
B.维生素C在酸性条件下水解只得到1种产物
C.维生素C不可溶于水,可溶于有机溶剂
D.脱氢维生素C的分子式为C6H8O6
第二部分 非选择题(共80分)
三、本题包括3小题,共22分
21.(6分)化学实验设计和操作中必须十分重视安全问题和环境保护问题。下列实验问题处理方法不正确的是 。(选错倒扣分)
①在制氧气时排水法收集氧气后出现倒吸现象,立即松开试管上的橡皮塞。
②在气体发生装置上直接点燃一氧化碳气体时,必须要先检验一氧化碳气体的浓度。最简单的方法是用排空气的方法先收集一试管气体,点燃气体,听爆鸣声。
③不慎将酸溅到眼中,应立即用水冲洗,边洗边眨眼睛。
④给试管中的液体加热时,不时移动试管或加入碎瓷片,以免暴沸伤人。
⑤用碱式滴定管量取20.00mL 0.1000 mol/L的KMnO4溶液。
⑥稀释浓硫酸时,可先在烧杯中加一定体积的水,再边搅拌边加入浓硫酸。
22.(10分)从含银、铜、金和铂的金属废料中提取金、银、铂的一种工艺如下:
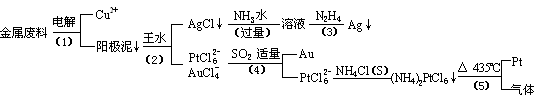
根据以上工艺回答下列问题:
(1)电解时,以金属废料为阳极,纯铜为阴极,CuSO4溶液为电解液,写出电解方程式: 阳极: ,阴极: ;
若工作一段时间后测得导线上通过了3.01×1024个e-,则阴极有 g铜析出。
(2)步骤(4)中SO2被氧化成H2SO4,试写出该步骤的离子反应方程式:
![]() ;
;
(3)金和浓硝酸反应的化学方程式为:Au + 6HNO3(浓) Au(NO3)3 + 3NO2↑+ 3H2O
但该反应的平衡常数很小,所以金和浓硝酸几乎不反应,但金却可以溶于王水,试简要解释之:
。
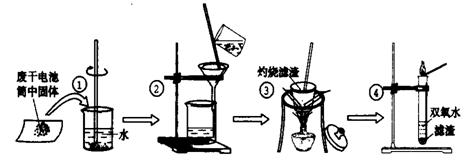 23.(16分)
某同学用废干电池内的黑色固体(可能含有MnO2、NH4Cl、ZnCl2等物质)进行如图所示实验:
23.(16分)
某同学用废干电池内的黑色固体(可能含有MnO2、NH4Cl、ZnCl2等物质)进行如图所示实验:
(1) 操作②名称是 ,该过程玻璃棒的作用: 。
(2) 操作④加入③中所得滤渣,试管中迅速产生能使带火星的木条复燃的气体,由此推测滤渣含有MnO2,试管中发生反应的化学方程式: ;MnO2在反应中是 剂。
(3) 操作③灼烧滤渣中的黑色固体时,产生一种使澄清石灰水变浑浊的气体,由此推测滤渣中除含有MnO2外,还存在的物质为: 。
(4) 已知氯化锌与稀氨水反应先生成Zn(OH)2白色沉淀,Zn(OH)2可以溶于稀氨水生成可溶性的[Zn(NH3)4](OH)2;下列是该同学对操作②的滤液成分进行探究的过程:
①检验NH4Cl:取少量滤液加入NaOH固体,并加热,产生一种使湿润的红色石蕊试纸
变 色的刺激性气体。
②检验ZnCl2:取少量滤液逐滴滴入稀氨水,有白色沉淀;滴入过量稀氨水后白色沉淀
溶解。这两步反应的离子方程式是: ; 。
四、本题包括3小题,共29分
24.(8分) 能源问题是人类社会面临的重大课题,甲醇是未来重要的能源物质。一定条件下,在体积为2 L的密闭容器中,1mol一氧化碳与2mol氢气反应生成甲醇(催化剂为Cu2O/ZnO):
CO(g)+2H2(g)![]() CH3OH(g) △H<0
CH3OH(g) △H<0
根据题意完成下列各题:
(1)反应达到平衡时,平衡常数表达式K= ,升高温度,K值 (填“增大”、“减小”或“不变”)。
(2)在500℃,10min反应达平衡,此时甲醇的物质的量浓度为0.3mol/L,从反应开始到平衡,氢气的平均反应速率v(H2)= 。
(3)在其它条件不变的情况下,把反应处于平衡体系的容器的体积压缩为1 L,下列有关该体系的说法正确的是 。
A.氢气的浓度减少 B.正反应速率加快,逆反应速率减慢
C.甲醇的物质的量增加 D.重新平衡时c(CO)/c(CH3OH)不变
25.(19分)
Ⅰ.三氟化氮(NF3)是一种新型电子材料,它在潮湿的空气中与水蒸气能发生氧化还原反应,其反应的产物有:HF、NO和HNO3 ,请根据要求回答下列问题:
(1)反应过程中,被氧化与被还原的元素的物质的量之比为_______________。
(2)写出该反应的化学方程式
__________________________________________________________________。
(3)NF3是一种无色、无臭的气体,但一旦NF3在空气中泄漏,还是易于发现。你判断该气体泄漏时的现象是________________________________________________________。
(4)一旦NF3泄漏,可以用 溶液喷淋的方法减少污染。
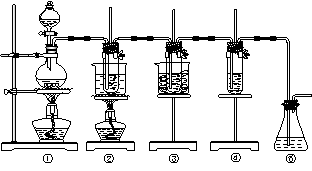
Ⅱ.在实验室里可用下图所示装置制取氯酸钾、次氯酸钠和探究氯水的性质。


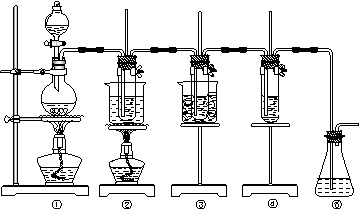

图中:①为氯气发生装置;②的试管里盛有15 mL 30% KOH溶液,并置于热水浴中;③的试管里盛有15 mL 8% NaOH溶液,并置于冰水浴中;④的试管里加有紫色石蕊试液;
请填写下列空白:
(1)制取氯气时,在烧瓶里加入一定量的二氧化锰,通过分液漏斗向烧瓶中加入适量的浓盐酸。实验时为了除去氯气中的氯化氢气体,可在①与②之间安装盛有________或_________(填写化学试剂名称)的净化装置。
(2)比较制取氯酸钾和次氯酸钠的条件,二者的差异是:______________________________________。
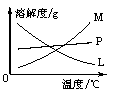
②的试管中反应的离子方程式为___________________________。反应完毕经冷却后,②的试管中有大量晶体析出。下图中符合该晶体溶解度曲线的是_______(填写编号字母);从②的试管中分离出该晶体的方法是__________(填写实验操作名称)。
(3)实验中可观察到④的试管里溶液的颜色发生了如下变化,请填写下表中的空白:
| 实验现象 | 原因 |
| 溶液最初从紫色逐渐变为_______色 | 氯气与水反应生成的H+使石蕊变色 |
| 随后溶液逐渐变为无色 | _______________________________ |
(4)有同学指出该实验装置存在明显不妥之处,请在原实验装置图上作图完善,说明使用何种化学试剂,理由是_______________________________________________
26.(11分)常温下在20mL 0.1 mol/L Na2CO3溶液中逐滴加入0.1mol/L HCl溶液40mL,溶
![]()
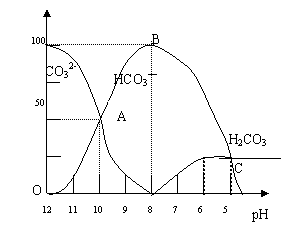 液的pH逐渐降低,此时溶液中含碳元素的微粒物质的量浓度的百分含量(纵轴)也发生变
液的pH逐渐降低,此时溶液中含碳元素的微粒物质的量浓度的百分含量(纵轴)也发生变
化(CO2因逸出未画出),如下图所示:
回答下列问题:
(1)20 mL 0.1mol/LNa2CO3溶液呈碱性的
原因是(用离子方程式表示) ;
其溶液中所有阳离子和阴离子的浓度有何关系?
(用等式表示) 。
(2)某同学认为该溶液中Na2CO3的水解是微
弱的,发生水解的CO32-离子不超过其总量的10%。
请你设计简单实验证明该同学的观点是否正确 。
(3)若向20mL 0.1mol/LNa2CO3溶液中加入BaCl2粉末3.328×10-7g时开始产生沉淀X,则Ksp(X)= 。
(4)请写出OAB段的离子方程式 ;当混合液pH= 时,开始放出CO2气体。
五、(本题包括1小题,共10分)
27.(10分)
已知: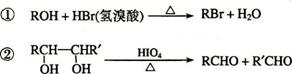
C、H、O三种元素组成的的有机物A,其相对分子质量为88,分子中C、H、O原子个数比为2:4:1 。A中含有碳氧双键,与A相关的反应如下:
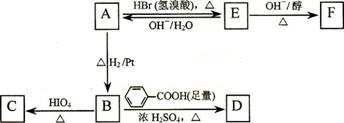
⑴.A的分子式为___________。
⑵A有2个不同的含氧官能团,其名称是 。.
⑶.写出E → F的反应类型: _______ ____。
⑷.写出C和F的结构简式:C ___________ 、 F ___________。
六、选做题(本题包括2小题,每小题10分,考生只能选做一题。28小题为“有机化学基础”内容的试题,29题为“物质结构与性质”内容的试题)
28. (10分)一种用于治疗高血脂的新药灭脂灵是按如下路线合成的:
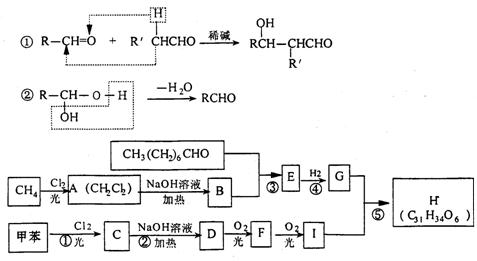
已知G的分子式为C10H22O3,试回答:
(1)写出B、E结构简式:_________ 、________;
(2)上述反应中属于取代反应的是___________(填序号);
(3)写出反应方程式:
I.反应② ;
Ⅱ.F与银氨溶液反应: 。
29.(10分)下表由元素周期表的前三周期去掉副族上方的空白区域后组合而成,表中虚线处为ⅡA、ⅢA族的连接处,请用相应的化学用语回答下列问题:
| a | |||||||
| b |
|
| c | d | e | f | |
| g | h |
(1)写出仅由e形成的两种带有相同电荷数的阴离子的符号: 、 。
(2)d元素名称为 ,其基态原子的电子排布式为 。
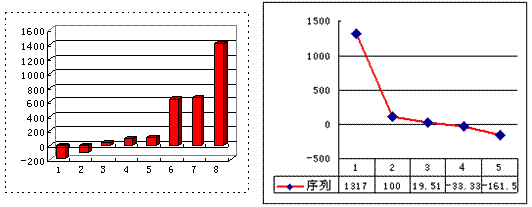
(3)上左图是表示第三周期8种元素单质的熔点(℃)柱形图,已知柱形“1”代表Ar,则其中柱形“8”代表 (填化学式),是 晶体。
(4)b、c、d、e、f的氢化物的沸点(℃)直角坐标图(上右图),序列“5”的氢化物的名称是 ,空间构型为 ;序列“2”的氢化物的结构式为 ,其中心原子的杂化轨道类型是 杂化。
高三化学第2周周末训练题参考答案
一、选择题(每小题3分,共30分)
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| B | B | A | C | B | D | C | D | B | D |
二、选择题(每小题4分,共40分)
| 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 |
| AC | BC | C | A | D | C | CD | C | D | B |
21.(6分)①②⑤(每错1个倒扣2分,扣完为止)
22.( 10分)
(1)Cu—2e-=Cu2+(2分)、 Cu2+ + 2e-=Cu(2分) 160(2分)
(2)2AuCl4-+3SO2 + 6 H2O =2Au + 8Cl- + 3SO42- + 12H+ (2分)
(3)王水中含有大量的Cl-,Au3+与Cl-可生成AuCl4-,使该平衡中Au3+浓度降低,平衡正移,金即可溶于王水。(2分)
23.(16分,每空2分)(1)过滤,引流作用。
(2)2H2O2 ![]() 2H2O + O2↑,催化。 (3)炭(或碳、或C)
2H2O + O2↑,催化。 (3)炭(或碳、或C)
(4)①蓝。②Zn 2+ +2NH3·H2O= Zn (OH)2↓+2 NH4 +;
Zn (OH)2+ 4 NH3·H2O= [Zn (NH3) 4]2++2OH-+4H2O。
24.(8分)(1)K=c(CH3OH)/c(CO)·c2(H2) ,减小。(各2分)
(2)0.06 mol·(L·min)-1 (2分)(3)AC(2分)
25.(19分)
Ⅰ.(1)1:2 (1分)
(2)3NF3+5H2O=2NO+HNO3+9HF(2分)
(3)产生红棕色气体,产生刺激性气味气体,产生白雾。(各1分)
(4)NaOH 或KOH (1分)
Ⅱ.(1)可在①与②之间安装盛有__饱和食盐水 1’或稀盐酸 1’(填写化学试剂名称)的净化装置。
|
![]() ②的试管中反应的离子方程式为_3Cl2 + 6OH—
ClO3— + 5Cl—+3H2O 2’ _。符合该晶体溶解度曲线的是_M__1’__(填写编号字母);分离出晶体的方法是_过滤 1’_ (填写实验操作名称)。
②的试管中反应的离子方程式为_3Cl2 + 6OH—
ClO3— + 5Cl—+3H2O 2’ _。符合该晶体溶解度曲线的是_M__1’__(填写编号字母);分离出晶体的方法是_过滤 1’_ (填写实验操作名称)。
(3)实验中可观察到④的试管里溶液的颜色发生了如下变化,请填写下表中的空白:
| 实验现象 | 原因 |
| 溶液最初从紫色逐渐变为_红_ 1’_色 | 氯气与水反应生成的H+使石蕊变色 |
| 随后溶液逐渐变为无色 | 氯气与水反应生成HClO将石蕊氧化成无色物质 1’ |
(4)有同学指出该实验装置存在明显不妥之处,请在原实验装置图上作图完善,说明使用何种化学试剂,理由用氢氧化钠溶液吸收尾气,防止污染空气。1’
|


26.(1)CO32-+H2O ![]() HCO3-+OH—(2分);
HCO3-+OH—(2分);
c(Na+)+c(H+)=2c (CO32-)+c(HCO3-)+c (OH-)(1)
(2)用pH试纸(或pH计)测常温下0.1mol·L-1 Na2CO3溶液的pH,(1分)若pH<12,则该同学的观点正确;若pH>12,则该同学的观点不正确。(1分)(共2分)
(3) 8.0×10-9(2分) (4) CO32-+H+=HCO3- ; 6 (各2分)
27.(10分,每空各2分)⑴.C4H8O2 ⑵. 羰基、羟基 ⑶. 消去反应
⑷. CH3CHO ![]()
28. (10分)
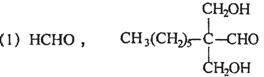 (各2分)
(各2分)
![]() (2)①②⑤(2分)
(2)①②⑤(2分)
(3)Ⅰ、C6H5CH2Cl+H2O C6H5CH2OH+HCl (2分)
![]() (2分)
(2分)
29.(10分)
(1)O2- O22-(或O2-、O3-)(2分)
(2)氮(1分) 1s22s22p3(1分)
(3)Si(1分) 原子(1分)
(4)甲烷(1分) 正四面体(1分) ![]() (1分) sp3 (1分)
(1分) sp3 (1分)