高三化学模拟测试题(1)
化 学 试 卷
第一部分 选择题(共70分)
相对原子质量:H 1 C 12 O 16 S 32 Cl 35.5 I 127 Na 23 Al 27 Fe 56 As 75
一、选择题(本题包括10小题,每小题3分,共30分。每小题只有一个选项符合题意。)
1.下列物质能使品红溶液退色的是( )
①活性炭 ②过氧化钠 ③氯水 ④二氧化硫 ⑤臭氧
A.①③④ B.②④⑤ C.①②③④ D.①②③④⑤
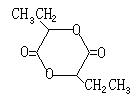
2.某种药物主要成分X的分子结构为:![]() 。以下关于该有机物X的说法中错误的是( )
。以下关于该有机物X的说法中错误的是( )
A.X难溶于水,易溶于有机溶剂 B.X能跟 溴水反应
C.X能使酸性高锰酸钾溶液褪色 D.X能发生水解反应
3.某金属硝酸盐受热分解生成金属氧化物、NO2和O2。假如生成的NO2和O2的物质的量之比为8︰1,则金属元素的化合价在反应过程中的变化是( )
A.升高 B.降低 C.不变 D.无法确定
4.下列物质的水溶液中,除水分子外,不存在其它分子的是( )
A.KF B.Na2S C.H3PO4 D.HNO3
5.测定某分子式为C11H16的烃的结构时,确定其分子中含有2个甲基、2个亚甲基(-CH2-)和1
个次甲基( ![]() ),且分子中除苯环外不含其它环状结构。该分子可能的结构有( )
),且分子中除苯环外不含其它环状结构。该分子可能的结构有( )
A.2种 B.4种 C.8种 D.12种
6. 欲证明一瓶无色液体为蒸馏水,以下实验方法最可靠的是( )
A.测得其pH值为7 B.鉴定所含元素仅有H和O
C.电解得到体积比为2︰1的两种气体 D.101.325kPa时沸点为100℃
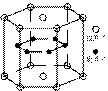 7. 2001年世界十大科技成果之一是日本科学家发现了硼镁形成的化合物。该
7. 2001年世界十大科技成果之一是日本科学家发现了硼镁形成的化合物。该
化合物刷新了金属化合物超导温度的最高记录。图3-1示意的是该化合物的
晶体结构单元,每个单元中镁原子间形成正六棱柱,其中上、下底面还各
有一个镁原子;六个硼原子位于棱柱内。则该化合物的化学式为( )
A.Mg2B B.MgB2 C.Mg3B2 D.MgB
8.下列叙述正确的是( )
A.在101kPa时,1molC燃烧生成CO放出110.5kJ热量,则C的燃烧热为110.5kJ /mol
B.在25℃,101kPa时,1molH2燃烧生成液态水,放出285.8kJ热量,则H2的燃烧热为—285.8kJ/mol
C.稀强酸和稀强碱反应生成1mol水所放出的热量就是中和热
D.含有0.5molH2SO4的硫酸溶液和含有1molNaOH的烧碱溶液反应放出的热量就是中和热
9.某溶液中加入铝片产生大量氢气,则在该溶液中一定能够大量共存的离子组是( )
A.Cl-、CO32-、Na+、Ca2+ B.SO2-4 、CH3COO-、K+、Mg2+
C.Na+、K+、SO2-4 、Cl- D.NH+ 4 、Ba2+、Cl-、HCO- 3
10.下列有关实验的描述正确的是( )
A.用湿润的pH试纸测定稀盐酸的pH
B.不能在石英坩埚中熔融氢氧化钠
C.在苯酚溶液中加入少量溴水,振荡,有白色沉淀产生
D.为了除去乙酸乙酯中混有的少量乙酸,可向其中加入适量的乙醇,加热
二、选择题(本题包括10小题,每小题4分,共40分。每题有一个或两个选项符合题意。若正确答案只包括一个选项,多选时,该题0分;若包括两个选项,只选一个且正确的给 2分,选两个且都正确的给4分,但只要选错一个,该题就为0分。)
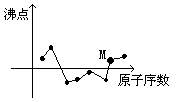 11. 右图中曲线表示原子序数在前20号中的某些元素的原子序数
11. 右图中曲线表示原子序数在前20号中的某些元素的原子序数
(按递增顺序排列)和单质的沸点的关系,其中M点表示的
元素是( )
A、H B、S C、Si D、Ca
12.能够使反应Cu+2H2O=Cu(OH)2↓+H2↑发生的是( )
A.铜片作原电池的负极,碳棒作原电池的正极,氯化钠溶液作电解质溶液
B.铜锌合金在潮湿空气中发生电化学腐蚀
C.用铜片作电解池的阴极和阳极,电解Na2SO4溶液
D用铜片作电解池的阴极和阳极,电解稀硫酸
13. 已知A、B、C、D、E是核电荷数依次增大的五种短周期主族元素,原子半径按D、E、B、C、A 的顺序依次减小,B和E 同主族,下列推断不正确的是( )
A.C、D、E不可能在同一周期
B.D可能在第二周期
C.A、B、E不可能在同一主族
D.C和D化合物形成的晶体可能为原子晶体
14.常温下,向10mLpH=4的一元强酸HA中加入VmLpH=10的一元强碱BOH溶液,若混合溶液的pH=7(混合溶液体积设为V总mL,假定V总=10+V),则对反应后的溶液的叙述正确的是( )
A.c(H+)=c(OH-)=c(A-)=c(B+) B. c(A-)=c(B+)
C.V总 < 20mL D.V总 = 20mL
15.反应SO2(g)+NO2(g)![]() NO(g)+SO3(g)在容积固定的密闭容器中达到平衡。在其它条件不变时,向容器内充入一定量O2。下列说法正确的是( )
NO(g)+SO3(g)在容积固定的密闭容器中达到平衡。在其它条件不变时,向容器内充入一定量O2。下列说法正确的是( )
A.平衡向左移动,容器内压强不一定增大
B.平衡向右移动,容器内压强不一定增大
C.平衡不一定移动,容器内压强一定增大
D.平衡向右移动,SO2的转化率提高
16. 以下物质的溶液在空气中蒸发至干能够得到纯净溶质的是( )
A.Na2CO3 B.FeSO4 C.AlCl3 D. MgCl2
17.以下叙述正确的是( )
A.1mol/LAl2(SO4)3溶液中Al3+的浓度为2mol/L
B.1molSiO2和1mol晶体Si中含有的共价键数都是4NA(NA表示阿伏加德罗常数)
C.强电解质溶液的导电性比弱电解质溶液的导电性强
D.碱性溶液中可以存在CH3COOH分子
18.下列离子方程式书写不正确的是( )
A.向Ba(OH)2溶液中逐滴滴入Na2SO4溶液至恰好完全反应:
Ba2++SO2-4 =BaSO4↓
B.向苯酚钠溶液中通入少量CO2:
2C6H5O-+H2O+CO2→2C6H5OH+CO2-3
C.向澄清石灰水中通入过量CO2
Ca2++CO2+2OH-=CaCO3↓+H2O
D向含有0.1molFeBr2溶液中慢慢通入2.24L(标况)Cl2:
2Fe2++2Br-+2Cl2=2Fe3++Br2+4Cl-
19.下列叙述正确的是( )
A. 只要含有金属阳离子的晶体就一定是离子晶体
B.在冰块中,每个水分子中存在2个氢键
C.理论上,所有氧化还原反应均可设计成原电池
D.极性分子中一定含有极性键,非极性分子中不一定含有非极性键
20. 某氧原子的质量为a g,12C原子的质量为b g,且NA表示阿佛加德罗常数,下列说法中正确的是( )
A、氧元素的相对原子质量为12a/b B、1mol该氧原子的质量为aNAg
C、x g该氧原子所含的电子数为8x/a D、y g 该氧原子的中子数一定为8y/a
第二部分 非选择题 (共80分)
三、(本题包括3小题,共33分)
21.(8分)现有下列仪器或用品:a.铁架台(含铁圈、铁夹) b.锥形瓶 c.滴定管 d.烧杯(若干)
e.玻璃棒 f.胶头滴管 g.托盘天平(含砝码) h.滤纸 i.量筒 j.漏斗 k.温度计
现有下列试剂:A.NaOH固体 B.碳酸钠溶液 C.氯化镁溶液 D.蒸馏水
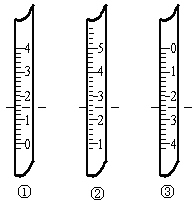 试填空:
试填空:
①如图分别是温度计、量筒、滴定管的一部分,
下述判断及读数(虚线刻度)不正确的是_______
A.①是量筒,读数为1.5mL
B.②是量筒,读数为2.5mL
C.③是滴定管,读数为2.50mL
D.②是温度计,读数是2.5℃
②用氢氧化钠配制一定物质的量浓度的氢氧化钠溶液时,还缺少的仪器是 。
③除去Mg(OH)2中混有的少量Ca(OH)2:可以用的试剂是: (选填序号),操作方法是滴加试剂、_______、洗涤。
④完成③,上述仪器或用品用到的有 (从上述仪器或用品中选择,并填上相应序号) 。
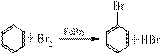
22.(12分)下图为研究苯和溴的取代反应的实验装置图。其中A试管下端开了一个小孔,塞好石棉绒,再加入适量的铁屑。

(1)向A中逐滴加入溴和苯的混合液,几秒钟内就发生反应。有关A中反应的化学方程式为:
①
②
(2)试管C中苯的作用是 。
反应开始后,观察D和E两试管,D可以看到的现象是 ;
E可以看到的现象是 。
反应2~3min后,装置B中观察到的现象是 。
(3)在实验的整套装置中,具有防倒吸的装置有 (填字母代号)。
(4)该套实验装置的设计,构思巧妙,科学合理。除了具有操作方便,成功率高,各步现象明显,产物便于观察外,还有一个明显的优点是 。
23.(13分)已知FeS0![]() 在高温下分解生成Fe
在高温下分解生成Fe![]() O
O![]() 、S0
、S0![]() 和SO
和SO![]() 。某研究性学习小组先用下图所示装置检验该反应所产生的气态物质,然后用装置中A瓶内的混合物来测定已分解的FeS0
。某研究性学习小组先用下图所示装置检验该反应所产生的气态物质,然后用装置中A瓶内的混合物来测定已分解的FeS0![]() 的质量。
的质量。
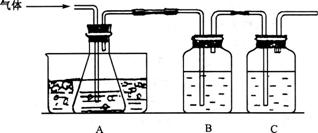
请回答下列问题:
(1)实验时,A瓶的作用是检验测定生成的S0![]() 气体,A瓶内盛水,水中滴有数滴 溶液,B瓶内盛品红试液,C瓶内盛NaOH溶液,NaOH溶液的作用是___________________________________。
气体,A瓶内盛水,水中滴有数滴 溶液,B瓶内盛品红试液,C瓶内盛NaOH溶液,NaOH溶液的作用是___________________________________。
(2)A瓶内所盛试剂的作用是___________ __,A瓶要用冰水冷却的原因是_________________________________________________________________。
(3)检验后,用A瓶内的混合物测定FeS0![]() 已分解的质量,此实验操作的第一步是(简述操作步骤)____________________________________________________________。
已分解的质量,此实验操作的第一步是(简述操作步骤)____________________________________________________________。
(4)测定过程中,在过滤器上将沉淀洗净后,将沉淀灼烧并冷却至室温,称量其质量为a![]() g,再次灼烧冷却至室温称量其质量为a
g,再次灼烧冷却至室温称量其质量为a![]() g,且a
g,且a![]() <a
<a![]() ,接下来的操作应当是
,接下来的操作应当是
________________________________________________ 。
(5)已经分解的FeS0![]() 的质量是___________
_(沉淀质量用a表示,填计算式)。
的质量是___________
_(沉淀质量用a表示,填计算式)。
四、(本题包括3小题,共27分)
24. (8分)在元素周期表中,锌(30Zn)、镉(48Cd)、汞(80Hg)同属于锌族,锌和汞在自然界中
常共生,镉的金属活动性介于锌和汞之间。湿法炼锌过程中产生的铜镉渣中含有Cu、Cd、Zn等多种金属,可用于生产金属镉。镉的主要用途可以用作镍—镉电池,以及用于颜料生产,镉化合物还在PVC稳定剂、发光材料、半导体材料、杀菌剂等方面有广泛的应用。镉的生产流程如图示意如下:
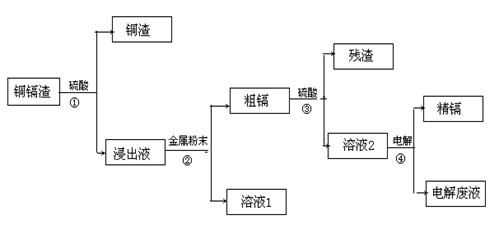
请回答下列问题:
(1)镉元素的核外电子排布式为 ;周期表中第 周期,第 族。
(2)写出步骤①反应的离子方程式 。
(3)步骤②所加入的金属的名称是 。
(4)步骤④用“溶液2”作电解液,镉在 极析出,该电极材料是
(5)“电解废液”中含有镉,不能直接作为污水排放。目前含镉的废水处理的方式有两种,一种是在含镉污水中加入硫化钠,沉淀镉离子,另一种是加入聚合硫酸铁和聚合氯化铝,沉淀镉离子。写出硫化钠沉淀镉离子的离子方程式 。
25. (9分)为了预防碘缺乏症,国家规定每千克食盐中应含40~50mg碘酸钾。碘酸钾晶体有较高的稳定性,但在酸性溶液中,碘酸钾是一种较强的氧化剂,能跟某些还原剂作用生成碘;在碱
性溶液中,碘酸钾能被氯气、次氯酸等强氧化剂氧化为更高价的碘的含氧酸盐。
工业生产碘酸钾的流程如下:
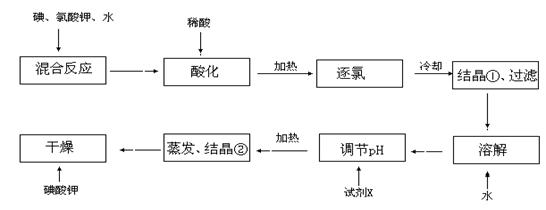
![]() (1)碘、氯酸钾和水混合后的反应为:I2+ KClO3
+ H2O KH(IO3)2 + KCl+ Cl2↑。已知反应时,两种还原产物所得电子数目相同,请配平该反应的化学方程式:
(1)碘、氯酸钾和水混合后的反应为:I2+ KClO3
+ H2O KH(IO3)2 + KCl+ Cl2↑。已知反应时,两种还原产物所得电子数目相同,请配平该反应的化学方程式:
。
(2)混合反应后,用稀酸酸化的作用是
(3)X的化学式为 ;写出用试剂X调节pH的化学方程式
(4)生产中,如果省去“酸化”、“逐氯”、“结晶①、过滤”这三步操作,直接用试剂X调整反应后溶液的pH,对生产碘酸钾的影响是 。
26.(10分)若不上慎发生砒霜泄露,应急的措施是采用石灰中和,使被污染的河水含砷量降低到
国家允许的标准范围内,以消除可能造成的危害。 测定砷的含量是利用下述反应:
AsO33-+I2+H2O![]() AsO43-+2I-+2H+
AsO43-+2I-+2H+
此反应为可逆反应,控制溶液的酸碱性,可以测定不同价态(+3或+5)的砷;调节溶液pH值,可以使平衡明显朝正反应方向移动,也可以明显朝逆反应方向移动。
(1)由此可知,AsO33-和AsO43-中,增大pH值, 的还原性增强;降低pH值, 的氧化性增强。
(2)要使反应顺利朝正反应方向进行,pH值不能太大,原因是 。
(3)今有一试样,含As2O3和As2O5及其对测定没有影响的杂质,将此试样用NaOH溶液溶解后,在中性溶液中用0.0200 mol·L-1的I2—KI溶液滴定,用去25.00mL。滴定完毕后,使溶液呈酸性,加入过量的KI。由此析出的碘又用0.125 mol·L-1的Na2S2O3溶液滴定,用去24.00mL。试计算试样中的质量:As2O3 g,As2O5 g。(已知2Na2S2O3+ I2 = Na2S4O6 +2NaI)
五、(本题包括2小题,共20分)
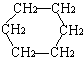
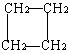
27. (8分)环丙烷可作为全身麻醉剂,环已烷是重要的有机溶剂。下面是部分环烷烃及烷烃衍生物的结构简式、键线式和某此有机化合物的反应式(其中Pt、Ni是催化剂)。
| 结构简式 |
|
| Br—CH2—CH2—CH(CH3)—CH2—Br |
| 键线式 |
|
|
|
![]() ①
①
![]()
![]() ②
②
![]() ③
③
④
回答下列问题:
.... ⑴环烷烃与相同碳原子数的 是同分异构体。
.... ⑵从反应①~③可以看出,最容易发生开环加成反应的环烷烃是 (填名称)。
判断依据为 。
.... ⑶环烷烃还可以与卤素单质,卤化氢发生类似的开环加成反应,如环丁烷与HBr在一定条件下反
应,其化学方程式为 (用键线式表示,不需注明反应条件)。
.... ⑷写出鉴别环丙烷和丙烯的一种方法。试剂 ;现象与结论
。
28.(12分) 已知 (注:R,R’为烃基)
A为有机合成中间体,在一定条件下发生消去反应,可能得到两种互为同分异构体的产物,其
中的一种B可用于制取合成树脂、染料等多种化工产品。A能发生如下图所示的变化。
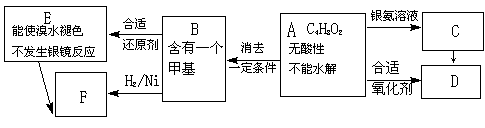 |
试回答
(1)写出符合下述条件A的同分异构体结构简式(各任写一种):
a.具有酸性______________________b.能发生水解反应______________________
(2)A分子中的官能团是 。
(3) D的结构简式是 ,该分子中含有 个手性碳。
(4)C→D的反应类型是___________,E→F的反应类型是___________
a.氧化反应 b.还原反应 c.加成反应 d.取代反应
(5)写出化学方程式:A→B____________________________________________。
(6)写出E生成高聚物的化学方程式:____________________________________________。
(7)C的同分异构体C1与C有相同官能团,两分子C1脱去两分子水形成含有六元环的C2,写出C2的
结构简式:___________________________;该分子内的碳原子成键时有 种杂化类型。
高三模拟测试题(1)
化 学 试 卷 答 题 卡
班级 高三( )班 姓名 座号
第一部分 选择题(共70分)
| 题 号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| 答案 | ||||||||||
| 题 号 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 |
| 答案 |
第二部分 非选择题(共80分)
注意事项:1、请在规定的区域和规定的位置上填写答案,凡没有在规定的区域和规定的位置作答的答案无效,不能得分。
2、请保持卷面清洁,书写工整。凡书写潦草,无法辨认清楚的答案,一律不给分;卷面不清洁的,可根据实际情况扣3~5分。
三、(本题包括3小题,共33分)
| 21.(8分) ① ② 。 ③ (选填序号), ④ (填上相应序号) 。 22.(12分) (1)① ② (2) 试管C中苯的作用是 。 D可以看到的现象是 ; E可以看到的现象是 。 装置B中观察到的现象是 。 (3) (填字母代号)。 (4) 。 23.(13分) (1) 溶液; 。 (2)___________ __, 。 (3) 。 (4) 。 (5) (沉淀质量用a表示,填计算式)。 |
四、(本题包括3小题,共27分)
| 24. (8分) (1) ; 第 周期,第 族。 (2) 。 (3) 。 (4)镉在 极析出,该电极材料是 (5) 。 25. (9分) (1)□I2+□KClO3 +□H2O ——□KH(IO3)2+□KCl+□Cl2↑。 (2) (3)X的化学式为 ; (4) 。 26.(10分) (1) ; 。(2) 。 (3)As2O3 g,As2O5 g。 |
五、(本题包括2小题,共20分)
| 27. (8分) .... ⑴ 。 .... ⑵ (填名称)。 判断依据 。 ⑶ (不需注明反应条件)。 .... ⑷试剂 ; 。 28.(12分) (1)a. b. (2) 。 (3) , ___________ (4) ___________, ___________ (5) A→B 。 (6) 。 (7) ; |
高三模拟测试题(1)
化学试卷参考答案
第一部分 选择题(共70分)
| 题 号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| 答案 | D | B | A | D | B | D | B | C | C | B |
| 题 号 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 |
| 答案 | B | C | B | BD | BD | A | D | BC | D | BC |
第二部分 非选择题
三、(本题包括3小题,共33分)
| 21、(8分)① AD ② 容量瓶 ③ C或CD;过滤 ④ a、d、e、(f)、h、j 22. (12分)(1)① 3Br2+2Fe=2FeBr3 ② (2) 吸收HBr气体中混有的Br2蒸气 。 D试管中石蕊试液慢慢变红,导管口有大量白雾产生; E试管中有浅黄色沉淀生成 。 溶液下有无色油状液体生成;有红褐色沉淀生成 (3) D、E和F (填字母代号)。 (4) 能够充分吸收有毒气体,防止污染空气 。 23.(13分)(1)BaCl (2)检验并吸收S0 (3)向A瓶中逐滴滴加BaCl (4)继续灼烧、冷却、称重,直至连续两次称量的质量不变或质量差小于0.1g为止。
(5) ×152×2g
|
四、(本题包括3小题,共27分)
| 24.(8分)(1)1s22s22p63s23p63d104s24p64d105s2 ; 5,ⅡB (2)Cd+2H+=Cd2++H2↑,Zn+2H+=Zn2++H2↑ (3)锌 (4)阴、镉板 (5)Cd2++S2-=CdS↓ 25.(9分)(1)6I2+11KClO3+3H2O=6KH(IO3)2+5KCl+3Cl2↑ (2)促进氯气从反应混合物中逸出 (3)KOH;KH(IO3)2+KOH=2KIO3+H2O (4)反应产生的氯气跟KOH反应生成KClO;KClO能将KIO3氧化成KIO4;从而不能得到纯碘酸钾 26. (10分)(1)AsO33- ;AsO43- (2)pH值太大,碱性太强,碘单质会和氢氧根发生反应而消耗。 (3)As2O3 :0.0495 g,As2O5 :0.115 g。 |
五、(本题包括2小题,共20分)
| 27.(8分) (1)烯烃 (2)环丙烷;在都使用催化剂的条件下,环丙烷的加成反应的温度最低
(4)酸性KMnO4溶液;紫色褪去的是丙稀,不褪色的是环丙烷 28.(12分)(1)a、CH3CH2CH2COOH ;b、CH3CH2COOCH3 (2)羟基、醛基; (3)CH3COCH2COOH ; 0 (4)a ; b、c (5) CH3CH(OH)CH2CHO → CH3CH=CHCHO+H2O
(7) ; 2 |
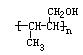 (6)nCH3CH=CHCH2OH →
(6)nCH3CH=CHCH2OH →