高三化学秋学期12月月考试卷
化 学 试 题
说明:①本卷分为第一卷和第二卷两部分。满分110分,考时90分钟。
②请将所有答案写在答题卡上,答在其它地方不得分。
③可能用到的相对原子质量:H 1 C 12 N 14 O 16 Na 23 Cl 35.5
第Ⅰ卷(共48分)
一.选择题(本题共16小题,每小题3分,共48分,每小题只有一个选项符合题意)
1.下列有关叙述正确的是( )
A. “神舟六号”飞船返回舱的表层采用高温时自动烧蚀的耐高温、抗氧化的新型无机非金属材料带走热量从而保证内部温度不致过高。
B.“加碘食盐” “含氟牙膏”“富硒营养品” “高钙牛奶”“加铁酱油”等等,这里的碘、氟、硒指的是分子,钙、铁则分别是钙离子和铁离子。
C. 赤潮、酸雨、臭氧层空洞、潮汐等都与环境污染有关
D. “冰,水为之,而寒于水”说明相同质量的水和冰,水的能量高
2.下列各组物质的分类都正确的是(括号里的是类别)
A.空气(混合物)、C2H5OH(醇)、H2SO4(离子化合物)、CO2(非电解质)
B.液氨(氢化物)、NH4Cl(铵盐)、HNO3(氧化性酸)、NaOH(强电解质)
C.HCl(共价化合物)、CH3COOH(羧酸)、Na2O2(碱性氧化物)、CH3I(卤代烃)
D.NO2(酸性氧化物)、CH3CHO(有机物)、CO(有机物)、CH3COOCH3(酯)
3、下列叙述中正确的是
A、CO2分子内含有极性键,所以CO2分子是极性分子
B、分子晶体、原子晶体中一定含有共价键,离子晶体一定含有离子键
C、气态氢化物的稳定性:NH3>PH3>AsH3
D、某非金属元素从游离态变成化合态时,该元素一定被还原
4、下列金属或氧化物可以完全溶解的是
A、1molZn与含1molHCl的稀溶液共热 B、1molCu与含4molHNO3的浓硝酸
C、1molCu与含2molH2SO4的浓硫酸共热 D、1molMnO2与含4molHCl的浓盐酸共热
5.下列各组热化学方程式(同温、同压下)中Q1大于Q2(Q1、Q2为正值)的有
①:S(g)+O2(g)=SO2(g); ΔH=-Q1kJ/moL
S(s)+O2(g)=SO2(g); ΔH=-Q2kJ/moL
②:C(s)+1/2 O2(g)=CO(g); ΔH=-QlkJ/moL
C(s)+O2(g)=CO2(g); ΔH=-Q2kJ/moL
③:4Al(s)+3O2(g)=2Al2O3(s); ΔH=-QlkJ/moL
4Fe(s)+3O2(g)=2Fe2O3(s); ΔH=-Q2kJ/moL
④:2H2(g)+O2(g)=2H2O(g); ΔH=-QlkJ/moL
2H2(g)+O2(g)=2H2O(l); ΔH=-Q2kJ/moL
A.①② B.③④ C.②④ D.①③
6、NA为阿伏加德罗常数,下列说法正确的是
A、1molFe3+完全水解生成氢氧化铁胶体粒子的数目为NA
B、常温常压下,32gO2-离子中所含电子的数目为17 NA
C、标准状况下,11.2 L四氯化碳所含分子数为0.5 NA
D、含有2NA个阴离子的Na2O2固体,投入足量水中产生约22.4L的氧气
7.在元素周期表短周期中的X和Y两种元素可组成化合物XY3,下列说法正确的是( )
A.XY3晶体一定是离子晶体
B.若Y的原子序数为m,X的原子序数不可能是m±4
C.X和Y可属于同一周期,也可属于两个不同周期
D.X和Y一定不属于同一主族
8、下列离子方程式或化学方程式,正确的是
A、澄清石灰水中加入少量小苏打溶液: Ca2++OH-+HCO3-=CaCO3↓+H2O
B、氯化铁溶液中通入硫化氢气体: 2Fe3++3S2-=2FeS↓+S↓
C、向Fe(OH)3中加入氢碘酸:Fe(OH)3+3H+=Fe3++3H2O
D、氯化铝溶液中加入过量氨水:4NH3·H2O+Al3+=4NH4++AlO2-+2H2O
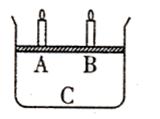
 9.向含1mol HCl和1mol MgSO4的混合溶液中加入1mol·L—1的Ba(OH)2溶液,产生沉淀的物质的量(n)与加入Ba(OH)2溶液体积(V)间的关系图正确的是
9.向含1mol HCl和1mol MgSO4的混合溶液中加入1mol·L—1的Ba(OH)2溶液,产生沉淀的物质的量(n)与加入Ba(OH)2溶液体积(V)间的关系图正确的是
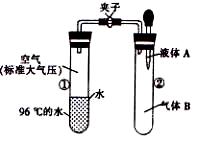 10。如图所示,夹子开始处于关闭状态,将液体A滴人试管②与气体B充分反应,打开夹子,可发现试管①内的水立刻沸腾了。则液体A和气体B的组合不可能是下列的
10。如图所示,夹子开始处于关闭状态,将液体A滴人试管②与气体B充分反应,打开夹子,可发现试管①内的水立刻沸腾了。则液体A和气体B的组合不可能是下列的
A.氢氧化钠溶液、二氧化碳
B.水、氨气
C.氢氧化钠溶液、一氧化氮
D.水、二氧化氮
11.下列实验操作中,错误的是
(1)用托盘天平称取5.2gNaCl ;(2)用50mL量筒量取5.2mL盐酸;(3)用蒸发皿加热KNO3溶液制取KNO3晶体;(4)用100mL容量瓶配制50mL0.1mol/LH2SO4溶液;(5)用带玻璃塞的棕色试剂瓶存放浓HNO3;(6)用煤油液封保存锂、钠、钾单质
A.(2)(3)(5) B.(2)(4)(5) C.(1)(4)(6) D.(2)(4)(6)
12.某研究性学习小组为了探索镁粉与溴水反应的机理,做了如下四组实验:
①将镁粉投入冷水中,未见任何现象;
②将镁粉放入溴水中,观察到只是开始时产生极少量的气泡,但溴水的颜色逐渐褪去;
③将镁粉放入液溴中,未观察到任何明显现象;
④向含足量镁粉的液溴中滴加几滴水,观察到溴的红棕色很快褪去。
则下列关于镁与溴水的反应机理的论述中正确的是
A.镁粉只直接与溴水中的溴反应
B.镁粉只与溴水中的酸反应
C.产生极少量的气泡是由于镁粉与水反应得到
D.镁粉在水的催化下与溴发生反应
13.可逆反应m A(g) + n B(g) pC(g) + g D(g) 的v ~ t图像如下左图,若其它条件都不变,只是在反应前加入合适的催化剂,则其v ~ t 图像如下右图。
|
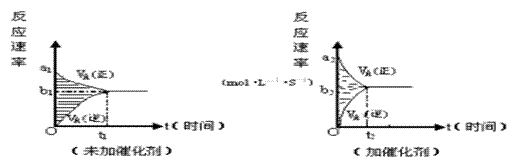
①a1 = a2 ② a1 < a2 ③b1 = b2 ④b1 < b2 ⑤t1 > t2
⑥t1 = t2 ⑦两图中阴影部分面积相等 ⑧右图阴影部分面积更大
以上正确的为
A.②④⑤⑦ B.①④⑥⑧ C.②③⑤⑧ D.①③⑥⑦
14.工业上用氨氧化法制得硝酸浓度一般为50%左右,若要得到更浓的硝酸,所采用的吸水剂是
A.浓硫酸 B 生石灰 C 无水CaCl2 D 硝酸镁晶体[Mg(NO3)2·6H2O]
15.在标准状态下,将NO2、NO、O2混合后,充满容器倒置于水中,完全溶解,无气体剩余,若产物也不泄露,则所得溶液物质的量浓度的数值范围是
A ![]() <c<
<c<![]() B
B ![]() <c<
<c<![]() C
C ![]() <c<
<c<![]() D
D ![]() <c<
<c<![]()
16..假设原子晶体SiO2 中有25%的Si原子由Al原子取代,不足的价数由K原子补充,可形成正长石,则正长石的化学组成为:
A KAlSiO4 B KAlSiO8 C KAlSi3O8 D KAlSi4O6
第Ⅱ卷(非选择题:共62分)
17、(8分)(1)以下各种尾气吸收装置中,适合于吸收HCl气体,而且能防止倒吸的有__________
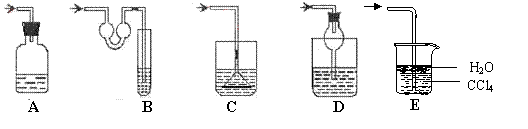

(2)对下列仪器:A、容量瓶 B、蒸馏烧瓶 C、滴定管 D、量筒 E、烧杯
F、蒸发皿 G、分液漏斗使用时必须检查是否漏水的有 (填序号)
(3)用固体NaOH配制250mL0.5mol·L-1 NaOH溶液, 下列操作使所配制的NaOH溶液浓度偏高的有:______________(填写代号,选错倒扣分)
A.称取固体NaOH时未用小烧杯 B.没有用水冲洗烧杯2~3次 C.定容时,俯视液面使与刻度相切 D.溶液配好摇匀后,发现液面低于刻度线,又加水至液面与刻度相切 E.将未冷却的溶液注入容量瓶后,马上定容 F.样品中混有Na2O杂质
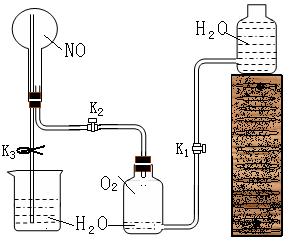 18.(14分)某研究性学习小组同学设计如图所示的实验装置来验证某些物质的化学性质,请回答:
18.(14分)某研究性学习小组同学设计如图所示的实验装置来验证某些物质的化学性质,请回答:
(1)该实验的目的: 。
(2)该实验的原理是(用化学方程式
回答) , 。
(3)实验用品:实验仪器除铁架台(
带铁夹)、储气瓶(两个)、直管活活塞
(K1、K2)、止水夹(K3)、橡皮塞、橡皮
导管和若干玻璃导管外,还有那几种仪
器(写仪器名称) ,
实验所用的试剂为 。
(4)实验步骤:
①按图连接好仪器。
②打开活塞K1、K2,主要现象为 。
打开活塞K3,要使烧瓶内产生喷泉可采用的方法是 。
19.(8分)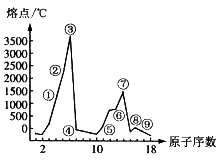 右图是部分短周期元素的单质熔点的变化图,根据此图,填写下列空格:
右图是部分短周期元素的单质熔点的变化图,根据此图,填写下列空格:
(1)③号元素位于周期表第__________周期_______族,其单质的一种同素异形体能导电,该同素异形体的名称叫______________。
(2)⑤、⑥两种元素形成的最高价氧化物对应的水化物之间相互反应的离子方程式为______________。
(3)⑦号元素的原子结构简图为___________。
(4)②、④两元素形成的化合物其晶体有两种结构,其中一种结构与金刚石相似,该结构的晶体属___________晶体,若使其熔化,需破坏的作用力为___________________。
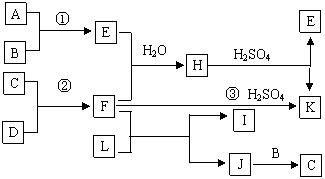 20.(10分)下图是部分短周期元素的单质及其化合物的转化关系图(有关反应的重要条件及生成的水已略去),已知:(a)A、B、C、D是非金属单质,其中B、C、D在常温常压下是气体。(b)反应①、②是化工生产中的重要反应。(c)化合物E是形成酸雨的污染物之一,化合物K是常见的氮肥。(d)化合物L具有漂白性,可由Cl2与NaOH溶液反应制得。(e)化合物J由两种元素组成,其相对分子质量为32。
20.(10分)下图是部分短周期元素的单质及其化合物的转化关系图(有关反应的重要条件及生成的水已略去),已知:(a)A、B、C、D是非金属单质,其中B、C、D在常温常压下是气体。(b)反应①、②是化工生产中的重要反应。(c)化合物E是形成酸雨的污染物之一,化合物K是常见的氮肥。(d)化合物L具有漂白性,可由Cl2与NaOH溶液反应制得。(e)化合物J由两种元素组成,其相对分子质量为32。
请按要求填空:
(1)反应③的化学方程式 。
(2)C的结构式 ;H的化学式 。
(3)L溶液与化合物E反应的离子方程式 。
(4)化合物J的化学式 。
![]() 21.(10分)有如下化学反应:2A(g)+B(g)
2C(g);△H<0
21.(10分)有如下化学反应:2A(g)+B(g)
2C(g);△H<0
(1)若将4mol气体A和2mol气体B在2L密闭容器中混合,经2s后测得C的浓度为0.6mol·L-1。则2秒时B的浓度为 mol·L-1。
|
(3)如右图所示,将4mol气体A和2mol气体B
混合后置于体积可变的等压容器中,一定温度下达
到平衡状态X时,测得气体总物质的量为4.2mol。
若A、B、C起始的物质的量分别用a、b、c表示,
试回答:
ⅰ:达到平衡状态X时的容器中,通入少量B气体,
容器中A的体积分数 (填“增大”、“减小”或“不变”)。若要使A的体积分数再升高到与平衡状态X相同,可采取的一种措施是 (只填一种即可)。
ⅱ:若起始a=1.2mol,b=0.6mol,且达到平衡后各气体的体积分数与平衡状态X相同,则起始时C的取值范围为 。
![]() 22.(12分)已知:4NH3 + 5O2
4NO + 6H2O ;4NO + 3O2 + 2H2O 4HNO3
22.(12分)已知:4NH3 + 5O2
4NO + 6H2O ;4NO + 3O2 + 2H2O 4HNO3
设空气中氧气的体积分数为0.20,氮气的体积分数为0.80。请完成下列填空和计算:
(1)a molNO完全转化为HNO3需要氧气 a mol
(2) 为使NH3恰好完全氧化为NO,氨气-空气混合物中氨的体积分数为(用小数表示)
(保留2位小数)
(3)20.0 mol的NH3用空气氧化,产生的混合气体为:NO 18.0 mol、 O2 12.0 mol、
 N2 150.0 mol和一定量的硝酸,以及其它成分。(高温下NO和O2不反应)则氨转化为NO和HNO3的转化率分别为 、
。
N2 150.0 mol和一定量的硝酸,以及其它成分。(高温下NO和O2不反应)则氨转化为NO和HNO3的转化率分别为 、
。
(4)20.0 molNH3和一定量的空气充分反应后,再转化成HNO3。
①在右图中画出HNO3的物质的量n(A)和空气的物质的量n(B)关系的理论曲线。
②写出当125 mol≤n(B)≤200 mol时,n(A)和n(B)关系式 。
答 题 卡
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 |
| 答案 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
附答案:
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 |
| 答案 | D | B | C | B | D | B | C | A | D | C | D | D | A | A | C | C |
17.(8分)(1)BDE (3分)(2) A C G (2分),(3) CEF (3分)
18.(14分)(1)验证NO和O2反应,NO2和H2O反应。
(2)2NO + O2 == 2NO2 3NO2 + H2O == 2HNO3 + NO (或4NO2 + O2 + 2H2O == 4HNO3 )
(3)烧瓶、烧杯 NO O2 和H2O
(4)盛NO的烧瓶内出现红棕色 用手(或热毛巾巾等)将烧瓶捂热。
19.(8分)(1)二、ⅣA(2分) 石墨(1分)
(2)Al(OH)3 + OH-==== AlO2- + 2H2O(2分)
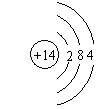 (3)
(3)
(1分)
(4)原子(1分) 共价键(1分)
20.(10分)
(1)2NH3 + H2SO4 ==(NH4)2SO4
![]() (2)N
N (NH4)2SO3(或NH4HSO3
)
(2)N
N (NH4)2SO3(或NH4HSO3
)
(3)ClO-+ SO2 + 2OH- = SO42-+ Cl- + H2O
(4)N2H4 (每空2分)
21.(10分)
(1)0.7 (2)![]()
(3)ⅰ 减小 升温(或通入A气体) ⅱ:任意值(每空2分,共10分)
22.(12分)(1)0.75 (2) 0.14 (3) 97.5% 7.5%
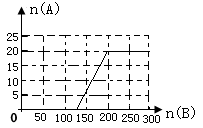 (4)①见右图:
(4)①见右图:
② 3n(A)=0.8[n(B)-125][ 125 mol≤n(B)≤200 mol](每空2分)