高三化学第一学期12月联考试卷
高三化学试卷
命题学校:龙城高级中学
说明:Ⅰ.第一、二部分试卷答案一律写在答卷纸上规定答题处,否则不得分。
Ⅱ.可能用到的相对原子质量:H-1、C-12、O-16、S-32、K-39、Mn-55
第一部分 选择题(共70分)
一、选择题(本题包括10小题,每小题3分,共30分。每小题只有一个选项符合题意)
 1.右图是同学们经常使用的某品牌修正液包装标签。小明仔细阅读后,结合自己的生活经验和所学知识得出了该修正液的某些性质,小明的推测中不合理的是( )
1.右图是同学们经常使用的某品牌修正液包装标签。小明仔细阅读后,结合自己的生活经验和所学知识得出了该修正液的某些性质,小明的推测中不合理的是( )
A.修正液是一种胶体,均一、透明
B.修正液中含有的化学物质有毒
C.修正液的成分对纸张不具有腐蚀性
D.修正液的溶剂易挥发、易燃
2.奥运吉祥物福娃外材为纯羊毛线,内充物为无毒的聚酯纤维(![]() )下列说法不正确的是( )
)下列说法不正确的是( )





A.羊毛与聚酯纤维的化学成分不相同
B.聚酯纤维和羊毛一定条件下均能水解
C.该聚酯纤维单体为对苯二甲酸和乙二醇
D.由单体合成聚酯纤维的反应属加聚反应
3.不具有放射性的同位素称之为稳定同位素,近20年来,稳定同位素分析法在植物生理学、生态学和环境科学研究中获得广泛应用。如在陆地生态系统研究中,2H、13C、15N、18O、34S等常用做环境分析指示物。下列说法中正确的是( )
A.34S与32S互为同素异形体
B.1H216O在相同条件下比1H218O更易蒸发
C.13C和15N原子核内的质子数相差2
D.硫元素基态原子的电子排布式为 1S22S22P63S23P34S1
4.钠盐和钾盐性质相似,但实际生产中多用钾盐而不用钠盐,如实验室制氧气是用KClO3而不是用NaClO3,制黑火药用KNO3而不用NaNO3,并且在KNO3中不能含有NaNO3,对此现象,以下各种理由合理的是 ( )
A.钠盐的吸湿性比钾盐强 B.钾盐的氧化性比钠盐强
C.钾盐的熔点比钠盐高 D.钾盐比钠盐在自然界含量更多
5.实验室可通过以下反应来制取碘:2 NO + O2 = 2 NO2 ;2H++2I-+NO2=NO+I2+H2O。在整个过程中,每制取1mol I2时,所消耗氧化剂的质量是( )
A.46g B.32g C.28g D.16g
6.元素A和B的原子序数都小于18。已知A元素原子的最外层电子数为a,次外层电子数为b;B元素原子的M层电子数为(a-b),L层电子数为(a+b),则A、B两元素所形成的化合物的晶体类型为( )
A.分子晶体 B.原子晶体 C.离子晶体 D.金属晶体
7.下列对实验仪器名称的标注或实验操作,正确的是( )
8.分类方法在化学学科发展中起到了非常重要的作用。下列分类标准合理的是
① 根据酸分子中含有的H原子个数将酸分为一元酸、二元酸等
② 根据反应中是否有电子转移将化学反应分为氧化还原反应和非氧化还原反应
③ 根据分散系是否具有丁达尔现象将分散系分为溶液、胶体和浊液
④ 根据反应中的热效应将化学反应分为放热反应和吸热反应
A.①③ B.②④ C.①②④ D.②③④
9、在日常生活中,雪碧、可口可乐等饮品都是塑料容器盛装,而盛啤酒的容器却是玻璃制品,很少见到用塑料瓶盛装啤酒,这是由于塑料 ( )
A 造价太高同时形成白色垃圾而引起环境污染
B.太软,饮用和运输时都很不方便
C.相对玻璃透气性强,啤酒易被氧化而变质
D.属有机物,能与啤酒反应而不与雪碧、可口可乐等饮品反应
10.最近广东北江发生严重的水体镉污染事件,专家确定用1200吨的聚合铁{简称PFS,化学式为:[Fe2(OH)n(SO4)3-n/2]m ,n<5 ,m<10}分批加入,利用PFS在水体中形成絮状物,以吸附镉离子。结合题中信息,下列说法不正确的是( )
A.10848Cd核素中中子数为60
B.含镉废电池应进行回收处理
C.PFS中铁显十2价
D.实验室由FeSO4溶液制PFS需经过氧化、水解和聚合的过程
二、选择题(本题包括10小题,每小题4分,共40分,每小题有一个或两个选项符合题意。若正确答案只包括一个选项,多选时,该题为0分;若正确答案包括两个选项,只选一个且正确的得2分,但只要选错一个,该小题就为0分)
11.下列有关叙述正确的是( )
A.“加碘食盐”“高钙牛奶”“含氟牙膏”“富硒营养品”等等,这里的碘、钙、氟、硒指的是分子
B.实验室用“通风橱”是一种不彻底的排放手段,因有害气体未经转化或吸收
C.“雨后彩虹”、“海市蜃楼”这类自然景观不仅与光现象有关也与胶体有关
D.电解水制取氢气和氧气时,通常加入硫酸钠等强电解质,说明强电解质的导电性一定比弱电解质的强
12. 下列有关物质的结构或性质的叙述错误的是( )
A. 由极性键形成的分子不一定是极性分子
B. 水是一种非常稳定的化合物,这是由于氢键所致
C. 石英、食盐、金属钠、干冰的熔点依次降低
D. 分子晶体中一定存在分子间作用力,可能有共价键
13.在体积相同且体积固定不变的两个密闭容器中分别充满O2、O3气体,当这两个容器内温度和气体密度相等时,下列说法正确的是( )
A.两种气体的压强相等 B.O2比O3的质量小
C.两种气体的分子数目相等 D.两种气体的氧原子数目相等
14. 下列反应的离子方程式错误的是( )
A.硫化钠溶于水中:S2-+2H2O![]() H2S↑+2OH-
H2S↑+2OH-
B.铜跟浓硝酸反应:Cu+2N03-+4H+=Cu2++2N02↑+2H2O
C.碳酸钙跟稀盐酸反应:C032-+2H+=CO2↑+H2O
D.铁跟氯化铁溶液反应:Fe+2Fe3+=3Fe2+
15、下列叙述中错误的是( )
A、电解池的阳极上发生氧化反应,阴极上发生还原反应
B、原电池跟电解池连接后,电子从电池负极流向电解池阳极
C、电镀时,通常把待镀的金属制品作阴极
D、电解饱和食盐水时,阴极得到氢氧化钠溶液和氢气
16.室温下,下列溶液等体积混合后,所得溶液的pH一定大于7的是( )
A 0.1mol/L的盐酸和0.1mol/L的氢氧化钠溶液
B.0.1mol/L的盐酸和0.1mol/L的氢氧化钡溶液
C.pH=4的醋酸溶液和pH=10的氢氧化钠溶液
D.pH=4的盐酸和pH=l0的氨水
17.已知25℃、10lkPa条件下:
4Al(s)+3O2(g) = 2Al2O3(s);△H = -2834.9kJ·mol-1;
4Al(s)+2O3(g)=2Al2O3(s);△H =-3119.1kJ·mol-1
由此得出的正确结论是
A.等质量的O2比O3能量低,由O2变O3为吸热反应
B.等质量的O2比O3能量低,由O2变O3为放热反应
C.O3比O2稳定,由O2变O3为吸热反应
D.O2比O3稳定,由O2变O3为放热反应
18.据最新报道,科学家发现了如下反应:O2+PtF6=O2(PtF6),已知O2(PtF6)为离子化合物,其中Pt为+5价,对于此反应,下列说法正确的是( )
A.在此反应中,O2是氧化剂,PtF6是还原剂
B.O2(PtF6)中氧元素的化合价是+1价
C.O2(PtF6)中不存在共价键
D.在此反应中,每生成1mol O2(PtF6)则转移1mol电子
19.二元酸H2A在水中发生电离:H2A=H++HA-和HA-![]() H++A2-,则下列几种物质的水溶液中关系式不正确的是 ( )
H++A2-,则下列几种物质的水溶液中关系式不正确的是 ( )
A.NaHA:c(Na+)>c(HA-)>c(OH-)>c(H+)
B.NaHA:c(Na+)=c(A2-)+c(HA-)
C.Na2A:c(Na+)>c(A2-) >c(OH-)>c(H+)
D.H2A: c(H+)=c(HA-)+ c(A2-)+c(OH-)
![]() 20、在一定条件下发生反应:2A(g) +
2B(g) x C(g) + 2D(g),在2L温度和体积均固定不变的密闭容器中,把4molA和2molB混合,2min后达到平衡时生成1.6molC,又测得反应速率VD =0.2mol/(L·min),下列说法正确的是
( )
20、在一定条件下发生反应:2A(g) +
2B(g) x C(g) + 2D(g),在2L温度和体积均固定不变的密闭容器中,把4molA和2molB混合,2min后达到平衡时生成1.6molC,又测得反应速率VD =0.2mol/(L·min),下列说法正确的是
( )
A、B的转化率是20%; B、x = 4 ;
C、A的平衡浓度是1.4mol/L D、平衡时气体压强是原来的0.94倍
第二部分 非选择题(共80分)
三、(本题包括3小题,共34分)
21.(12分)各地电视台的天气预报中都要预报城市的空气质量。预报中一般将城市空气中的SO2含量和可吸入颗粒的含量(可用g/cm3表示)分为8个等级。目前,测定空气中SO2含量时主要用一些氧化还原法。
已知:SO2气体与酸性KMnO4溶液反应时,MnO4—被还原为Mn2+,SO2被氧化为SO42—。
现有药品:0.1mol/L的酸性KMnO4溶液、颗粒吸附剂、品红试纸、pH试纸。
完成下列各题:
(1)配置200mL0.1mol/L的酸性KMnO4溶液需用的仪器有 、 、玻璃棒、胶头滴管、烧杯等,玻璃棒的作用是引流和 。
(2)在测定SO2含量和可吸入颗粒的含量时,首先应测定 ,
原因是 。
(3)写出SO2与酸性KMnO4溶液反应的离子方程式:
;
若气体的流速为a cm3/min,当t min时,200mL0.1mol/L的酸性KMnO4溶液恰好褪色,则空气中SO2的含量为 g/cm3 。
(4)若要测定空气中可吸入颗粒的含量,需要测出的数据有 。
22.(10分)已知常温下甲醛是一种无色、有刺激性气味的气体,易溶于水,是世界卫生组织(WHO)确认的致癌物和致畸物质之一。我国规定:居室中甲醛含量不得超过0.08mg/m3。可利用酸性高锰酸钾溶液测定甲醛。
测定原理:KMnO4 ( H+)溶液为强氧化剂,可氧化甲醛和草酸。
有关离子方程式为:4MnO4― + 5HCHO + 12H+ == 4Mn2+ + 5CO2↑ + 11H2O
2MnO4― + 5H2C2O4 + 6H+ == 2Mn2+ + 10CO2 ↑+ 8H2O
测定装置:部分装置如下图所示(a、b为止水夹)
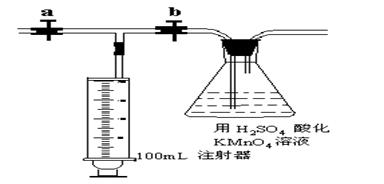
测定步骤:
①收集待检新装修的房屋居室空气5L。
②准确量取5.00mL 1.00×10-3mol•L-1 的高锰酸钾溶液于250mL锥形瓶中,滴入3滴6mol•L-1 的H2SO4 溶液,加水45mL稀释备用。
③将1.00×10-3mol•L-1 的草酸标准溶液置于酸式滴定管中备用。
④打开a,关闭b,用注射器抽取100mL新装修的房屋的室内空气。关闭a,打开b,再缓缓推动注射器,将气体全部推入酸性高锰酸钾溶液中,使其充分反应。再如此重复4次。
⑤用标准草酸溶液滴定锥形瓶中的溶液,记录滴定所消耗的草酸溶液的体积。
⑥再重复实验2次(每次所取的高锰酸钾溶液均为5.00mL)。3次实验所消耗草酸溶液的体积平均值为12.38mL。
回答以下问题:
(1)使用 量取5.00mL高锰酸钾溶液。
(2)如果注射器压送气体速度过快,可能会产生什么不良后果?使结果偏高还是偏低?
; 。
(3)本实验是否需要外加指示剂?若需要请指出指示剂的名称,若不需要,试说明如何确定滴定的终点。
; 。
(4)计算该居室内空气中甲醛的浓度为 mg/m3 ,
该居室的甲醛 (填“是”或“否” )超标。
23.(12分)下面是某化学学习小组的同学进行研究性学习的过程,请你参与并协助他们完成相关学习任务。
【研究课题】探究草酸晶体受热分解的产物
【查阅资料】该小组同学通过网络查询,获得草酸及草酸晶体的一些相关知识:
| 名称 | 分子式 | 颜色、状态 | 溶解性 | 熔点(℃) | 密度(g/cm3) |
| 草酸 | H2C2O4 | — | 易溶于水 | 189.5 | 1.900 |
| 草酸晶体 | H2C2O4·2H2O | 无色晶体 | — | 101.5 | 1.650 |
备注:草酸晶体失去结晶水后,175℃以上开始分解。
【提出猜想】⑴ ;
⑵分解产物中的气体可能是CO、CO2或它们的混合物。
 【设计方案】⑴请设计完成“猜想⑴”的实验方案[用简要的实验装置图表示,要体现所使用仪器
【设计方案】⑴请设计完成“猜想⑴”的实验方案[用简要的实验装置图表示,要体现所使用仪器
(加热和夹持仪器不必画出)和试剂]。
⑵化学学习小组的同学继续利用下图所示装置进行“猜想⑵”的实验探究。
已知: A、C、F中盛装澄清石灰水, B中盛装浓NaOH溶液, D中装有碱石灰,E中装有CuO。
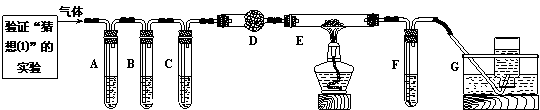 |
①证明分解产物中有CO2的现象是 ;证明分解产物中有CO的现象是
。
②若未连接装置G,要达到防止污染环境的目的,可采取的措施是 。
【交流讨论】小李同学继续查阅相关资料发现:草酸是二元弱酸,酸性比碳酸强,在受热分解过程中有少量升华;草酸钙和草酸氢钙均为白色不溶物。小李通过进一步研究,对实验中CO2的检验提出质疑。试根据相关信息,指出原设计中存在的问题,并提出实验的改进措施: 。
四、(本题包括3小题,共31分)
24、(8分) 氨是最重要的氮肥,是产量最大的化工产品之一。课本里介绍的合成氨技术叫哈伯法,是德国土哈福在1905年发明的,其合成原理为:
![]()
他因此获得了1918年度诺贝尔化学奖。试回答下列问题:
(1)合成氨工业中采取的下列措施可用勒夏特列原理解释的是 (填序号)。
A 采用较高压强(20MPa~50MPa)
B 采用500℃的高温
C 用铁触媒作催化剂
D 将生成的氨液化并及时从体系中分离出来,N2和H2循环到合成塔中
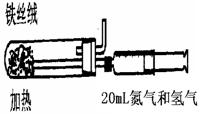 (2)右图是实验室模拟工业法合成氨的简易装置。简述检验有氨气生成的方法:
(2)右图是实验室模拟工业法合成氨的简易装置。简述检验有氨气生成的方法:
。
(3)在298K时,将10molN2和30molH2通入合成塔中,为何放出的热量小于924kJ?
答: 。
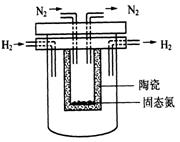 (4)1998年希腊亚里斯多德大学的Marnellos和Stoukides采用高质子导电性的SCY陶瓷(能传递H+),实现了高温常压下高转化率的电化学合成氨。其实验装置如图。正极的电极反应式为:
(4)1998年希腊亚里斯多德大学的Marnellos和Stoukides采用高质子导电性的SCY陶瓷(能传递H+),实现了高温常压下高转化率的电化学合成氨。其实验装置如图。正极的电极反应式为:
。
25.(11分)I、下表是百姓超市出售的“粤牌”加碘精制盐的有关说明:
| 产 品 标 准 号 | Q/320000JYJ03-2004 |
| 许 可 证 号 | 食盐批字第100070号 |
| 配 料 表 | 精制盐、碘酸钾 |
| 含 碘 量 | 35±15mg/kg |
| 卫生许可证号 | 粤食字(2005)第00015号 |
| 分 装 日 期 | 见封口 |
| 储 藏 方 法 | 通风、防潮 |
| 食 用 方 法 | 根据烹调所需适量加入 |
| 食品标签认可号 | 粤食签(2002)007号 |
II、下面是某网站上刊出的有关碘及碘的化合物的有关信息:
自然界中碘主要以碘化物和碘酸盐的形式存在。碘在海水中的含量甚微(5×10-8%),但海洋中某些生物如海带、海藻等具有选择性吸收和聚积碘的能力,因而干海藻是碘的一个重要来源。目前世界上碘主要来自智利硝石,其中含碘0.02%~1%,智利硝石中碘主要以碘酸钠(NaIO3)的形式存在。通常情况下碘是一种紫黑色固体,易升华,只能少量溶于水得棕黄色的碘水溶液,但易溶于苯、四氯化碳等有机溶剂,紫色的碘蒸气有刺激性气味,能强烈刺激眼、耳、鼻、气管等粘膜,吸入较多的碘蒸气会发生中毒,甚至造成死亡。碘遇淀粉(面粉的主要成分)会出现明显的蓝色。碘离子(I-)具有明显的还原性,而高价态的碘则具有较强的氧化性:
2NaI+3H2SO4+MnO2=2NaHSO4+MnSO4+2H2O+I2 …………⑴
2NaIO3+5NaHSO3=2Na2SO4+3NaHSO4+H2O+I2 …………⑵
反应⑴是从海藻灰中提取碘的主要反应,反应⑵是从智利硝石中提取碘的主要反应,两个反应均在水溶液中进行。 根据以上信息,回答下列问题:
⑴反应⑴、反应⑵的离子方程式是:
反应⑴: ;
反应⑵: ;
I2在反应⑴中是 (填“氧化”或“还原”,下同)产物,
在反应⑵中是 产物;
⑵请你设计实验探究上述 “粤牌”精制盐中是否真的含有碘元素。
实验名称:探究“粤牌”精制盐中是否含有碘元素
实验目的:1.认识碘酸钾中的碘元素转变成碘单质的化学反应;
2. 。
实验原理:用NaHSO3还原KIO3生成单质碘,再用淀粉检验碘单质的存在
实验用品:试管、滴管,“粤”牌精制盐、亚硫酸氢钠溶液、淀粉溶液、蒸馏水。
实验步骤:(用准确、简洁的语言完成下表第1步的操作及第3步的现象两个空格)
| 实验步骤 | 实验现象 | 实验结论 |
| 1. | 固体在水中溶解 | 食盐及碘酸钾能溶于水 |
| 2.向上述溶液中滴加适量的亚硫酸氢钠溶液,振荡。 | 溶液出现棕黄色 | |
| 3.再向上述溶液中滴加淀粉溶液,振荡。 | “粤”牌精制盐中含有碘元素。 |
26(12分).环境污染问题已经越来越受到世人的重视。请关注以下两个有关环境污染的问题:
I、2001年11月20日,《解放日报》报道:南太平洋岛国“图瓦卢被迫全国移民”到新西兰。该国前总理佩鲁曾声称图瓦卢是“温室效应的第一个受害者”。目前该国正面临生存环境严重恶化的局面。该国岛屿近20年来已经被海水侵蚀得千疮百孔,岛上的淡水日益减少;海水的大量侵入使土壤盐碱化,粮食和蔬菜无法正常生长。图瓦卢陆地最高处仅海拔4.5m,由于海平面日渐升高,据估计这些岛屿将于50年内被海水淹没。请根据以上材料分析:
(1)图瓦卢是由多个珊瑚礁形成的岛国。由于大气中![]() 含量的剧增,大量珊瑚礁(主要成分是碳酸钙)被海水侵蚀,其原因是(用化学方程式表示):
含量的剧增,大量珊瑚礁(主要成分是碳酸钙)被海水侵蚀,其原因是(用化学方程式表示):
____ ____ ____。
(2)为了控制温室效应。各国科学家提出了不少方法和设想。有人根据液态CO2密度大于海水密度的事实,设想将CO2液化后,送入深海海底。以减小大气中CO2的浓度。为使CO2液化,可采用的措施是 ( )
A. 减压、升温 B. 增压、升温 C. 减压、降温 D. 增压、降温
(3)科学家致力于二氧化碳的“组合转化”技术研究,把过多的二氧化碳转化为有益于人类的物质。如将CO2和H2以1∶4的比例混合,通入反应器。在适当的条件下反应,可获得一种重要的能源。请完成以下化学方程式:
![]()
若将CO2与H2混合,在一定条件下以1∶3的比例发生反应,生成某种重要的化工原料和水。该化工原料可能是( ) (填序号)
A. 烷烃 B. 烯烃 C. 炔烃 D. 芳香烃
II、“汽车尾气”的污染问题也是产生温室效应的原因之一。汽车起动引擎用电火花去点燃汽缸中的燃料蒸气(辛烷)和空气混合物,汽缸内发生燃烧,燃烧是急速而猛烈的,温度很高,当活塞从气缸里往外推出时,燃烧的气体在不到百分之一秒的时间内受到膨胀和冷却,因此燃料必有一部分不完全燃烧。
(1)根据所学知识写出气缸内可能发生反应的化学方程式:(可以不填满)
①: 2 C8H18 + 25 O2 → 16 CO2 + 18 H2O
②:______________________________________________________________
③:________________________ ____________________________________
④:______________________________________________________________
⑤:______________________________________________________________
⑥:______________________________________________________________
(2)若辛烷蒸气在气缸内完全燃烧,则空气体积与辛烷蒸气体积之比是 。
(假设空气中氮气和氧气的体积比为4:1)
(3) 若空气体积与辛烷蒸气体积之比小于(2)中的值,则汽车尾气中含量较多的有害气体是 。若空气体积与辛烷蒸气体积之比大于(2)中的值,则汽车尾气中含量较多的有害气体是 。
五、(本题包括2小题,共15分)
27.(4分)某含氧有机化合物可以作为无铅汽油的抗爆震剂,它的相对分子质量为88.0,含 C的质量分数为68.2%,含H的质量分数为13.6%,红外光谱和核磁共振氢谱显示该分子中有4个甲基。请写出其结构简式。
_____________________________ _。
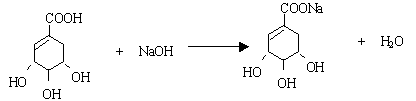
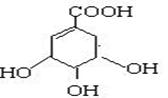 28. (11分)莽草酸是合成治疗禽流感的药物——达菲(Tamiflu)的原料之一。莽草酸是A的一种异构体。A的结构简式如下:
28. (11分)莽草酸是合成治疗禽流感的药物——达菲(Tamiflu)的原料之一。莽草酸是A的一种异构体。A的结构简式如下:
(1)A的分子式是 。
(2)A与溴的四氯化碳溶液反应的化学方程式(有机物用结构简式表示)是:
_____________________________ _。
(3)A与氢氧化钠溶液反应的化学方程式(有机物用结构简式表示)是:
_____________________________ _。
(4)A在浓硫酸作用下加热可得到B(B的结构简式为HO-![]() -COOH),其反应类型是
。
-COOH),其反应类型是
。
(5)B的同分异构体中既含有苯环结构又含有酚羟基和酯基的共有 种,写出其中一种同分异构体的结构简式 。
 高三化学试卷答卷
高三化学试卷答卷
座位号________
| 题号 | 选择题(一、二) | 三 | 四 | 五 | 总分 |
| 得分 |
|
|
|
|
|
请将选择题答案填入下列空格内:
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| 答案 |
|
|
|
|
|
|
|
|
|
|
| 题号 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 |
| 答案 |
|
|
|
|
|
|
|
|
|
|
三、(本题包括3小题,共34分)
21.(12分)
(1) 、 、 。(共3分)
(2) ,(1分)
。(2分)
(3) ;(2分)
g/cm3 。(2分)
(4) 。(2分)
22.(10分)
(1) 。(2分)
(2) ,(1分) 。(1分)
(3) ,(1分)
。(2分)
(4) mg/m3 (2分) ; 。(1分)
23. (12分)
【提出猜想】⑴: ;(2分)
【设计方案】
⑴请将简要的实验装置图画在下列方框中:(仪器和试剂各1分,共2分)

⑵:
① ;(2分)
。(2分)
②措施是 。(2分)
【交流讨论】
。(2分)
四、(本题包括3小题,共31分)
24、(8分)
(1) 。(2分)
(2) 。(2分)
(3)
。(2分)
(4) 。(2分)
25.(11分)
⑴反应⑴: ;(2分)
反应⑵: ;(2分)
、 。 (各1分,共2分)
⑵实验目的:2. 。(1分)
| 实验步骤 | 实验现象 | 实验结论 |
| 1. | 固体在水中溶解 | 食盐及碘酸钾能溶于水 |
| 2.向上述溶液中滴加适量的亚硫酸氢钠溶液,振荡。 | 溶液出现棕黄色 | |
| 3.再向上述溶液中滴加淀粉溶液,振荡。 | “粤”牌精制盐中含有碘元素。 |
(每空2分,共4分)
26.(12分)
Ⅰ、(1)_____________________________________________________。(2分)
(2)( ) (1分)
(3) ![]() (1分)
(1分)
该化工原料可能是( ) (1分)
II、(1)根据所学知识写出气缸内所有可能发生反应的化学方程式(可不填满):
①: 2 C8H18 + 25 O2 → 16 CO2 + 18 H2O
②:______________________________________________________________
③:______________________________________________________________
④:______________________________________________________________
⑤:______________________________________________________________
⑥:______________________________________________________________
(共4分)
(2)体积之比是 。 (1分)
(3) 。(1分) 。(1分)
五、(本题包括2小题,共15分)
27.(4分)
。
28.(11分)
(1)A的分子式是 。 (2分)
(2)A与溴的四氯化碳溶液反应的化学方程式(有机物用结构简式表示)是:
_____________________________ _。(2分)
(3)A与氢氧化钠溶液反应的化学方程式(有机物用结构简式表示)是:
_____________________________ _。(2分)
(4)其反应类型是 。(1分)
(5)有 种, (2分)
。(2分)
高三化学试卷参考答案
选择题答案:
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| 答案 | A | D | B | A | D | B | C | B | C | C |
| 题号 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 |
| 答案 | BC | B | D | AC | B | BD | A | D | AD | B |
21.(12分)(1)250mL容量瓶、托盘天平;搅拌。 (每空1分,共3分)
(2)可吸入颗粒;(1分)空气中的固体尘粒容易被其它溶液吸收。(2分)
![]() (3)5SO2+2MnO4—+2H2O
= 2Mn2++5SO42—+4H+;(2分)
(2分)
(3)5SO2+2MnO4—+2H2O
= 2Mn2++5SO42—+4H+;(2分)
(2分)
(4)吸收前和吸收后颗粒吸附剂和盛放仪器的质量。(2分)
22. (10分)
(1)酸式滴定管或移液管(2分)
(2)甲醛不能完全被吸收,影响测定结果;(1分) 测定结果偏低(1分)
(3)不需要;(1分) 以高锰酸钾为指示剂,最后一滴草酸标准溶液滴下,溶液紫红色褪去且半分钟内不恢复,即为滴定终点。(2分)
(4)3.6mg/m3(2分); 是(1分)。
23(12分).
【提出猜想】⑴草酸晶体中含有结晶水,受热时会有水生成(2分)
 【设计方案】⑴
【设计方案】⑴
(2分)
(或其它合理装置图也给分)
⑵①装置A中澄清石灰水变浑浊(2分)
装置C中澄清石灰水不变浑浊,装置E中黑色氧化铜变为红色固体,装置F中澄清石灰水变浑浊(不写全不给分)(2分)
②在装置F出气导管的末端放一个燃着的酒精灯(2分)(其它合理答案也给分)
【交流讨论】在未洗气的情况下将分解产物通入澄清石灰水,还可能因草酸蒸气与A中石灰水反应生成了草酸钙沉淀,对实验中CO2的检验有干扰;(1分) 因而在装置A之前可增加一个装有水的洗气装置(1分)(其它合理答案也给分)
24.(8分)
(1)AD (2分)
(2)用湿润的红色石蕊试纸放在导管出口处,若试纸变蓝说明有氨气生成。(2分)(其它合理答案也给分)
(3)该反应是可逆反应,10molN2与30molH2不可能完成反应,所以放出的热量小于924kJ 。(2分)
(4) N2 + 6H+ +6e— = 2NH3 。(2分)
25.(11分)
⑴ 2I-+4H++MnO2=Mn2++2H2O+I2 (2分)
2IO3-+5HSO3-=3H++5SO42-+H2O+I2 (2分)
氧化 ;(1分) 还原 。(1分)
实验目的:2.认识碘单质的检验方法。(1分)(其它合理答案也给分)
| 实验步骤 | 实验现象 | 实验结论 |
| 1.取食盐少许于一支试管中,加入适量的蒸馏水,振荡,使食盐全部溶解。 | ||
| 溶液变成蓝色 |
(每空2分,共4分)
26(12分). I、(1) CaCO3 + CO2 + H2O == Ca(HCO3)2 (2分)
(2) D (1分)
(3) CH4 ; B (每空1分,共2分)
II、(1) 2C8H18 + 17O2 → 16CO + 18H2O
2C8H18 + 9O2 → 16C + 18H2O
2CO+O2![]() 2CO2
2CO2
N2+O2![]() 2NO
2NO
2NO + O2 = 2NO2
(共4分,正确写出上述中的4个反应就给4分,对一个给1分,写其它合理反应酌情给分)
(2) 125:2 (1分) (3) CO ; NO、NO2或NO2 (每空1分,共2分)
27(4分): CH3—O—C(CH3)3 (其它正确写法也给分,但写成结构式扣1分)
28.(11分)(1)C7H10O5 (2分)
(2)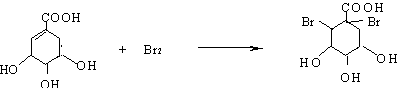 (2分)
(2分)
(3) (2分)
(2分)
(4) 消去反应 (1分)
(5) 3 (2分)
 或
或 或
或 (2分)
(2分)