
 高三化学第一学期上学期试题
高三化学第一学期上学期试题
考试时间:90分钟 试卷分值:100分
命题人:秦 群
本卷分第Ⅰ卷和第Ⅱ卷,第Ⅰ卷为单项选择题,请将所选择的答案用2B铅笔涂在填入答题卡中相应的位置,否则不予记分。第Ⅱ卷为非选择题,请将答案填写在第Ⅱ卷相应的范围内,否则不予记分。
第Ⅰ卷 (选择题 共60分)
一、选择题(每小题只有一个正确选项,3′×20,共60分)
1、我国科学家利用超高真空扫描隧道显微镜在一块晶体硅的表面通过探针的作用搬走原子,写下了“中国”两字。下列说法不正确的是( )
A、上述操作中发生了化学变化 B、上述操作中只发生了物理变化
C、这两个汉字是目前世界上最小的汉字 D、这标志着我国科学已进入操作原子的阶段
2、设某元素原子核内质子数为m,中子数为n,则下列叙述正确的是( )
A、不能由此确定该元素的相对原子质量
B、这种元素原子的相对原子质量为(m+n)
C、若碳原子质量为W g,此原子的质量为(m+n)W g
D、核内中子的总质量小于质子的总质量
3、下表为元素周期表前四周期的一部分。有关表内五种标记元素的叙述中,正确的是( ) A、常压下五种元素的单质中Z单质的沸点最高
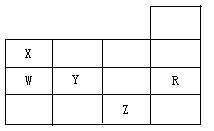 B、Y、Z的阴离子电子层结构都与R原子的相同
B、Y、Z的阴离子电子层结构都与R原子的相同
C、W的氢化物的沸点比X的氢化物的沸点高
D、Y元素的非金属性比W元素的非金属性强
4、下列各组比较不正确的是( )
A、酸性:H4SiO4 < H3PO4 < H2SO4 < HClO4
B、碱性:Be(OH)2 < Mg(OH)2 < KOH
C、氧化性:S < O2 < F2
D、还原性:Se2- < S2- < O2-
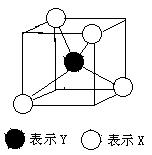
5、常见的离子晶体类型有5种,下图是其中一种空间构型,该晶体中X、Y的离子个数之比可能为( )
A、4:1 B、2:1 C、1:1 D、1:2
6、已知铍(Be)的原子序数为4,下列对铍及其化合物的说法中,正确的是( )
A、铍的原子序数大于硼的原子序数
B、氯化铍分子中铍原子的最外层电子数是8
C、氢氧化铍比氢氧化钙更难溶
D、单质铍跟冷水反应产生氢气
7、甲、乙两种非金属:①甲比乙容易与H2化合;②甲单质能与乙的阴离子发生置换反应;③甲的最高价氧化物对应水化物的酸性比乙的最高价氧化物对应的水化物的酸性强;④与某金属反应时,甲原子得电子数目比乙的多;⑤甲的单质熔、沸点比乙的低。能说明甲比乙的非金属性强的是( )
A、只有④ B、只有⑤ C、①②③ D、①②③④⑤
8、已知H2O2的分子空间结构可在二面角中表示,如图所示:
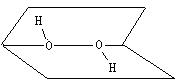
则有关H2O2结构的说法中正确的是( )
A、分子的正、负电荷重心重合 B、分子中各原子在同一条直线上
C、H2O2是极性分子 D、H2O2是非极性分子
9、毛发中含有砷、铅等有毒物质,可以致癌。下列元素中与砷同周期,与铅同主族的是( )
A、 Sb B、Bi C、Ge D、Ga
10、用NA表示阿伏加德罗常数,下列叙述中正确的是( )
A、12 g金刚石晶体中含有碳碳键的数目为4NA
B、常温常压下46 g N2O4和NO2的混合气体含有的原子总数为3NA
C、标准状况下,22.4 L CH3CHO能与NA个氢分子加成
D、SiO2晶体中,有NA个Si就有2 NA个Si-O键
11、下列说法或表示方法中正确的是( )
A、等质量的硫蒸气和硫磺分别完全燃烧后使终态相同,后者放出的热量多
B、氢气的燃烧热为285.8 KJ·mol-1,则氢气燃烧的热化学方程式为:
2H2(g)+O2(g)=2H2O(l);△H =-285.8 KJ·mol-1
C、Ba(OH)2·8H2O(s)+2NH4Cl(s) = BaCl2(s)+2NH3+10H2O(l); △H < 0
D、已知中和热为57.3 KJ·mol-1,若将含0.5 mol H2SO4的浓溶液与含有1 mol NaOH的溶液混合,放出的热量要大于57.3 KJ
12、图中曲线表示原子序数小于20的某些元素的原子序数(按递增顺序连续排列)与其单质沸点的近似关系,其中A点表示的元素是( )
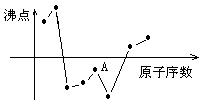
A、Si B、Al C、F D、O
13、既有离子键又有共价键和配位键的化合物是( )
A、NH4NO3 B、NaOH C、H2SO4 D、NH3
14、在短周期元素中,原子最外电子层只有1个或2个电子的元素属于( )
A、金属元素 B、稀有气体元素 C、非金属元素 D、无法确定为哪一类元素
15、下列事实中,能够证明NCl3是共价化合物而不是离子化合物的是( )
A、NCl3能发生水解反应 B、液态NCl3不导电
C、NCl3不易发生热分解反应 D、NCl3呈棕黄色
16、7 g炭粉与14 g氧气在一定条件下恰好完全反应,则生成物中CO与CO2的物质的量之比是( )
A、1∶1 B、2∶1 C、2∶3 D、3∶2
17、如果a g某气体中含有的分子数为b,则c g该气体在标准状况下的体积是(式中NA为阿伏加德罗常数)( )
![]()
18、共价键断裂有均裂和异裂两种方式,均裂:A:B→A·+B·,异裂:A:B→A++[∶B]-。下列化学反应中发生共价键均裂的是( )
A、2K+2H2O=2KOH+H2↑ B、2Na+2C2H5OH=2C2H5ONa+H2↑
C、Na2CO3+H2O=NaHCO3+NaOH D、CH3COOH+C2H5OH→CH3COOC2H5+H2O
19、下列每组物质发生状态变化所克服的粒子间的相互作用力属于同种类型的是( )
A、食盐和蔗糖熔化 B、金属钠和晶体硫熔化
C、碘和干冰升华 D、二氧化硅和氧化钠熔化
20、某固体A在一定温度下分解生成固体B、气体C和气体D,A(s)=B(s)+C(g)+4D(g),若测得生成的气体的质量是同温同压下相同体积氢气质量的10倍,且当所生成气体在标准状况下的体积约为22.4 L时,所得B的质量为30.4 g,则A的摩尔质量是( )
A、130.4 g·mol-1 B、50.4 g·mol-1 C、182.4 g·mol-1 D、252 g·mol-1
第Ⅱ卷 (非选择题 共40分)
二、填空题(共31分)
21、乙硼烷(B2H6)是一种气态高能燃料。0.3 mol B2H6在氧气中充分燃烧,生成固态三氧化二硼和液态水,放出649.5 KJ热量,其热化学方程式为:
。
又已知:H2O(l)=H2O(g);△H =+44 KJ·mol-1,则11.2
L(标准状况)B2H6完全燃烧生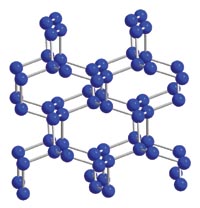 成气态水时放出的热量是
KJ。
成气态水时放出的热量是
KJ。
22、2004年7月德俄两国化学家共同宣布,在高压下氮气会发生聚合得到高聚氮,恢复到常温常压时这种高聚物就变得极不稳定。 在这种高聚氮中氮原子间以共价单键相结合,N-N单键的键能为160 kJ/mol (N2的N≡N键能为942 kJ/mol),晶体结构如图所示。请仔细观察右图,回答下列问题:
(1)在这种晶体中,每个氮原子与 个氮原子结合;
(2)按键型分类时,该固体属于 晶体。
(3)这种固体的可能潜在应用是
,
这是因为: 。
23、A、B、C、D是四种原子序数小于18的主族元素:(1)A原子的电子层数等于最外层电子数,(2)A与B处于同一周期,B与D可形成离子化合物的D2B,该化合物的水溶液呈碱性,(3)C的离子核内质子数与核外电子数之和为18,(4)A、C、D三种元素的离子具有相同的电子层排布。推断A~D各为何种元素,并填空:
(1)A B C D (均填元素符号)
(2)四种元素的离子半径由大到小的顺序为:
(3)用离子方程式表示D2B水溶液呈碱性的原因: 。
三、计算题(共9分)
24、称取金属钠、铝、铁、各m g,在室温下分别与V L 4 mol·L-1的盐酸充分反应,试讨论在下列三种情况下,V值的取值范围(用含m的表达式表示)。
(1)铝与盐酸反应放出的H2最多:
(2)钠与盐酸反应放出的H2最多:
(3)铝与铁分别与盐酸反应,放出的H2一样多: 。
参考答案及评分标准
一、选择题:(每小题只有一个正确选项,3′×20,共60分)
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| 答案 | A | A | D | D | D | C | C | C | C | B |
| 题号 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 |
| 答案 | D | C | A | D | B | D | A | D | C | D |
二、填空题(共31分)
21、(7分)答案:B2H6(g)+3O2 = B2O3(s) + 3H2O(l);△H =-2165 KJ·mol-1(4分)
1016.5 KJ(3分)
22、答案:(8分,每空2分)
(1)3 (2)原子晶体 (3)炸药(或高能材料), 高聚氮分解成N2释放大量能量。
23、(16分)答案:(1)A Al B S C O D Na (每空2分)
(2)r(S2-) > r(O2-) > r(Na+) > r(Al3+)(4分)
(3) S2- + H2O ≒ HS- + OH-,HS- + H2O ≒ H2S +OH- 。(4分)
注:只写第一个离子方程式给全分。
三、计算题(共9分)
24、(9分,每空3分)答案:(1)V > m/92 (2)V < m/92 (3) V ≤ m/112