高三化学上学期第三次月考试卷
化学试卷
(说明:本卷中的18、20、22、23四个大题分创新班和普通班,请先做好选择。)
相对原子质量:
H 1 C 12 O 16 Na 23 Mg 24 S 32 Cl 35.5 Fe 56 Cu 64
一、选择题:(每小题只有一个选项符合题意,每小题2分,共16分)
1.导致下列现象的主要原因与排放SO2有关的是 ( )
A.酸雨 B.光化学烟雾 C.臭氧空洞 D.温室效应
2.下列有关气体体积的叙述中,正确的是 ( )
A、一定温度和压强下,各种气态物质体积的大小,由构成气体的分子大小决定
B、一定温度和压强下,各种气态物质体积的大小,由构成气体的分子数决定。
C、不同的气体,若体积不同,则它们所含的分子数也不同;
D、气体摩尔体积是指1摩尔任何气体所占的体积约为22.4L
![]() 3.已知反应A2(g)+2B2(g) 2AB(g)的△H<0,下列说法正确的是
(
)
3.已知反应A2(g)+2B2(g) 2AB(g)的△H<0,下列说法正确的是
(
)
A.升高温度,正向反应速率增加,逆向反应速率减小
B.达到平衡后,升高温度或增大压强都有利于该反应平衡正向移动
C.升高温度有利于反应速率增加,从而缩短达到平衡的时间
D.达到平衡后,降低温度或减小压强都有利于该反应平衡正向移动
4.下列关于浓硫酸的叙述正确的是 ( )
A.浓硫酸具有吸水性,因而能使蔗糖炭化
B.浓硫酸在常温下可迅速与铜片反应放出二氧化硫气体
C.浓硫酸是一种干燥剂,能够干燥氨气、氢气等气体
D.浓硫酸在常温下能够使铁、铝等金属钝化
5.在常温常压下呈气态的化合物,降温使其变成固体,得到的晶体属于( )
A.分子晶体 B.原子晶体 C.离子晶体 D.金属晶体
6.下列有关药品的保存或使用不正确的是
A、溴水盛于带磨砂玻璃塞的细口瓶中; B、硫酸铜粉末、氯化钙等药品贮存于干燥器中
C、白磷需浸入水中密封保存 D、用碳酸钠滴定盐酸时,Na2CO3溶液应盛于酸式滴定管中
7.Se是人体必需微量 元素,下列有关![]() Se和
Se和![]() Se的说法正确的是
(
)
Se的说法正确的是
(
)
A、![]() Se 和
Se 和![]() Se互为同素异形体
B、
Se互为同素异形体
B、![]() Se和
Se和 ![]() Se互为同位素
Se互为同位素
C、![]() Se和
Se和 ![]() Se 分别含有44和46个质子 D、
Se 分别含有44和46个质子 D、![]() Se和
Se和 ![]() Se都含有34个中子
Se都含有34个中子
8.下列关于胶体的叙述不正确的是 ( )
A.布郎运动是胶体微粒特有的运动方式,可以据此把胶体和溶液、悬浊液区别开来
B.光线透过胶体时,会发生丁达尔效应
C.用渗析的方法净化胶体时,使用的半透膜只能让较小的分子、离子通过
D.胶体微粒具有较大的表面积,能吸附阳离子或阴离子,故在电场作用下会产生电泳现象
二、选择题(每小题只有一个选项符合题意,每小题3分,共24分)
9.在25℃、101 kPa下,1 g甲醇燃烧生成CO2和液态水时放热22.68 kJ,下列热化学方程式正确的是 ( )
A.
CH3OH(l)+![]() O2(g)=CO2(g)+2H2O(l) DH=+725.8 kJ / mol
O2(g)=CO2(g)+2H2O(l) DH=+725.8 kJ / mol
B. 2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(l) DH=-1452 kJ / mol
C. 2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(l) DH=-725.8 kJ / mol
D. 2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(l) DH=+1452 kJ / mol
10.下列叙述正确的是 ( )
A. 发生化学反应时失去电子越多的金属原子,还原能力越强
B. 金属阳离子被还原后,一定得到该元素的单质
C. 核外电子总数相同的原子,一定是同种元素的原子
D. 能与酸反应的氧化物,一定是碱性氧化物
11.设NA代表阿伏加德罗常数,下列说法正确的是 ( )
A. 5.6 g铁与足量盐酸反应转移的电子数为0.3NA
B. 100 mL 2.0 mol/L的盐酸与醋酸溶液中氢离子均为0.2NA
C. 标准状况下,22.4 L氦气与22.4 L氟气所含原子数均为2 NA
D. 20 g重水(D2O)中含有的电子数为10NA
12.下列反应的离子方程式表示正确的是( )
A.碳酸氢钙溶液和氢氧化钠溶液混合:HCO3-+ OH- == CO32- + H2O
B.醋酸钠溶液和盐酸混合:CH3COONa + H+ == CH3COOH + Na+
C.少量金属钠放入冷水中:Na+ + 2H2O == Na+ + 2OH— + H2↑
D.硫酸铜溶液和氢氧化钡溶液混合:
Cu2+ + SO42- + Ba2+ + 2OH- == Cu(OH)2↓ + BaSO4↓
13.已知某溶液中存在较多的H+、SO42-、NO3-,则该溶液中还可能大量存在的离子组是( )
A. Al3+、CH3COO-、Cl- B. Mg2+、Ba2+、Br- C. Mg2+、Cl-、I- D. Na+、NH4+、Cl-
14.关于电解NaCl水溶液,下列叙述正确的是 ( )
A.电解时在阳极得到氯气,在阴极得到金属钠
B.若在阳极附近的溶液中滴入KI试液,溶液呈棕色
C.若在阴极附近的溶液中滴入酚酞试液,溶液呈无色
D.电解一段时间后,将全部电解液转移到烧杯中,充分搅拌后溶液呈中性
15.A、B为二种短周期元素,相互间能形成AB3型化合物,已知A的原子序数为a,B的原子序数为b,则a、b的关系符合下列关系中的:① a=b+5 ② a+b=8 ③ a+b=30 ④a=b+8
A.①②③ B.①②③④ C.②③④ D.①②④
16.某温度下,将Cl2通入NaOH溶液中,反应得到NaCl、NaClO、NaClO3的混合液,经测定ClO-与ClO3-的浓度之比为l :3。则Cl2与NaOH溶液反应时被还原的氯元素与被氧化的氯元素的物质的量之比为 ( )
A.21 :5 B.1l :3 C.3 :1 D.4 :1
三、(本题普通班同学计34分,创新班的同学记36分)
17.(6分)在PH=1的条件下,将含有MnO4- Fe2+ Fe3+ I- 四种离子的溶液混合在一起,充分反应后,若溶液中有 I- 剩余,则溶液中可能还有_________离子存在;若溶液中MnO4-有剩余,则溶液中一定没有____________离子。
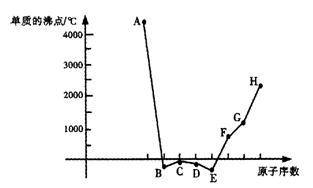 18.(普通班同学做)(8分)
18.(普通班同学做)(8分)
A、B、C、D、E、F、G、H八种短周期元素,其单质的沸点如下图所示。 请回答:
(1)上述元素的最高价氧化物的水化物中,碱性最强的是(写化学式) ;上述元素的气态氢化物中,最稳定的是(写化学式) 。
(2)上述元素中,某些元素的常见单质所形成的晶体为分子晶体,这些单质的分子式是 。
(3)已知D、F、G三种元素的离子均具有跟Ne相同的电子层结构,则这三种离子的半径由大到小的次序为(用相关元素的离子符号表示) > > 。
18.(创新班同学做)(10分)
A、B、C三种元素都是短周期元素,它们的原子核外电子层数相同。A、B元素各自形成的A离子和B离子均和Ne元素的原子电子层结构相同,A元素的氢氧化物比B元素的氢氧化物碱性强。5.8gB的氢氧化物恰好能与100mL 2mol/L盐酸完全反应。C元素的单质化学性质活泼但不能直接和氧气反应。根据上述条件,回答下列问题:
(1)A元素和C元素形成化合物的晶体类型是________晶体。
(2)C元素在元素周期表中的位置是 ;C的最高价氧化物的分子式为 。
(3)B的氢氧化物与盐酸反应的离子方程式: 。
(4)C元素的单质,可用A的最高价氧化物对应的水化物的溶液吸收,其离子方程式为 。
19.(12分)以天然气为原料合成尿素的生产中的主要反应之一为:
![]() CH4(g)+H2O(g) CO(g)+3H2(g);△H>0
CH4(g)+H2O(g) CO(g)+3H2(g);△H>0
请根据题目要求回答下列问题:
(1)在一定条件下,将0.05molCH4和0.10molH2O气放入容积2L的密闭容器中,20s时有0.01molCO生成,则H2的化学反应速率为 。
(2)在其它条件不变的情况下降低温度,则逆反应速率 (填“增大”或“减小”或“不变”,下同);在其它条件不变的情况下加压,则正反应速率 。
(3)在一定条件下,当该反应处于化学平衡状态时,下列操作可使化学平衡向正反应方向移动的是 (填序号)。
A.升高温度 B.降低温度 C.增大压强
D.减小压强 E.加入催化剂 F.移出水蒸气
(4)在一定温度下,将1.0molCH4和2.0molH2O(g)通入某一恒压容器中,达到化学平衡时,混合气体共4.0mol,则CH4的转化率为 ;若其它条件不变,起始时加入a mol CH4 , b mol H2O(g),c mol CO和d molH2达到平衡时,各组分体积分数与上述平衡完全相等,则a、b和c满足的关系为 (用字母表示)。
20.(普通班同学做)(8分)
A、B、C、D、E代表单质或化合物,他们之间的相互转化关系如下图所示。A为地壳中含量仅次于氧的非金属元素单质,其晶体结构与金刚石相似。请填写下列空格:
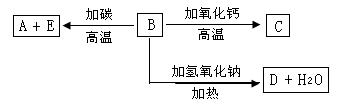
(1)单质A的原子的结构示意图 ,它的最高化合价是 。
(2)B的化学式(分子式)为 ,其晶体类型为 。B和碳反应生成A和E的化学方程式是 。
(3)C的化学式(分子式)为 ,D的化学式(分子式)为 。
20.(创新班同学做)(8分)
已知下图中A至F是化合物,G是单质,其中固体A进行焰色反应时火焰呈黄色。
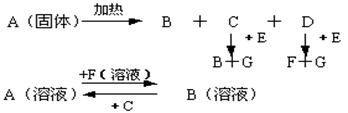
写出A、B、E、F的化学式。A ___ __ B ___ __ E __ _ F ___ _
四、(本大题普通班同学记16分,创新班同学记14分)
21.(6分)下列有关实验的叙述,正确的是(填序号) ▲
A.用98%的浓硫酸配制100g10%的稀硫酸溶液时,除使用量筒外还需用到容量瓶
B.用渗析法分离淀粉中混有的NaNO3杂质
C.无法用分液漏斗将乙二醇和水的混合液体分离
D.用浓氨水洗涤做过银镜反应的试管
E.配制浓硫酸和浓硝酸的混合酸时,将浓硫酸沿器壁慢慢加入到浓硝酸中,并不断搅拌
F.用酸式滴定管量取20.00mL0.1000mol/L的高锰酸钾溶液
G.用托盘天平称取10.50g干燥的NaCl固体
H.在中学《硫酸铜晶体里结晶水含量测定》的实验中,称量操作至少需要四次
I.用瓷坩埚高温熔融NaOH和Na2CO3的固体混合物
J.配制银氨溶液时,将稀氨水慢慢滴加到硝酸银溶液中,产生沉淀后继续滴加到沉淀刚好溶解为止
22.(普通班学生做)(10分)
某校化学小组学生利用下图所示装置进行“乙二酸(俗名草酸)晶体受热分解”的实验,并验证分解产物中有CO2和CO。(图中夹持装置及尾气处理装置均已略去)
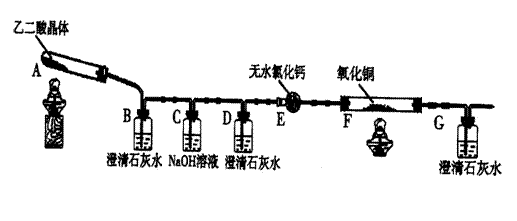 |
(1)①证明分解产物中有CO2的现象是 。
②证明分解产物中有CO的现象是 。
(2)装置C中盛放NaOH溶液的作用是 。
(3)实验结束后,装置F中黑色氧化铜变为红色固体。简述检验红色固体中是否含有Cu2O的实验方法(已知Cu2O溶于稀硫酸生成铜单质和硫酸铜):
。
(4)草酸和草酸钠(Na2C2O4)可以在酸性条件下被KMnO4、MnO2氧化。写出KMnO4、和草酸钠溶液在稀硫酸中反应的离子方程式是:
。
22.(创新班同学做)(8分)
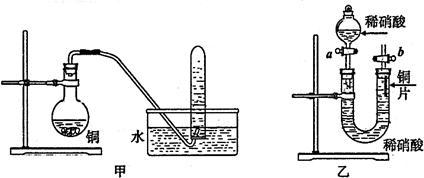
|
(1)写出铜和稀硝酸反应的离子方程式 。
(2)实验装置甲能否证明铜和稀硝酸反应的产物是NO气体 (填:“能”或“不能”),请简述理由(包括化学方程式)是 。
(3)若用实验装置乙进行实验,检查装置气密性的操作是 。
五、(本题共10分)
23.(普通班同学做)
向Cu与CuO的混合物中加入混酸(硝酸和硫酸)后加热,使之恰好完全反应,反应中不产生SO2和Cu(NO3)2,硝酸的还原产物只有NO,且得到NO气体8.96L(标准状况)。将溶液冷却后刚好全部结晶(无其它任何残留物),得到CuSO4·5H2O晶体 250g。试计算:
(1)混酸中硝酸和硫酸的物质的量之比。
(2)原混合物中Cu和CuO的物质的量之比。
(3)混酸中硫酸的质量分数。
 23.(创新班同学做)
23.(创新班同学做)
(1)已知在标准状态下,1体积的水能溶解560体积的氯化氢气体,则所得溶液的溶质质量分数为多少?
(2)右图为某市售盐酸试剂瓶标签上的部分数据。试计算:
①该盐酸的物质的量浓度为多少?(列式计算)
②取该盐酸25.4mL与2.00mol/L的氢氧化钠溶液100mL混合,再将混合后溶液稀释至1.00L,此时溶液的pH约为多少?