高三化学十二月月考测试卷
化 学 试 题
本试卷分第一卷和第二卷两部分,共150分。考试时间120分钟。
相对原子量:H 1 He 4 C 12 N 14 O 16 Na23 S 32 Cu64 Ag 108 Sn119
第一卷(选择题,共72分)
一、选择题(本题包括8小题,每题4分共32分。每小题只有一个选项符合题意。)
1.在日常生活中,雪碧、可口可乐等饮品都是塑料容器盛装,而盛啤酒的容器却是玻璃制品,很少见到用塑料瓶盛装啤酒,这是由于塑料
A.造价太高同时形成白色垃圾而引起环境污染
B.太软,饮用和运输时都很不方便
C.相对玻璃透气性强,啤酒易被氧化而变质
D.属有机物,能与啤酒互溶而不与雪碧、可口可乐等饮品互溶
2.下列各组比较项目包含的数据关系中,前者比后者大的是
A.氨水与氯水中微粒种数 B.NH4+离子与 P4分子中的键角
C.C2H2与 C6H6分子中碳碳键键长 D.同温同压下同体积的氦气和氢气所含原子数
3.已知KMnO4与双氧水反应的化学方程式为:
2KMnO4+5H2O2+3H2SO4=2MnSO4+5O2↑+K2SO4 +8H2O,则5molO2参加反应则转移电子
A.5mol B.20mol C.15mol D.10mol
4.下列各组物质发生化学反应:①Fe +O2 ②P + Cl2 ③Cu + HNO3 ④Na + O2 ⑤Fe + Cl2 ⑥P2O5 + H2O ⑦H2S + O2 ⑧C + O2 ,在不同情况下能得到不同产物的是
A.全部 B.除①外的其它组
C.除③外的其它组 D.除⑤外的其它组
5.某金属氧化物在光照下可生成具有很强氧化能力的物质,能用来消除空气或水体中的污染物。下列有关该金属氧化物的应用的叙述不正确的是 ( )
A.将形成酸雨的SO2氧化为SO3
B.将家居装修挥发出的甲醛氧化为CO2和H2O
C.将医药废水中的苯酚氧化成H2O和CO2
D.将电镀废水中的氰根离子CN-氧化成CO2和N2
6.高铁电池是一种新型可充电电池,与普通高能电池相比,该电池能长时间保持稳定的放电电压。高铁电池的总反应为:
![]()
下列叙述不正确的是:
A.放电时负极反应为:Zn—2e- +2OH-= Zn(OH)2;
B.充电时阳极反应为:Fe(OH)3 —3e- + 5OH- = FeO42- + 4H2O;
C.放电时每转移3 mol电子,正极有1mol K2FeO4被氧化;
D.放电时正极附近溶液的碱性增强。
7. 在一定温度下,向饱和的烧碱溶液中加入一定量的Na2O2,充分反应后恢复到原来温度,下列说法中正确的是
A.溶液的pH不变,有H2放出 B.溶液中Na+ 数目减小,有O2放出
C.溶液的pH增大,有O2放出 D.溶液中c(Na+ )增大,有O2放出
8.不能用胶体的知识解释的现象是( )
A、牛油与氢氧化钠溶液共煮,向反应后所得的液体中加入食盐,会有固体析出
B、一支钢笔使用两种不同牌号的蓝墨水,容易出现堵塞
C、向氯化铁溶液中加入NaOH溶液,会出现红褐色沉淀
D、在河水与海水的交界处,易形成三角洲
二、选择题(本题包括8小题,每小题4分,共32分.每小题有一个或两个选项符合题意.若正确答案只包括一个选项,多选时,该题为0分;若正确答案包括两个选项,只选一个且正确的给2分,选两个且都正确的给4分,但只要多选或错选,该小题就为0分.)
9、下列反应的离子方程式正确的是
A.Fe3O4与稀硝酸反应:Fe3O4+8H+![]() Fe2++2Fe3++4H2O
Fe2++2Fe3++4H2O
B.电解饱和食盐水:2Cl-+2H2O![]() Cl2↑+H2↑+2OH-
Cl2↑+H2↑+2OH-
C.Ca(HCO3)2与过量Ca(OH)2溶液反应:Ca2++2HCO3—+2OH—![]() CaCO3↓+CO32—+2H2O
CaCO3↓+CO32—+2H2O
D.Na2S溶液呈碱性:S2—+2H2O![]() H2S+2OH—
H2S+2OH—
10、设NA表示阿伏加德罗常数的数值,下列说法正确的是
A.由2H和18O所组成的水11g,其中所含的中子数为5NA
B.2.4g金属镁变为镁离子时失去的电子数为0.1NA
C.常温常压下,48gO2和O3混合气含有的氧原子数为3NA
D.SiO2晶体中,1mol硅原子与氧原子共形成2NA个Si-O键
11、现有下列四个图像:
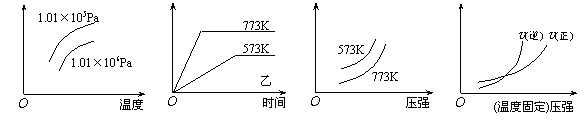 |
下列反应中全部符合上述图像的反应是
A.N2(g)+3H2(g) ![]() 2NH3(g);△H=-Q1kJ/mol(Q1>0)
2NH3(g);△H=-Q1kJ/mol(Q1>0)
B.2SO3(g) ![]() 2SO2(g)+O2(g);△H=+Q2
kJ/mol(Q2>0)
2SO2(g)+O2(g);△H=+Q2
kJ/mol(Q2>0)
C.4NH3(g)+5O2(g) ![]() 4NO+6H2O(g);△H=-808.7 kJ/mol
4NO+6H2O(g);△H=-808.7 kJ/mol
D.C(s)+CO2(g) ![]() 2CO(g);△H=+171.4kJ/mol
2CO(g);△H=+171.4kJ/mol
12、下列各组离子在水溶液中能够大量共存,无论向溶液中加入哪种物质,只要使由水电离产生的c(OH—)=1×10—14mo1·L—1,溶液中都会有沉淀生成。该组离子可能是
A.NH4+、K+、Cl—、SO32— B.K+、Na+、SiO32—、AlO2—
C.Ba2+、Na+、HSO3—、NO3— D.Fe2+、NH4+、NO3—、C1—
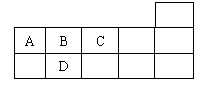 13、右表为元素周期表短周期的一部分,下列有关A、B、C、D四种元素的叙述不正确的是
13、右表为元素周期表短周期的一部分,下列有关A、B、C、D四种元素的叙述不正确的是
A.原子半径大小比较为D>B>C
B.生成的氢化物分子间均可形成氢键
C.A与C形成的阴离子可能有AC32-、A2C42-
D.A、B、C、D的单质常温下均不导电
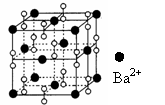 14、钡在氧气中燃烧时的得到一种钡的氧化物晶体,其结构如下图所示,有关说法正确的是
14、钡在氧气中燃烧时的得到一种钡的氧化物晶体,其结构如下图所示,有关说法正确的是
A.该晶体属于离子晶体 B.晶体的化学式为Ba2O2
C.该晶体晶胞结构与CsCl相似
D.与每个Ba2+距离相等且最近的Ba2+共有12个
15、下列实验过程中产生的现象与对应的图形符合的是
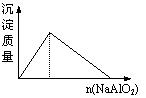 | |||
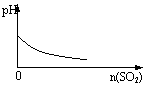 | |||
A.盐酸溶液中加入NaAlO2; B.SO2气体通入溴水中
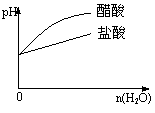 | |||
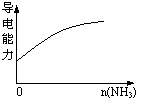 | |||
C.pH=2的醋酸与盐酸溶液分别加水稀释 D.氨气通入醋酸溶液中
16、0.1mol/LKHSO4和0.1mol/LNa2S溶液等体积混合后,溶液能使pH试纸变蓝,则离子浓度关系正确的是
A.c(SO42-)>c(HS-)>c(OH-)>(H+) B.c(Na+)>c(K+)>c(H+)>c(OH-)
C.c(Na+)=2c(S2-)+c(H2S)+c(HS-)+2(SO42-)
D.c(Na+)+c(K+)+c(H+)=c(SO42-)+c(S2-)+c(HS-)+c(OH-)
第Ⅱ卷(选择题 共86分)
三、(本题包括2小题,共22分)
17.(10分)电解法制碱的主要原料是饱和食盐水,由于粗盐水中含有泥沙、Ca2+、Mg2+、Fe3+、SO42-等杂质,不符合电解要求,因此必须经过精制。某同学设计了一种制备精盐的实验方案,步骤如下(用于沉淀的试剂稍过量):
步聚1:取一定量的粗盐,置于烧杯中,加入足量的水,配成粗盐水;
步聚2:向粗盐水中加入除杂试剂,然后进行过滤,滤去不溶物,再向滤液中加入盐酸调节盐水的pH;
步聚3:将得到的溶液蒸发浓缩、冷却、结晶、过滤、烘干即得精盐;
请回答以下问题:
(1)上述实验中的过滤操作需要烧杯、____________、___________等玻璃仪器。
(2)步聚2中常用Na2CO3、NaOH、BaCl2作为除杂试剂,则加入除杂试剂的顺序为:___________;
(3)步聚2中,判断加入BaCl2已过量的方法是:______________________;
(4)步聚2中,若先用盐酸调节pH再过滤,将会对实验结果产生影响,其原因是:
 ________________________________________________;
________________________________________________;
(5)为检验精盐纯度,需配制150 mL 0.2 mol/L NaCl(精盐)溶液,上图是该同学转移溶液的示意图,图中的错误是___________________、_____________________。
18.(12分)铁是人体必须的微量元素,治疗缺铁性贫血的常见方法是服用补铁药物。“速力菲”(主要成分:琥珀酸亚铁,呈暗黄色)是市场上一种常见的补铁药物。该药品不溶于水但能溶于人体中的胃酸。
某同学为了检测“速力菲”药片中Fe2+的存在,设计并进行了如下实验:

⑴ 试剂1是 ,试剂2是 ,加入新制氯水后溶液中发生的离子反应方程式是 , ;
⑵ 加入试剂2后溶液中颜色由淡黄色转变为淡红色是因为 ,
写出+2价Fe在空气中转化为+3价Fe的化学方程式 ;
⑶ 该同学猜想血红色溶液变为无色溶液的原因是溶液中的+3价铁被还原为+2价铁,你认为该同学的猜想合理吗? 。若你认为合理,请说明理由(若你认为不合理,该空不要作答) ;若你认为不合理请提出你的猜想并设计一个简单的实验加以验证(若你认为合理,该空不要作答) 。
四、(本题包括3小题,共29分)
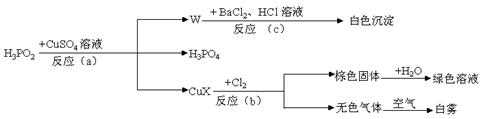
19.(8分)次磷酸(H3PO2)是一种强还原性弱酸,它能发生下列反应:
|
(1)CuX中X是表示一种元素,这种元素是 。
(2)反应(a)的化学方程式为 ,其中被氧化的元素是 ,还原产物是 (写物质的名称)。
(3)反应(c)的离子方程式为 。
(4)反应(b)中,当有1molCuX被氧化时,转移的电子数目为 个。
20. (10分)归纳整理是科学学习的重要方法之一。在学习了氧族元素的各种性质后,可归纳整理出如下表所示的表格(部分)。
| 性质\元素 | 8O | 16S | 34Se | 52Te |
| 单质熔点(℃) | -218.4 | 113 | 450 | |
| 单质沸点(℃) | -183 | 444.6 | 685 | 1390 |
| 主要化合价 | -2 | -2,+4,+6 | -2,+4,+6 | |
| 原子半径 | 逐渐增大 | |||
| 单质与H2反应情况 | 点燃时易化合 | 加热化合 | 加热难化合 | 不能直接化合 |
请根据表回答下列问题:
(1) 硒的熔点范围可能是______________(2) 碲的化合价可能有_________________
(3) 硫、硒,碲的氢化物水溶液的酸性由强至弱顺序是_________________(填化学式)。
(4) 氢硒酸有较强的_________(填“氧化性”或“还原性”),因此放在空气中长期保存易变质,其可能发生的化学方程式为_______________________________________。
 (5) 工业上Al2Te3可用来制备H2Te,完成下列化学方程式:
(5) 工业上Al2Te3可用来制备H2Te,完成下列化学方程式:
____A12Te3 + ( ) 一( )A1(OH)3↓ +( )H2Te↑
⑹已知在常温下,生成17g H2S放出56.1KJ的热量,试写出硫化氢分解的热化学方程式
_________________________________。
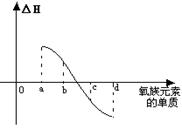
(7) 右图所示为氧族元素单质与H2反应过程中的能量变化示意图,其中a、b、c、d分别表示氧族中某一元素的单质,△H为相同物质的量的单质与H2反应的反应热。则:b代表________________,d代表_____________(均写单质名称)。
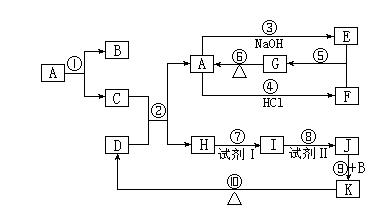 21.(11分)下列物质均为中学化学常见物质,转化关系如右图所示,(反应条件及部分反应物、产物未全部标出)。
21.(11分)下列物质均为中学化学常见物质,转化关系如右图所示,(反应条件及部分反应物、产物未全部标出)。
(1)写出下列物质的化学式:
A:___________; K:___________。
(2)C与D的混合物通常叫做________________ (填名称)。
(3)写出下列反应的化学方程式(注明反应条件,若是离子反应的与离子方程式):
②:__________________________________________________________________:
③:__________________________________________________________________:
⑧:__________________________________________________________________:
⑨:__________________________________________________________________。
五、(本题包括1小题,共10分)
22.(10分)在装修居室时,如使用不合格的建筑、装潢材料,易造成“室内空气污染”,影响人们身体健康,造成室内空气污染的有毒物质主要有甲醛、苯、氨、氡等。学好化学有助于我们设法减少居室内的空气污染,消除空气中的有害物质对人体可能产生的影响。回答下列问题:
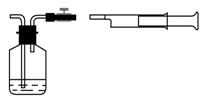 (1)我国《室内空气质量标准》规定室内空气中甲醛含量不得超过0.08mg/m3。小陈同学为测定新居内空气中甲醛含量是否超标,设计了如图所示的简易实验装置:
(1)我国《室内空气质量标准》规定室内空气中甲醛含量不得超过0.08mg/m3。小陈同学为测定新居内空气中甲醛含量是否超标,设计了如图所示的简易实验装置:
①请你帮助小陈同学选择装置中试剂瓶内的药品:_____(填序号);
a.银氨溶液 b.酸性高锰酸钾溶液 c.新制得氢氧化铜悬浊液
根据你的选择,为使实验现象明显,你认为对所选择试剂的浓度有什么要求__________________________________________________________________;
②在检查好装置气密性和选择好试剂瓶内的药品后,请你帮助小陈同学完成该实验的操作:________________________________________________________;
③若试剂瓶内溶液的体积和浓度已知,实验时还需测定的数据有:
_______________________________、________________________________;
(2)请你提出减少室内空气污染的措施:____________________________________;
六、(本题包括1小题,共12分)
23.(12分)有如下化学反应:2A(g)+B(g)![]() 2C(g),△H<0。
2C(g),△H<0。
I (1)若将4molA和2molB在2L的容器中混合,经2s后达到平衡,测得C的浓度为0.6mol·L-1,用物质A表示的平均反应速率为____________;2s时物质B的浓度为_______________;
(2)若将amolA和bmolB、cmolC在2L的容器中混合,经2s后,达到平衡测得C的浓度为0.6mol·L-1,如果反应是从逆方向开始到达平衡,则c的取值范围_______________;
II若把amolA和bmolB充入一密闭容器中,达到平衡时它们的物质的量满足:
n(A)+n(B)=n(C),则A的转化率为_________________;
 III若将4molA和2molB加入体积可变的等压容器中,一定温度下达到平衡状态,测得气体总物质的量为4.2mol。此时,混合气体中C的体积分数为_____________;若再通入少量B气体,体系中A的体积分数_____________(填“增大”、“减小”或“不变”),若要使A的体积分数再达到与原平衡状态相同,可采取的措施有____________________________。
III若将4molA和2molB加入体积可变的等压容器中,一定温度下达到平衡状态,测得气体总物质的量为4.2mol。此时,混合气体中C的体积分数为_____________;若再通入少量B气体,体系中A的体积分数_____________(填“增大”、“减小”或“不变”),若要使A的体积分数再达到与原平衡状态相同,可采取的措施有____________________________。
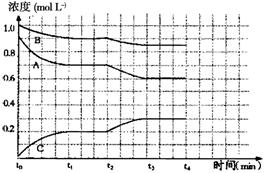
IV右图是一定条件下该反应过程中,体系内各物质浓度的变化情况。反应处于平衡状态的时间是________________,t2时曲线发生变化的原因是________________________________
七、(本题包括2小题,共13分)
24.(5分)碘盐是日常生活中必不可少的调味品,我国强制推广食用加碘盐。根据GB5461——《国家食用盐标准》,碘元素含量为20~50mg/kg为合格。质量监督部门为检测某品牌加碘盐是否合格,进行了如下实验:称取250g 某品牌加碘盐样品,在酸性条件下用足量KI溶液将其中IO3-全部转化成I2,生成的I2再用0.010mol/L的硫代硫酸钠溶液滴定,滴定到终点时用去12mL。
有关反应如下:
①IO3-+5I-+6 H+![]() 3I2+3H2O
3I2+3H2O
②I2+2S2O32-![]() 2I-+S4O62-
2I-+S4O62-
(1)用硫代硫酸钠溶液滴定I2时,应用________作指示剂,滴定到终点的现象是________;
(2)试通过计算说明该加碘食盐是否为合格产品(写出具体的计算过程)。
25.(8分)含氮废水进入水体而对环境造成的污染越来越严重,环境专家认为可以用金属铝将水体中的NO3-还原为N2而消除污染,Al则转变为Al(OH)3。
⑴ 写出Al和水体中NO3-反应的离子方程式 ;
⑵ 某水库水的实际容量大约为1×1010m3,1m3水体中含N元素4.2g,假设中N元素全部以NO3-的形式存在,则除去该水库中的N元素,大约需要金属铝 kg;
⑶ 事实上,金属镁比金属铝能更快的消除水体中N污染,反应原理和金属铝相同。金属镁可由下述方法制得:
![]()
如果用金属镁除去该水库中的N元素,大约需要含MgCl20.5%(质量分数)的海水多少kg?
⑷ 目前国际现货市场每吨镁粉的价格为1730美元左右,每吨铝粉的价格为3585美元左右,从价效比的角度出发,请通过计算分析应选用哪种金属消除水体中的N元素?
答题纸
三、(本题包括2小题,共22分)
17.(10分)
(1)需要烧杯、____________、___________等玻璃仪器。
(2)除杂试剂的顺序为:______________________________________;
(3方法是:
________________________________________________;
(4)其原因是:
________________________________________________;
(5)图中的错误是___________________、_____________________。
18.(12分)
⑴ 试剂1是 ,试剂2是 ,
离子反应方程式是 , ;
⑵因为 ,
化学方程式 ;
⑶合理吗? 。若你认为合理,请说明理由(若你认为不合理,该空不要作答) ;
若你认为不合理请提出你的猜想并设计一个简单的实验加以验证(若你认为合理,该空不要作答)
四(本题包括3小题,共29分)
19.(8分)
1)这种元素是 。
(2)化学方程式为 ,
其中被氧化的元素是 ,还原产物是 (写物质的名称)。
(3)反应(c)的离子方程式为 。
(4)转移的电子数目为 个。
20. (10分)
(1) 硒的熔点范围可能是______________(2) 碲的化合价可能有_________________
(3)由强至弱顺序是_________________(填化学式)。
(4)较强的_________(填“氧化性”或“还原性”),
化学方程式为_______________________________________。
(5):____A12Te3 + ( ) 一( )A1(OH)3↓ +( )H2Te↑
⑹热化学方程式_________________________________。
(7)则:b代表________________,d代表_____________(均写单质名称)。
21.(11分)
(1)写出下列物质的化学式:A:___________; K:___________。
(2)C与D的混合物通常叫做________________ (填名称)。
(3)
②:__________________________________________________________________:
③:__________________________________________________________________:
⑧:__________________________________________________________________:
⑨:__________________________________________________________________。
五、(本题包括1小题,共10分)
22.(10分)
①药品:_____(填序号);
浓度有什么要求__________________________________________;
②操作:________________________________________________________;
③数据有:_________________________、________________________________;
(2)措施:____________________________________;
六、(本题包括1小题,共12分)
23.(12分)I(1)平均反应速率为____________;2s时物质B的浓度为_______________;
(2)c的取值范围_______________;
II A的转化率为_________________;
III C的体积分数为_____________;体积分数_____________(填“增大”、“减小”或“不变”),措施有____________________________。
IV时间是________________,原因是________________________________
七、(本题包括2小题,共18分)
24. (1),应用________作指示剂,滴定到终点的现象是________;
(2)试通过计算说明该加碘食盐是否为合格产品(写出具体的计算过程)。
25.(10分) ⑴离子方程式 ;
⑵大约需要金属铝 kg;(写出具体的计算过程)
⑶大约需要含MgCl20.5%(质量分数)的海水多少kg?(写出具体的计算过程)
⑷请通过计算分析应选用哪种金属消除水体中的N元素?(写出具体的计算过程)
化学试题参考答案及评分标准
一、单项选择题(本题包括8小题,每小题4分,共32分。每小题只有一个选项符合题意)
1.c 2.b 3.c 4.b 5.B 6.b 7.d 8.d
二、不定项选择题(本题包括8小题,每小题4分,共32分。每小题有一个或两个选项符合题意。若正确答案只包括一个选项,多选时,该题为0分;若正确答案包括两个选项,只选一个且正确的得2分,选两个且都正确的得满分,但只要选错一个该小题就为0分)
9.ad 10.bc 11. c 12.c 13.C 14.B 15.b 16.a
三、(本题包括2小题,共22分)
17.(10分)(1)玻璃棒 漏斗 (2分)
(2)NaOH→BaCl2→Na2CO3 (2分)
(3)取所得溶液的上层清液1~2滴于滴定板上,再滴入1~2滴BaCl2溶液,若溶液未变浑浊,则表明BaCl2已过量 (2分)
(4)在此酸度条件下,会有部分沉淀溶解,从而影响制得精盐的纯度 (2分)
(5)未用玻璃棒引流;未采用150 mL容量瓶。 (2分)
18.(12分)⑴ 稀盐酸 KSCN溶液 2Fe2++Cl2=2Fe3++2Cl-
Fe3++SCN-=[Fe(SCN)]2+ (每空1分)
⑵ 少量的Fe2+转化为Fe3+,加入KSCN后显红色
4Fe2++4H++O2=4Fe3++2H2O (每空2分)
⑶ 不合理 我的猜想是[Fe(SCN)]2+离子中的SCN-被过量的氯水氧化。设计的实验为在褪色后溶液加入FeCl3溶液,仍不变红色(或在褪色后溶液加入加入KSCN溶液,变红色)
四、(本题包括2小题,共18分)
20、(10分)⑴ 113 ~ 450℃ ⑵-2、+4、+6 ⑶H2Te>H2Se>H2S;
⑷ 还原性 (以上每空1分) 2H2Se + O2 == 2H2O + 2Se
⑸ A12Te3 + ( 6H2O) = 2A1(OH)3↓ +3H2Te↑ (以上每空1分)
⑹H2S(g)=H2(g)+S(s);△H=+112.2KJ/mol (2分)
⑺硒 氧气 (每空1分)
21.(1)Al2O3、Fe(OH)3(2)铝热剂(3)略
(2分)
五、(本题包括1小题,共10分)
22.(10分)(1)①b (2分)
空气中甲醛含量很小,所选试剂的浓度宜小不宜大 (2分)
②慢慢用注射器抽气,反复若干次直至试剂瓶内溶液颜色刚好褪去 (2分)
③注射器的容积、抽气的次数 (2分)
(2)经常打开门窗,保持室内空气流通 (2分)
六、(本题包括2小题,共18分)
1 (1) 0.3mol·L-1·S-1 0.7mol·L-1(2)
2 ![]() ×100% 、
×100% 、
3 85.7%(1分)减小 升高温度 充入A气体 减小压强
4 t1-t2 t3-t4降低温度
七、(本题包括2小题,共18分)
24.(8分)(1)淀粉溶液 蓝色刚好褪去 (2分)
(2)由①②方程式可知:IO3-~3I2~6 S2O32- (1分)
n(IO3-)=![]() n(S2O32-)=
n(S2O32-)= ![]() ×0.012L×0.010mol/L=2×10-5mol (2分)
×0.012L×0.010mol/L=2×10-5mol (2分)
则250g 样品中含有碘元素的质量为:2×10-5mol×127g/mol×1000mg/g=2.54mg (1分)
该加碘食盐中碘元素的含量为:![]() (1分)
(1分)
因为10.16mg/kg<20mg/kg,所以该加碘盐不合格 (1分)
25.25.(10分)⑴ 6NO3-+10Al+18H2O=3N2↑+10Al(OH)3+6OH- (2分)
⑵ 1.35×108kg (2分)
⑶ 解:金属镁与NO3-反应的离子方程式为:
![]() 2NO3-+5Mg+6H2O=N2↑+5Mg(OH)2+2OH-
2NO3-+5Mg+6H2O=N2↑+5Mg(OH)2+2OH-
则1m3水体应消耗Mg:
(2分)
相当于消耗MgCl20.75mol,相当于消耗海水0.75mol×95g·mol-1÷0.5%=14.25kg
则除去该水库水体中的N元素大约消耗海水1×1010×14.25kg=1.425×1011kg (2分)
⑷ 分别除去1m3水体中的N元素,需消耗金属铝13.5g,消耗金属镁18g,除去等体积水体中的N元素,消耗的镁与铝的质量比为4∶3,但镁与铝的价格比约为1∶2。且金属镁比金属铝能更快的消除水体中N污染,所以应当选用金属镁。 (2分)
新19 (1)氢(2分)。
(2)6H2O+3H3PO2+4CuSO4=3H3PO4+4CuH+4H2SO4(3分),次磷酸中的磷元素(2分),
氢化亚铜(2分)
(3)SO42-+Ba2+=BaSO4↓(2分)
(4)1.806×1024(3分)