高三化学上学期期中联考试卷
化学试题
原子量:H—1 C—12 O—16 S—32 Cu—64 Cl—35.5 N—14 Na—23
一、选择题(本题共18小题,每小题只有一个正确选项,18×3=54分)
1.2004年,美国科学家通过“勇气”号太空车探测出水星大气中含有一种称为硫化羰(化学式为COS,羰音tang)的物质,己知硫化羰的结构与二氧化碳相似,但能在氧气中完全燃烧,下列有关硫化羰的说法中正确的是
A.硫化羰是酸性氧化物
B.硫化羰是由极性键构成的非极性分子
C.硫化羰可用做灭火剂
D.硫化羰在氧气中完全燃烧后的生成物是CO2和SO2
2.磁流体是电子材料的新秀,它既具有同体的磁性,又具有液体的流动性。制备时将含等物质的量的FeSO4和Fe2(SO4)3的溶液混合,再滴入稍过量的氢氧化钠溶液,随后加入油酸钠溶液,即可生成黑色的、分散质粒子的直径在5.5nm~36nm的磁流体。下列说法中正确的是
A.所得的分散系属于悬浊液 B.所得的分散系中的分散质为Fe2O3
C.给分散系通电时阳极周围黑色加深 D.该分散系能产生丁达尔效应
3.很多物质的名称中含有水,“水”通常有三种含义:①表示水这种物质;②表示水溶液;③表示物质处于液态。下列物质名称中的“水”不是以上三种含义的是
A.重水 B.溴水 C.水银 D.水晶
4.用含H37Cl的溶液跟K35ClO3晶体在一定条件下充分反应后,生成氯气、氯化钾和水:此反应生成氯气的式量为
A.72 B.73 C.73.33 D.70.6
5.在标况下,将CO2和CO混和气体(密度为10/7g·L-1)充满一盛有足量的Na2O2的密闭容器中(容积为22.4L,固体体积忽略不计)用不间断的电火花引发至充分反应,下列对完全反应后容器里残留物的叙述正确的是
A.有0.125mol O2 B.有0.5mol O2
C.有0.5mol CO D.有0.25mol Na2CO3
6.NA表示阿伏加德罗常数的值,下列说法正确的是
A.铁、铜和稀硫酸构成原电池,当转移NA个电子时,产生的气体体积为11.2L
B.通常状况下将0.5mol HI气体和0.5 mol C12混合后,气体的分子数为NA
C.标准状况下0.5 NA个Br2所占的体积约为11.2L
D.53gNa2C0![]() 固体含有的离子数为1.5NA
固体含有的离子数为1.5NA
7.下列离子方程式书写正确的是
A.硫酸亚铁加过氧化氢溶液:Fe2++H2O2+2H+====Fe3++4H2O
B.将少量硝酸银溶液滴入氨水中:Ag++2NH3·H2O==== [Ag(NH3)2]++2H2O
C.KAl(SO4)2中滴加Ba(OH)2使SO42![]() 恰好完全沉淀
恰好完全沉淀
2Al3++3SO2![]()
![]() +3Ba2++6OH
+3Ba2++6OH![]() ====2Al(OH)3 ↓+3Ba SO4↓
====2Al(OH)3 ↓+3Ba SO4↓
D.铝粉与NaOH的D2O溶液反应:2Al+2OH![]() +2D2O====2AlO
+2D2O====2AlO![]() +H2↑+2D2↓.
+H2↑+2D2↓.
8.NH![]() 浓度相同的下列各物质的溶液中,溶液的物质的量浓度最大的是
浓度相同的下列各物质的溶液中,溶液的物质的量浓度最大的是
A.NH4Al(S04)2 B.NH4HC03 C.NH4HS04 D.NH4N03
9.某阳离子X2+的原子核外有5个电子层,最外层含有2个电子,把固体XCl2溶于水配制成溶液时需加入少量的单质x和盐酸。由此判断下列说法中正确的是
A.X元素的常见化合价为+2和+3
B.X(OH)2呈强碱性
C.XCl2的溶液显酸性
D.X元素的最高价氧化物的水化物显强酸性
10.1g氢气在氧气中完全燃烧生成气态水,放出热量120.9kJ,则
A.反应的热化学方程式:2H2(g)+O2(g)=2H2O(g);△H=+483.6 kJ·mol![]() 1
1
B.氢气的燃烧热为241.8kJ·mol![]() 1
1
C.1molH20(1)的能量大于lmolH2O(g)的能量
D.2molH2和1mol02的能量总和大于2molH2O(g)的能量
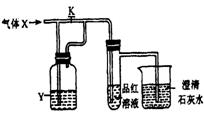 11.右图是一套检验气体性质的实验装置,向装置中缓缓地通入气体X,若关闭活塞K,则品红溶液无变化,而澄清石灰水变浑浊:若打开活塞K,则品红溶液褪色。据此判断气体X和洗气瓶内液体Y可能是下表中的
11.右图是一套检验气体性质的实验装置,向装置中缓缓地通入气体X,若关闭活塞K,则品红溶液无变化,而澄清石灰水变浑浊:若打开活塞K,则品红溶液褪色。据此判断气体X和洗气瓶内液体Y可能是下表中的
| A | B | C | D | |
| X | H2S | SO2 | CO2 | Cl2 |
| Y | 浓硫酸 | NaHCO3 饱和溶液 | Na2SO3 溶液 | NaHSO3 饱和溶液 |
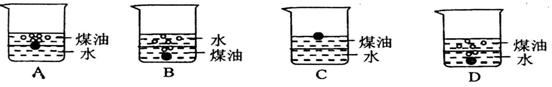
12.向一小烧杯中分别加入等体积的水和煤油,片刻后再向该烧杯中轻缓地加入绿豆大小的金属钠,可能观察到的现象是
13.在容积恒定的密闭容器中放入2molA和lmolB在一定条件下发生反应:2A(g)+B(g)![]() 2C(g),当达到平衡时测得压强减小
2C(g),当达到平衡时测得压强减小![]() ,则A的转化率为
,则A的转化率为
A.60% B.50% C.40% D.30%
14.原子的核电荷数小于18的某元素X,其原子的电子层数为n,最外层电子数为2n+l,原子核内质子数是2n2-1。下列有关x的说法中,不正确的是
A.X能形成化学式为X(OH)3的碱
B.X可能形成化学式为KXO3的含氧酸钾盐
C.X原子的最外层电子数和核电荷数肯定为奇数
D.X能与某些金属元素形成化合物
15.常温下,将PH=1的硫酸溶液平均分成两等份,一份加入适量的水,另一份加入与该硫酸溶液物质的量浓度相同的氢氧化钠溶液,两者PH都升高了l,则加入的水和氢氧化钠溶液的体积比为
A.5︰l B.6︰l C.10︰1 D.1l︰l
16.某溶液中大量存在以下五种离子:NO![]() 、SO2
、SO2![]() -4、Fe3+、H+、M,其物质的量之比为:n(NO
-4、Fe3+、H+、M,其物质的量之比为:n(NO![]() ):n(SO2
):n(SO2![]() 4):n(Fe3+):n(H
4):n(Fe3+):n(H![]() ):n(M)=2︰3︰1︰3︰1,则M可能是
):n(M)=2︰3︰1︰3︰1,则M可能是
A.Fe2+ B.Mg2+ C.Cl![]() D.Ba2+
D.Ba2+
17.已知HF的酸性比HCN的酸性强,现有物质的量浓度和体积相同的NaF和NaCN两种溶液,已知NaF溶液中离子数目为nl,NaCN溶液中离子数目为n2,下列关系式中正确的是( )
A.nl=n2 B.nl>n2 C.nl<n2 D.c(F-)<c(CN-)
18.某些盐在溶液中结晶时,析出的晶体是结晶水合物。下表记录了t°C的4份相同的硫
酸铜溶液中加入的无水硫酸铜的质量以及析出的硫酸铜晶体(CuS04·5H2O)的质量(温度维持不变)的实验数据
| 硫酸铜溶液 | Ⅰ | Ⅱ | Ⅲ | Ⅳ |
| 加入的无水硫酸铜(g) | 2.5 | 4.0 | 6.0 | 8.0 |
| 析出的硫酸铜晶体(g) | 0.10 | 2.8 | 6.4 | 10.0 |
当加入4.6g无水硫酸铜时,析出硫酸铜晶体的质量为
A.3.42g B.3.88g C.6.82g D.2.56g
二、实验题(本题共2小题,共20分)
19.(10分)
请按要求填空:
(1)指出下列实验用品或仪器(已经洗涤干净)使用时的第一步操作:
①石蕊试纸(检验气体性质)______________;
②容量瓶____________。
(2)当NaHCO3溶液中混有Na2CO3,为除去Na2CO3可以通入__________,化学方程式为_________________。
 (3)BaSO4中混有AgCl可通过加入__________使AgCl转化为可溶的____________除去。
(3)BaSO4中混有AgCl可通过加入__________使AgCl转化为可溶的____________除去。
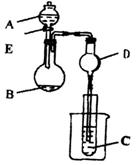
20.(10分)
用下图装置进行实验,将A逐滴加入B中:
(1)若A为浓H2SO4,B为第三周期金属元素的片状单质,其在常温下难与水反应;C为品红溶液,实验中观察到C中溶液褪色,则B是__________________(填化学式),B与浓H2SO4反应的化学方程式为____________________。反应后往烧杯中加入沸水,又可观察到试管C中的现象为___________________。
(2)若B为KMnO4晶体,C为品红溶液,实验中观察到C中溶液褪色,则B中发生反应的化学方程式是__________________。然后往烧杯中加入沸水,试管C中的现象是______________________。
(3)若B是生石灰,实验中观察到C溶液从无色变红色,则A是____________,C是
___________仪器D在此实验中的作用是_________________________________。
三、推断题(本题共2小题,共16分)
21.(6分)
A、B、C、D均为常见的短周期元素,常温下A、B可形成两种常见的液态化合物,其最简式分别为BA和B2A、B与D可形成分子X,也可形成阳离子Y,X 和Y在水溶液中酸碱性正好相反,C![]() 的焰色反应呈黄色。
的焰色反应呈黄色。
(1)C元素在周期表中的位置是_____________,液态X类似B2A也能微弱电离产生电子数相同的两种离子,则液态x的电离方程式:_________________________。
(2)M、N是由A、B、C、D四种元素中任意三种元素组成的不同类型的强电解质,M的水溶液呈碱性,N的水溶液呈酸性,且M溶液中水的电离程度小于N溶液中水的电离程度。则M、N分别为________________(填化学式)。若将0.1m01.L![]() 1M和0.2mol.L
1M和0.2mol.L![]() 1N两溶液等体积混和所得溶液中离子浓度的大小顺序__________________________。
1N两溶液等体积混和所得溶液中离子浓度的大小顺序__________________________。
22.(10分)
位于短周期的原子序数依次增大的D、A、B、C四种元素(其中一种是金属),它们的单质在通常情况下,A、B是固体。C2、D2是常见的双原子气体单质,另有X溶液和Y溶液。这些物质相互转化的关系如下图所示,图中G、I均为白色胶状沉淀,F是含B元素的盐。电解H的水溶液生成C2、D2和X溶液,这是一种重要的化工生产原理。
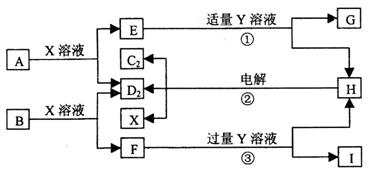
(1)X、Y的化学式分别为________、__________。
(2)l在受热灼烧后的最终产物属___________晶体。
(3)写出反应②的化学方程式:_____________________________________________。
(4)写出反应①、③的离子方程式:
反应①:________________________________________________________。
反应③:________________________________________________________。
四、计算题(10分)
23.已知C12和NO2在一定条件下可以化合成一种气态化合物A。为了测定A的组成进行如下实验:(不考虑2 NO2![]() N2O4的平衡)
N2O4的平衡)
(1)当C12与NO2混合气体以不同比例混合时,测得其平均式量分别为51和6l,分别求出C12在上述混合气体中的体积分数。
(2)取上述不同比例的混合气体各5L,在一定条件下充分反应后,气体体积均为4L,由此写出C12和NO2反应的化学方程式。
(3)设C12的体积分数为x(0<x<1),试讨论当x的取值范围不同时(C12与NO2的总体积为5L),反应后的总体积V随x变化的函数关系,将结果填入下表。
| x值 | V(反应后混合气体体积) |
参考答案
一、选择题(18×3=54分)
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 |
| 答案 | D | D | D | C | A | D | B | B | C | D | B | A | B | A | B | B | B | B |
二、实验题
19.(10分)
(1)①将石蕊试纸湿润 ②检验容量瓶是否漏水
(2)过量的CO2 CO2+Na![]() CO
CO![]() +H2O=2NaHCO3
+H2O=2NaHCO3
(3)氨水 Ag(NH3)2Cl
20.(10分)
(1)Mg Mg+2H2SO4浓===MgSO4+SO2↑+2H2O C中溶液变红
(2)2KMnO4+16HCl====2KCl+2MnSO4+5Cl2↑+8H2O 无变化
(3)浓氨水(或铵盐的浓溶液);酚酞试液;防止倒吸
三、推断题
21.(6分)
(1)第三周期 IA族 2NH3![]() NH4++NH2
NH4++NH2![]()
(2)NaOH,NH4NO3 C(NO3![]() )>C(NH4+)>C(Na+)>C(OH
)>C(NH4+)>C(Na+)>C(OH![]() )>C(H+)
)>C(H+)
22.(10分)
(1)NaOH HCl
(2)原子
(3)2NaCl+2H2O电解2NaOH+H2↑+Cl2↑
(4)①AlO2![]() +H
+H![]() +H2O====Al(OH)3↓
+H2O====Al(OH)3↓
③SiO32![]() +2H++H2O====H4SiO4↓
+2H++H2O====H4SiO4↓
四、计算题
23.(10分)
(1)20%、60%
(2)Cl2+2NO2====2NO2Cl
(3)
| x 值 | V(反应后混合气体体积) |
| 0<x< | V=5(1-x)L |
| x= | V= |
|
| V=2.5(1+x)L |