高三化学上学期期中调研测试
化 学 试 卷
本试卷分第一卷(选择题)和第二卷(非选择题)两部分。全卷满分150分,考试时间120分钟。
第一卷(选择题 共64分)
可能用到的相对原子质量:H 1 C 12 O 16 Na 23 Mg 24 Al 27 S 32
Cl 35.5 Cr 52 Fe 56 Cu 64 Ag 108 Hg 200.6
一、单项选择题(本题包括8小题,每小题4分,共32分。每小题只有一个选项符合题意)
1.2006年9月28日,中国科学家研制的“人造太阳”成功地进行了一次放电。所谓“人造太阳”是指受控核聚变。从1 L海水中提取出来的氘(![]() )受控核聚变成氦(
)受控核聚变成氦(![]() )时产生的能量相当于300 L汽油燃烧放出的能量。因此这种技术对解决能源问题有着十分广阔的发展前景。下列有关说法正确的是
)时产生的能量相当于300 L汽油燃烧放出的能量。因此这种技术对解决能源问题有着十分广阔的发展前景。下列有关说法正确的是
A.氘(![]() )受控核聚变成氦(
)受控核聚变成氦(![]() )是一种化学变化
)是一种化学变化
B.![]() 和
和![]() 互为同位素
互为同位素
C.符号![]() 中的“2”与符号
中的“2”与符号![]() 中的“2”意义不同
中的“2”意义不同
D.![]() 2和
2和![]() 2的物理性质、化学性质都存在着很大的差异
2的物理性质、化学性质都存在着很大的差异
2.锂和镁在元素周期表中有特殊“对角线”关系,它们的性质相似。下列有关锂及其化合
物叙述正确的是
A.Li2SO4难溶于水 B.Li与N2反应产物是Li3N
C.LiOH易溶于水 D.LiOH与Li2CO3受热都很难分解
3.在一定条件下,分别以高锰酸钾、氯酸钾、过氧化氢为原料制取氧气,当制得同温、同压下相同体积的氧气时,三个反应中转移的电子数之比为
A.1∶1∶1 B.2∶2∶1 C.2∶3∶1 D.4∶3∶1
4.某溶液中含有大量的Al3+、NH![]() 、Ag+、Fe2+四种离子。向该溶液中加入足量Na2O2,微
、Ag+、Fe2+四种离子。向该溶液中加入足量Na2O2,微
热并充分搅拌后,再加入过量稀盐酸,此时溶液中大量存在的阳离子可能是
A.H+、Na+、Al3+、Fe3+ B.Al3+、H+、Na+、Fe2+
C. H+、Na+、Al3+、NH![]() D.Fe3+、Ag+、Na+、H+
D.Fe3+、Ag+、Na+、H+
5.若某装置(电解池或原电池)中发生反应的离子方程式是:Cu+2H+=Cu2+ +H2↑。则该装置
A.可能是原电池,也可能是电解池
B.只能是原电池,且电解质溶液为硝酸
C.只能是电解池,且金属铜为该电解池的阳极
D.只能是电解池,电解质溶液可以是硝酸
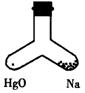 6.在右图支管中,一管装入2.3g金属钠,一管装入HgO,同时加热两部分,Na完全燃烧 ,若加热后容器里空气成分基本未变,则HgO质量可能是
6.在右图支管中,一管装入2.3g金属钠,一管装入HgO,同时加热两部分,Na完全燃烧 ,若加热后容器里空气成分基本未变,则HgO质量可能是
A.21.7g B.24g
C.43.4g D.10.85g
7.恒温下,将两个铂电极插入一定量的Na2SO4饱和溶液里进行电解,经过一段时间后,在阳极逸出n mol气体,同时从溶液中析出m g Na2SO4·10H2O晶体,则原Na2SO4溶液的质量分数为
A.![]() B.
B.![]()
C.![]() D.
D.![]()
![]()
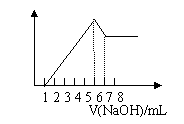 8.把镁铝合金用稀硫酸溶解,加入氢氧化钠溶液的体积与生成沉淀的质量关系如下图,则合金中镁和铝的质量比是
8.把镁铝合金用稀硫酸溶解,加入氢氧化钠溶液的体积与生成沉淀的质量关系如下图,则合金中镁和铝的质量比是
A.2∶3
B.4∶3
C.4∶9
D.8∶9
二、不定项选择题(本题包括8小题,每小题4分,共32分。每小题有一个或两个选项符合题意。若正确答案只包括一个选项,多选时,该小题为0分;若正确答案包括两个选项,只选一个且正确的给2分,选两个且都正确的给满分,但只要选错一个该小题就为0分)
9.一定量的的稀H2SO4与过量铁粉反应时,为减缓反应速率,且不影响生成H2的总量,可向稀H2SO4中加入
A.Na2SO4固体 B.NaOH固体 C.CH3COONa固体 D.NH4Cl饱和溶液
10.下列离子方程式正确的是
A.氢氧化铁溶于氢碘酸中:Fe(OH)3 + 3H+ = Fe3+ + 3H2O
B.Na2S溶液呈碱性:S2-+2H2O![]() H2S+2OH-
H2S+2OH-
C.澄清石灰水与少量小苏打溶液混合:Ca2+ + OH- + HCO3‑ ==CaCO3↓ + H2O
D.等体积等物质的量浓度的NaOH和NH4HSO4溶液混合:H+ + OH- = H2O
11.最新研究表明生命起源于火山爆发,是因为火山爆发产生的气体中含有1%的羰基硫(COS),已知羰基硫分子中所有原子的最外层都满足8电子结构,结合已学知识,可以得到的正确结论是
![]() A.羰基硫属于非极性分子
A.羰基硫属于非极性分子
B.羰基硫的电子式为:
C.羰基硫沸点比CO2低
D.羰基硫分子中三个原子处于同一直线上
12.四种主族元素的离子aXm+、bYn+、cZn-、dRm-(a、b、c、d为元素的原子序数),
它们具有相同的电子层结构,若m>n,则下列关系能够成立的是
A. 原子序数:a>b>c>d B. a-b=n-m
C.元素非金属性:Z<R D.最高价氧化物对应水化物的碱性:X>Y
13.设NA代表阿伏加德罗常数,下列说法正确的是
A.12.4 g白磷中含有P—P共价键个数为0.6 NA
B.100 mL pH = 2的盐酸与醋酸溶液中氢离子数均为2×10-3 NA
C.标准状况下,22.4 L氩气与22.4 L氟气所含质子数均为18 NA
D.1 L 0.1 mol/L Na2CO3溶液中CO32—和HCO3—总数为0.1 NA
14.可逆反应aX(g)+bY(g)![]() cZ(g)在一定温度下的一密闭容器内达到平衡后,t0时改变某一外界条件,化学反应速率(v)一时间(t)图象如右图。则下列说法中正确的是
cZ(g)在一定温度下的一密闭容器内达到平衡后,t0时改变某一外界条件,化学反应速率(v)一时间(t)图象如右图。则下列说法中正确的是
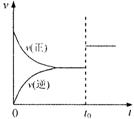 A.若a+b=c,则t0时只能是增大了容器的压强
A.若a+b=c,则t0时只能是增大了容器的压强
B.若a+b=c,则t0时只能是加入了催化剂
C.若a+b≠c,则t0时只能是加入了催化剂
D.若a+b≠c,则t0时只能是增大了容器的压强
15.微型钮扣电池在现代生活中有广泛应用。有一种银锌电池,其电极分别是Ag2O和Zn,电解质溶液为KOH,电极反应为:Zn+2OH―-2e-=ZnO+H2O ,Ag2O+H2O+2e-=2Ag+2OH-,总反应为:Ag2O+Zn=2Ag+ZnO。根据上述反应式,下列叙述中正确的是
A.在使用过程中,电池负极区溶液pH增大
B.在使用过程中,电流由Ag2O极经外电路流向Zn极
C.在使用过程中,Zn电极发生还原反应,Ag2O电极发生氧化反应
D.外电路中每通过0.2mol电子,正极的质量理论上减小1.6g
16.向一定量的Fe、FeO、Fe2O3的混合物中,加入100mL 1mol/L的盐酸,恰好使混合物完全溶解,放出224mL(S、T、P)的气体。所得溶液中加入KSCN溶液无血红色出现,混合物中铁元素的质量分数为
A.68.6% B.77.8% C.81.4% D.无法计算
第二卷(非选择题 共86分)
三、(本题包括2小题,共20分)
17.(10分) Ⅰ.探究有关物质氧化性的强弱。
Bi位于周期表中VA,+3价较稳定,NaBiO3溶液为无色。取一定量的Mn(NO3)2溶液依次进行实验,现象记录如下。
①滴加适量的NaBiO3溶液,溶液变为紫红色。
②继续滴加适量H2O2,紫红色褪去,并有气泡产生。
③再加入适量的PbO2固体,固体溶解,溶液又变为紫红色。
④最后通入足量的SO2气体。
请回答下列问题:
(1)推测实验④中的现象为 ▲ 。
(2)分析上述现象,KMnO4、H2O2、PbO2氧化性由强到弱的顺序为 ▲ 。
Ⅱ.探究镁、铝、铁金属单质还原性的强弱。
现有镁条、铝片、铝粉、铁钉、氧化镁、氧化铝、氧化铁、盐酸、稀硫酸、硝酸及其它常用的实验用品和仪器,根据现有药品,请你设计简单实验验证镁、铝、铁金属单质的还原性强弱。
依据你设计的实验方案,回答下列问题:
(3)实验原理:用化学方程式表示实验中的反应① ▲ 、② ▲ 、③ ▲ …
(4)实验现象:能够充分说明镁、铝、铁金属单质还原性强弱的明显现象是 ▲ 。
(5)实验结论:你得到的实验结论是 ▲ 。
18.(10分)实验室常用间接碘量法测定胆矾中铜含量。
实验原理
![]() 在弱酸性条件下,Cu2+与I—作用可生成I2,并被还原成白色的碘化亚铜沉淀;I2溶于过量的KI溶液中:I2+I— I3—,可用Na2S2O3标准溶液滴定,其反应为:2S2O32-+I3—=
S4O62—+3I—。
在弱酸性条件下,Cu2+与I—作用可生成I2,并被还原成白色的碘化亚铜沉淀;I2溶于过量的KI溶液中:I2+I— I3—,可用Na2S2O3标准溶液滴定,其反应为:2S2O32-+I3—=
S4O62—+3I—。
实验步骤
第一步:准确称取a g含少量 Fe2(SO4)3胆矾试样。
第二步:将试样置于250 mL碘量瓶(带磨口塞的锥形瓶)中,加50 mL蒸馏水、5 mL 3 mol/LH2SO4溶液,振荡,得到澄清、透明溶液。
第三步:向第二步得到的溶液中先加少量NaF溶液,再加入足量的10%KI溶液,摇匀。
第四步:盖上碘量瓶瓶盖,置于暗处5 min,充分反应后,加入淀粉溶液作指示剂。
第五步:将c mol/L Na2S2O3标准溶液装入滴定管。
第六步:滴定,当碘量瓶中溶液由蓝色变为无色且在半分钟内不再变化时,共用去V mL标准溶液。
资料卡片
氧化性:O2 >Fe3+>Cu2+>I2>FeF63-。
讨论下列问题:
(1)第三步操作中,“先加少量NaF溶液”的作用是 ▲ 。
(2)第四步加入淀粉溶液的体积是 ▲ 。
A.1~2 mL B.2~3 mL C.2~3滴
(3)第五步Na2S2O3标准溶液装入滴定管前的必要操作是 ▲ 。
(4)计算:根据本次实验结果,该胆矾试样中铜元素的质量分数ω(Cu)= ▲ 。
(5)实验中若用普通锥形瓶替代碘量瓶,测得胆矾试样中铜元素的质量分数为x(Cu),则x(Cu) ▲ ω(Cu) (填“大于”、“等于”或“小于”),你的理由是 ▲ 。
四、(本题包括2小题,共18分)
19.(8分) 元素周期表是20世纪科学技术发展的重要理论依据之一。
已知A、B、C、D、E五种元素都是元素周期表中前20号元素。A、B、C、D四种元素在课本元素周期表中的相对位置如下图所示,B、C、D的最高价氧化物的水化物两两混合,均能发生反应生成盐和水。E元素原子序数均大于A、B、C、D元素,且不与A、B、C、D元素位于同主族。
| …… | A | ||||||
| B | C | D |
根据以上信息,回答下列问题:
(1)元素C在元素周期表中的位置是 ▲ 周期 ▲ 族。
(2)A和D的氢化物中,沸点较低的是 ▲ (填“A”或“D”);A和B的离子中,半径较小的是 ▲ (填离子符号)。
 |
(3)A和E可组成离子化合物,其晶胞(在晶体中具有代表性的最小重复单元)结构如下图所示,阳离子位于该正方体的顶点或面心;阴离子均位于小正方体中心。该化合物的电子式为 ▲ 。
20.(10分) X通常存在于钢铁中,它是由两种常见元素组成的混合物。A、D、H、I、J常温下为气体,H、I、J为单质。反应①为氯碱工业的主要反应,反应③是制备理想绿色水处理剂Na2FeO4(高铁酸钠)的一种方法(图中部分生成物没有列出)。
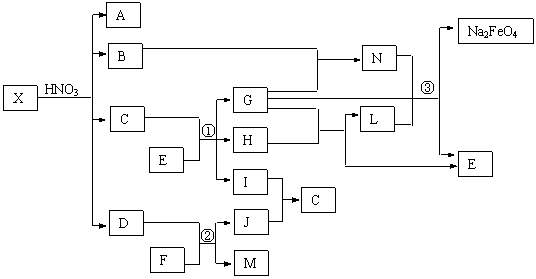 |
请依据上述物质之间关系回答下列问题:
⑴X中非金属元素的原子结构简图为 ▲ 。
⑵写出反应②的化学方程式 ▲ ;
反应③的离子方程式 ▲ 。
⑶若X是由组成元素相同的甲和乙的混合物,甲、乙均是由两种元素原子以最简整数比构成的化合物,其相对分子质量分别为124、180。现测得X中组成元素的质量之比为3∶35,则乙在X中的物质的量分数为 ▲ 。
五、(本题包括1小题,共12分)
21.(12分) 在人类社会的发展进程中,金属起着重要的作用。铝是国民经济发展的重要材料,目前我国铝消费超过430万吨,在众多的金属中仅次于钢铁。
经查阅,铝及其氧化物的有关实验数据如下:
| 熔点/℃ | 沸点/℃ | 燃烧热/kJ·mol-1 | |
| 铝 | 660 | 2467 | 602 |
| 氧化铝 | 2050 | 2980 | / |
(1) 铝是地壳中含量最多的金属元素,它占地壳总质量的7.51%,比铁几乎多1倍,是铜的近千倍。但人类发现和利用铝比较迟,你认为其主要原因是 ▲ 。
(2) 用坩埚夹住一小块铝箔(箔厚约0.1mm),在酒精灯上加热至熔化,轻轻晃动,观察到的现象是:铝箔熔化,失去了光泽,熔化的铝并不滴落,好像有一层膜兜着。铝箔“卷缩不脱落”是因为 ▲ 。
(3)将铝片插入硝酸汞溶液中,铝片表面灰暗,用湿布擦试后,铝片上附着了液态银白色的物质。将该铝片静置一段时间,铝片表面长出白色须状物,手持铝片时,白色须状物脱落,铝片发烫。经实验白色须状物能溶于稀盐酸且无气体放出。试写出直接导致铝片发烫的热化学反应方程式 ▲ 。
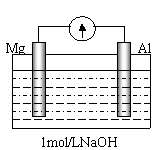 (4) 剪取大小、表面积相近的镁条和铝片,用砂纸打磨其表面,使镁条与铝片与电流计相连接后迅速插入盛有1mol/LNaOH溶液的烧杯中(如图)。预期的实验现象是:铝片溶解,镁片上有大量气泡放出。然而实验事实是:开始,铝片表面有许多气泡,随后,铝片表面气泡减少,镁条表面只有少量气泡产生,电流计显示电流方向与开始时相反。请写出后一过程镁片上的电极反应式 ▲ 。
(4) 剪取大小、表面积相近的镁条和铝片,用砂纸打磨其表面,使镁条与铝片与电流计相连接后迅速插入盛有1mol/LNaOH溶液的烧杯中(如图)。预期的实验现象是:铝片溶解,镁片上有大量气泡放出。然而实验事实是:开始,铝片表面有许多气泡,随后,铝片表面气泡减少,镁条表面只有少量气泡产生,电流计显示电流方向与开始时相反。请写出后一过程镁片上的电极反应式 ▲ 。
(5) 能源问题是人们关心的热点,有人提出用金属铝作燃料,这真是一种大胆而新颖的设想。对此,你的观点是 ▲ (填“A”或“B”),其理由是 ▲ 。
A.可行 B.不可行
六、(本题包括2小题,共18分)
22.(8分) 发射航天飞机的火箭常用氮的氢化物肼(N2H4)作燃料。试回答下列有关问题:
⑴在结构上N2H4和NH3的关系有如H2O2和H2O的关系。N2H4能发生下列反应:
![]()
![]() N2H4 + H3O+
N2H5+
+ H2O
N2H4 + H2O N2H5+ + OH-
N2H4 + H3O+
N2H5+
+ H2O
N2H4 + H2O N2H5+ + OH-
![]()
![]() N2H5+
+ H2O N2H62+ + OH- N2H5+
+ H2O N2H4 + H3O+
N2H5+
+ H2O N2H62+ + OH- N2H5+
+ H2O N2H4 + H3O+
据此你可得出的结论是 ▲ (填字母)。
A.肼水解显酸性 B.肼在水中电离出H+
C.肼是二元弱碱 D.肼是二元弱酸
⑵ 液态NH3类似H2O,也能微弱电离且产生电子数相同的两种离子,则液态NH3电离方程式为 ▲ 。
⑶ 25℃时,0.2 mol·L-1 氨水与0.2 mol·L-1HCl 溶液等体积混合(忽略混合后溶液体积的变化),测得混合溶液的pH=a(a<7)。则混合溶液中由水电离出的c(H+) ▲ (填“大于”、“等于”或“小于”) 0.2 mol·L-1HCl 溶液中电离出的c(H+);混合溶液中,c(H+)-c(NH3·H2O)= ▲ (用含有a的关系式表示)。
23.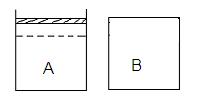 (10分)如右下图所示两个等体积的容器,A为恒压容器,B为恒容容器。在相同温度下,分别将1 mol N2 和3 mol H2 混合气体充入A、B容器中,发生如下反应:
(10分)如右下图所示两个等体积的容器,A为恒压容器,B为恒容容器。在相同温度下,分别将1 mol N2 和3 mol H2 混合气体充入A、B容器中,发生如下反应:
![]() N2(g)+3 H2
(g) 2NH3
(g); △H=-92.4 kJ/mol 。
N2(g)+3 H2
(g) 2NH3
(g); △H=-92.4 kJ/mol 。
保持温度不变,A、B容器中的反应均达到平衡状态。平衡时,A容器中气体体积为起始时的4/5,平衡状态记为P。
试回答下列问题:
(1) 平衡时A容器中NH3 的体积分数是 ▲ 。若要使B容器中NH3 的体积分数与 A容器中相同,可采取的措施是 ▲ 。
(2) 若保持温度不变,向B容器中补加c mol NH3 ,再次达到平衡时,A、B两容器中压强恰好相等,则c= ▲ 。
(3)若保持温度不变,开始时向容器A中加入a mol N2 、b mol H2和c mol NH3 ,要使反应向逆反应方向进行,且达到平衡后各气体的物质的量与原A平衡状态P相同,则起始时,c的取值范围是 ▲ 。
(4)若保持温度不变,开始时向容器B中加入a mol N2 、b mol H2 和 1 mol NH3 ,平衡时,测得放出的热量为23.1 kJ,NH3 的体积分数与A容器平衡状态P相同,则a + b 的值是 ▲ 。
七、(本题包括2小题,共18分)
24.(8分)合成氨的原料气N2和H2通常是以焦炭、水和空气为原料来制取的。造气的主要反应为:①2C+O2==2CO;②C+H2O(g)==CO+H2 。
(1) 1200 g 焦炭按①、②式完全反应时,生成标准状况下气体的体积V的范围
▲ m3。
(2) 现将焦炭、H2O(g)和空气混合完全反应,使生成的混合气体中[n(CO)+n(H2)]/ n(N2) =3,则混合气体中空气和H2O(g)的体积比为 ▲ (设空气中N2和O2的体积比为4∶1)。
(3) 为满足合成氨原料气的要求,使[n(CO)+n(H2)]/ n(N2) =3,且n(N2)/n(H2)=1,工业上采用焦炭与富氧空气和H2O(g)同时反应,则该富氧空气中O2的体积分数为多少?(假设某富氧空气仍只含O2和N2)
25.(10分)工业上为了处理含有Cr2O72-的酸性工业废水,采用下面的处理方法:往工业废水中加入适量的NaCl,以Fe为电极进行电解,控制一定条件,仅使Fe3+、Cr3+转化为沉淀,使废水中的铬含量达排放标准。现有1 L含有Cr2O72-的酸性工业废水,用上述方法处理后,在阴极上得到0.896 L(标准状况)气体,生成4.24 g 沉淀。
(1) Cr2O72-在酸性条件下与Fe2+ 发生氧化还原反应,生成Cr3+和Fe3+ 。写出该氧化还原反应的离子方程式 ▲ 。
(2)通过计算,确定处理后的废水中是否存在Cr2O72-。
(3)原工业废水中铬的含量是多少(g/L)?
试卷参考答案及评分标准
1.C 2.B 3.B 4.A 5.C 6.A 7.B 8.D
9.C 10.CD 11.BD 12.A 13.AC 14.C 15.BD 16.C
17.(1) 紫红色褪去,生成白色沉淀 (2) PbO2>KMnO4>H2O2
![]() (3)Mg +2HCl
=MgCl2 + H2 ↑ 2 Al +6HCl =2AlCl3 +3H2
↑
(3)Mg +2HCl
=MgCl2 + H2 ↑ 2 Al +6HCl =2AlCl3 +3H2
↑
2 Al +Fe2O3 2Fe +Al2O3
(4)镁条、铝片分别与盐酸反应时,镁条与盐酸反应剧烈;铝热反应中有熔融物铁珠落下
(5) 镁、铝、铁金属单质还原性由强到弱的顺序为镁、铝、铁
(每空2分,共10分,其它合理答案参照给分)
18.(1) 与Fe3+形成FeF63-,防止Fe3+氧化I—而影响Cu2+量的测定(2分)
(2) C (1分)
(3)检查滴定管是否漏水,用蒸馏水洗净滴定管后再用Na2S2O3标准溶液润洗2~3次 (2分)
(4) ![]() (3分)
(3分)
(5)大于 普通锥形瓶会使空气进入锥形瓶氧化I—,增加I2的量,使V偏大,测定结果偏大(2分)
19.(1)第三 ⅢA (2分)
(2) D (2分) Na+ (2分)
(3) (2分)
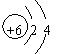 |
20.⑴ (2分)
⑵2Na2O2 +2CO2 =2Na2CO3 +O2 ↑ (3分)
2Fe(OH)3 +3ClO- + 4OH- = 2FeO42- +3Cl-+5H2O (3分)
⑶50% (2分)
21.(1) 铝是比较活泼的金属,冶炼困难 (2分)
![]() (2)铝表面的氧化膜熔点比铝高,包在铝的外面,熔化了的液态铝不会滴落 (2分)
(2)铝表面的氧化膜熔点比铝高,包在铝的外面,熔化了的液态铝不会滴落 (2分)
(3) 4A1(s)+3O2(g) 2A12O3(s); △H=-2408 kJ/mol (3分)
(4) O2+2H2O+4e-= 4OH― (3分)
(5) A,铝跟氧气或空气在一定条件下燃烧时,会放出大量的热,若合理利用,作为一种能源是可能的;B,铝的性质活泼,冶炼铝需要消耗大量的电能,还要消耗铝的矿产资源等(其它合理答案参照给分)(2分)
![]() 22.(1)C (2) 2NH3
NH4+ + NH2
22.(1)C (2) 2NH3
NH4+ + NH2
(3)大于 1×10a-14 (每空2分,共8分)
23.(1)25% (2分) 增加N2、H2或降低温度 (2分) (2) 0.5 (2分)
(3) 0.8<c≦2 (2分) (4) 5.5 (2分)
24.(1)2.24 <V<4.48 (2分) (2) 1∶1(3分)
(3)设该富氧空气中 n(N2)= 1.00 mol 则生成的混合气体中n(CO)+n(H2)=3.00 mol
n(N2)/n(H2)=1 n(H2)=1.00 mol
根据反应C+H2O(g)==CO+H2 ,生成1.00mol H2 同时生成 1.00 mol CO
根据反应2C+O2==2CO,还需生成的1.00 mol CO,需要n(O2)=0.500 mol
该富氧空气中O2的体积分数为=33.3% (3分)
25.(1) Cr2O72-+6Fe2++14H+ =2Cr3++6Fe3++7H2O (3分)
(2)阴极:2H+ + 2e- =H2 ↑ 阳极:Fe -2 e-=Fe2+
Fe2+ ~H2 n(Fe2+)=n(H2)=0.896 L/22.4 L·mol-1 = 0.04 mol
若0.04 mol Fe2+ 全部转化为Fe(OH)3 ,沉淀的质量至少为4.28 g,大于4.24 g
废水中Fe2+剩余,CrO72-全部被转化为Cr3+.(3分)
设 沉淀中Cr(OH)3 的物质的量为x ,Fe(OH)3 的物质的量为 y
103 g/mol x +107 g/mol ×3 x =4.24 g x=0.01 mol
废水中铬的含量为 =0.52 g/L (4分)