高三化学上学期模拟训练题
模拟训练一
(本试题分为ⅠⅡ两卷,共150分。考试时间为120分钟。)
第Ⅰ卷(选择题 共60分)
相对原子质量:H-1 B-10.8 C-12 N-14 O-16 Na-23 K-39 S-32 Mg-24
Ba-137 Al-27 Fe-56 Ca-40 Cl-35.5 Mn-55 V—51
一、选择题(本题包括6小题,每小题4分,共24分。每小题只有一个选项符合题意)
1.下列化学反应ΔH的数值(放热)最大的是 ( )
A.NaOH(aq)+HCl(aq)=NaCl(aq )+H2O(l);△H1
B. NaOH(aq)+![]() H2SO4(aq)=
H2SO4(aq)=![]() Na2SO4(aq)+H2O(l);△H2
Na2SO4(aq)+H2O(l);△H2
C.CH3COOH(aq)+NaOH(aq)=CH3COONa (aq )+H2O(l);△H3
D.NaOH(aq)+![]() H2SO4(浓)=
H2SO4(浓)=![]() Na2SO4(aq)+H2O(l);△H4
Na2SO4(aq)+H2O(l);△H4
![]() 2.下列各组表达式表示意义相同的是 ( )
2.下列各组表达式表示意义相同的是 ( )
A.-NO2 NO2 B.-OH
C.CH3CH2OH CH3OCH3 D.HCOOCH2 HOOCCH3
3.以下是几位同学在学习了速率和平衡理论以后发表的一些看法,其中不正确的是( )
A.化学反应速率理论可指导怎样在一定时间内快出产品
B.化学平衡理论可指导怎样使用有限原料多出产品
C.化学反应速率理论可指导怎样提高原料的转化率
D.正确利用化学反应速率和化学平衡理论可提高化工生产的综合经济效益
4.同温同压下,等体积的两容器内分别充满由14N、13C、18O三种原子构成的一氧化氮和一氧化碳。下列说法正确的是 ( )
A.含有相同数目的中子、原子和分子 B.含有相同的分子数和电子数
C.含有相同的质子数和中子数 D.所含分子数和质量均不相同
5.下图分别表示四种操作,其中有两个错误的是 ( )
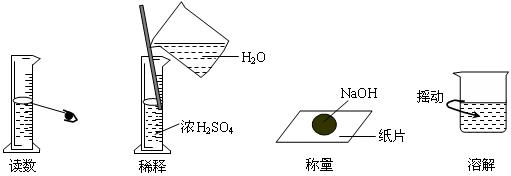
A B C D
6.在一定温度下,一定体积的密闭容器中有如下平衡:H2(g)+I2(g)![]() 2HI(g);已知H2和I2的起始浓度均为0.1mol·L-1时,达平衡时HI的浓度为0.16mol·L-1。若H2和I2的起始浓度均变为0.3mol·L-1,则平衡时H2的浓度是 ( )
2HI(g);已知H2和I2的起始浓度均为0.1mol·L-1时,达平衡时HI的浓度为0.16mol·L-1。若H2和I2的起始浓度均变为0.3mol·L-1,则平衡时H2的浓度是 ( )
A.0.16mol·L-1 B.0.06mol·L-1 C.0.04 mol·L-1 D.0.08mol·L-1
二、选择题(本题包括9小题,每小题4分,共36分。每小题有一个或两个选项符合题意。若正确答案只包括一个选项,多选时,该题为0分;若正确答案包括两个选项,只选一个且正确的得2分,选两个且都正确的得满分,但只要选错一个,该小题就为0分)
7.设NA表示阿伏加德罗常数,下列说法正确的是 ( )
A.硅晶体中,有NA个Si就有2NA个Si—Si键
B.同温、同压下,相同体积的氟气和氩气所含的原子数相等
C.标准状况下,11.2L以任意比例混合的氮气和氧气所含的原子数为NA
D.在含2molH2SO4的浓H2SO4溶液中加入足量的Zn粉,使其充分反应,则反应结束时转移电子数共4NA
8.下列反应的离子方程式错误的是 ( )
A.等物质的量的Ba(OH)2与NH4HSO4在稀溶液中反应:
Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O
B.向溴化亚铁溶液中通入过量的氯气:Fe2++2Br-+2Cl2=Fe3++Br2+4Cl-
C.少量的CO2通入碳酸钠溶液中:CO2+CO32-+H2O=2HCO3-
D.苯酚钠溶于醋酸溶液:C6H5O-+CH3COOH→C6H5OH+CH3COO-
9.混合下列各组物质使之充分反应,加热蒸干产物并在300℃灼烧至质量不变,最终残留固体为纯净物的是 ( )
A.向亚硫酸钠溶液中滴加过量的溴水
B.将物质的量浓度相等的KAl(SO4)2与Ba(OH)2溶液以体积比1∶2混合
C.等体积、等物质的量浓度的碳酸钠与氢氧化钡溶液混合
D.在NaBr溶液中通入过量氟气
10.第ⅠA碱金属元素与ⅦA元素所形成的化合物具有的性质是 ( )
A.当化合物溶于水后,电解其溶液难以得到金属单质
B.熔融状态不导电
C.化合物在固态时为离子晶体,晶体中阴、阳离子排列方式相同
D.化合物NaCl、KCl、RbCl、CsCl熔点依次升高
11.经测定,某溶液中只含有NH4+、Cl-、H+、OH-四种离子,下列说法中错误的是( )
A.溶液中四种离子之间可能满足:c(Cl-)>c(H+)>c(NH4+)>c(OH-)
B.若溶液中的溶质是NH4Cl和NH3·H2O,则不等式c(NH4+)>c(Cl-)>c(NH3·H2O)>c(H+)可能正确
C.若溶液中四种离子满足:c(Cl-)>c(NH4+)>c(H+)>c(OH-),则溶液中的溶质一定只有NH4Cl
D.若溶液中c(Cl-)=c(NH4+),则该溶液呈中性
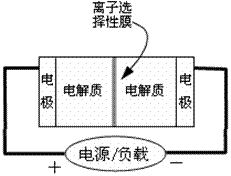 12.下图是一种正在投入生产的大型蓄电系统的原理图。电池中的左右两侧为电极,中间为离子选择性膜,在电池放电和充电时该膜只允许钠离子通过。电池充、放电的化学反应方程式为:
12.下图是一种正在投入生产的大型蓄电系统的原理图。电池中的左右两侧为电极,中间为离子选择性膜,在电池放电和充电时该膜只允许钠离子通过。电池充、放电的化学反应方程式为:
![]()
![]()
下列关于此电池说法正确的是 ( )
A.放电过程中钠离子从右到左通过离子交换膜
B.充电过程中钠离子从右到左通过离子交换膜
C.电池放电时,负极反应为:3NaBr-2e-=NaBr3+2Na+
D.充电的过程中当0.1molNa+通过离子交换膜时,导线通过0.1mol电子
13.常温下,将0.1mol·L-1盐酸和0.06mol·L-1氢氧化钡溶液等体积混合后,该混合溶液的pH是 ( )
A.1.7 B.12.3 C.12 D.2
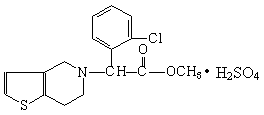 14.波立维是国家刚刚引进的新药,它给中风、心肌梗死等心脏病患者带来福音。波立维属于硫酸氢盐,它的结构如图所示。下列关于它的说法正确的是 ( )
14.波立维是国家刚刚引进的新药,它给中风、心肌梗死等心脏病患者带来福音。波立维属于硫酸氢盐,它的结构如图所示。下列关于它的说法正确的是 ( )
A.该物质的化学式为C16H15ClSNO2·H2SO4
B.该物质可以溶于水
C.波立维能形成硫酸氢盐是与其结构中的氮原子有关
D.它可以与NaOH溶液反应,1mol该物质最多可消耗2molNaOH
15.一定条件下将质量为Xg的有机物在O2中完全燃烧,燃烧后全部产物通过足量Na2O2层,过氧化钠的质量增重Yg,下列对应关系一定正确的是 ( )
| 序号 | 有机物 | X | Y |
| A | C2H4 | m | 15m/7 |
| B | HCOOH | m | 15m/23 |
| C | CH3OH和CH3COOH的混合物 | m | 2m/3 |
| D | HCOOH与CH3COOCH3的混合物 | m | m |
第Ⅱ卷(非选择题 共90分)
三、(本题包括2小题,共22分)
16.(8分)⑴下列四种实验装置(根据需要可在其中加入液体或固体)
①能用于干燥二氧化硫气体的装置有________(填字母)。
②装置B除可用于制取CO2、H2,还可制取_________、_______。(写出两种物质的化学式)。
③既能用于收集氯气又能用于收集一氧化氮气体的装置有__________。(填字母)
 | |||||||
 | |||||||
 | |||||||
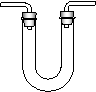 | |||||||
A B C D
⑵下列实验操作或实验事实的叙述不正确的是______________(填序号)。
A.过滤、蒸发操作过程中都需要用玻璃棒不断搅拌液体。
B.在试管中放入几片碎滤纸片,加入几滴90%的浓硫酸,捣成糊状,微热并冷却后,先滴入几滴CuSO4溶液,再加入过量的NaOH溶液中和至出现Cu(OH)2沉淀。加热至沸腾,可观察到红色沉淀生成。
C.制备硫酸亚铁晶体时,向废铁屑中加入过量稀硫酸,充分反应后,过滤,然后加热蒸干滤液即可得硫酸亚铁晶体
D.测定硫酸铜晶体结晶水含量的实验中,称量操作至少要进行4次。
17.(14分)我国化工专家侯德榜的“侯氏制碱法”曾为世界制碱工业做出了突出贡献。
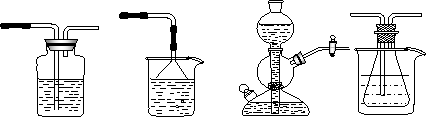 他利用NaHCO3、NaCl、NH4Cl等物质溶解度的差异,以食盐、氨气、二氧化碳等为原料制得NaHCO3,进而生产出纯碱。以下A、B、C、D四个装置可组装成实验室模拟“侯氏制碱法”制取NaHCO3的实验装置。装置中分别盛有以下试剂:B:稀硫酸C:盐酸、碳酸钙D:含氨的饱和食盐水、水
他利用NaHCO3、NaCl、NH4Cl等物质溶解度的差异,以食盐、氨气、二氧化碳等为原料制得NaHCO3,进而生产出纯碱。以下A、B、C、D四个装置可组装成实验室模拟“侯氏制碱法”制取NaHCO3的实验装置。装置中分别盛有以下试剂:B:稀硫酸C:盐酸、碳酸钙D:含氨的饱和食盐水、水
A B C D
四种盐在不同温度下的溶解度(g/100g水)表
|
| 0℃ | 10℃ | 20℃ | 30℃ | 40℃ | 50℃ | 60℃ | 100℃ | ||||
| NaCl | 35.7 | 35.8 | 36.0 | 36.3 | 36.6 | 37.0 | 37.3 | 39.8 | ||||
| NH4HCO3 | 11.9 | 15.8 | 21.0 | 27.0 | —① | — | — | — | ||||
| NaHCO3 | 6.9 | 8.1 | 9.6 | 11.1 | 12.7 | 14.5 | 16.4 | — | ||||
| NH4Cl | 29.4 | 33.3 | 37.2 | 41.4 | 45.8 | 50.4 | 55.3 | 77.3 |
(说明:①>35℃NH4HCO3会有分解)
请回答以下问题:⑴装置的连接顺序应是_______________(填字母)。
⑵A装置中盛放的试剂是_____________________,其作用是_____________________。
⑶在实验过程中,需要控制D温度在30℃~35℃,原因是_____________________________ ________________________。为了便于控制此温度范围,采取的加热方法为___________。
⑷反应结束后,将锥形瓶浸在冷水中,析出NaHCO3晶体的原因是_____________________。用蒸馏水洗涤NaHCO3晶体的目的是除去_______________________杂质(以化学式表示)
⑸将锥形瓶中的产物过滤后,所得的母液中含有______________________________(以化学式表示),可加入氯化氢,并进行___________操作,使NaCl溶液循环使用,同时可回收NH4Cl。
⑹测试纯碱产品中NaHCO3含量的方法是:准确称取纯碱样品Wg,放入锥形瓶中加蒸馏水溶解,加1~2滴酚酞指示剂,用物质的量浓度为c(mol/L)的HCl溶液滴定至溶液由红色到无色(指示CO32―+H+=HCO3―反应的终点),所用HCl溶液体积为V1 mL,再加1~2滴甲基橙指示剂,继续用HCl溶液滴定溶液由黄变橙,所用HCl溶液体积为V2 mL。写出纯碱样品中NaHCO3质量分数的计算式:NaHCO3(%)=______________。
四、(本题包括3小题,共32分)
18.(8分)随着材料科学的发展,金属钒及其化合物得到了越来越广泛的应用,并被誉为“合金维生素”。已知钒的原子序数为23,回答下列问题:
⑴钒被认为是一种稀土元素,广泛分散于各种矿物中,钾钒铀矿中的化学式为K2H6U2V2O15(其中钒元素的化合价为+5价)。若用氧化物的形式表示,该化合物的化学式为______。
⑵测定钒含量的方法是先把钒转化成V2O5,V2O5在酸性溶液里转变成VO2+,再用盐酸、硫酸亚铁、草酸等测定钒。请配平下列反应的化学方程式。
___VO2++____H2C2O4→___VO++___CO2+___H2O
其中还原剂是____;若反应消耗0.9g草酸,参加反应的钒元素质量是____g。
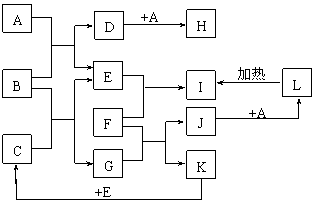 19.(10分)如下图所示,各物质间存在如下相互转化关系,其中F为常见的金属,高温下与某些金属氧化物反应,是工业冶炼金属的方法之一。A为无色气体,B为淡黄色固体,C为无色液体。E和K为无色气体单质,其它物质均为化合物。
19.(10分)如下图所示,各物质间存在如下相互转化关系,其中F为常见的金属,高温下与某些金属氧化物反应,是工业冶炼金属的方法之一。A为无色气体,B为淡黄色固体,C为无色液体。E和K为无色气体单质,其它物质均为化合物。
试回答下列问题:
⑴写出下列物质的化学式:A:__________ F:___________
⑵写出G的电子式________________;A属于__________(填“极性”或“非极性”)分子。
⑶写出J→L的离子反应方程式__________________________________________。
20.(14分)有A、B、C、D、E、F六种元素,已知:它们位于三个不同短周期,核电荷数依次增大;A与E、B与F分别同主族;A、E分别都能与D按原子个数比1﹕1或2﹕l形成化合物;B、C分别都能与D按原子个数比1﹕1或1﹕2形成化合物。
⑴写出只含有A、B、D、E四种元素的两种无水盐的化学式 、 。
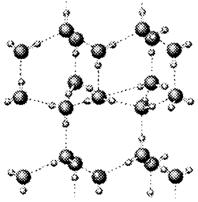 ⑵右图是A与D形成的一种化合物的晶体结构示意图,其中的虚线表示
,与每个“构成粒子”相邻的粒子呈
空间构型。E与D按原子个数比1﹕1形成的化合物的电子式为
。
⑵右图是A与D形成的一种化合物的晶体结构示意图,其中的虚线表示
,与每个“构成粒子”相邻的粒子呈
空间构型。E与D按原子个数比1﹕1形成的化合物的电子式为
。
⑶人们通常把拆开l mol某化学键所吸收的能量看成该化学键的键能。键能的大小可以衡量化学键的强弱,也可以用于估算化学反应的反应热(△H),化学反应的△H等于反应中断裂旧化学键的键能之和与反应中形成新化学键的键能之和的差。下表列出了上述部分元素形成的化学键的键能:
| 化学键 | F—D | F—F | B—B | F—B | C═D | D═D |
| 键能/kJ·mol-1 | 460 | 176 | 347.7 | 347 | 745 | 497.3 |
①下列三种物质形成的晶体,熔点由高到低的顺序(用a、b、c表示):
a.F与B形成的化合物 b.B与D形成的稳定化合物 c.F的单质
②试估算F单质晶体的燃烧热: 。
五、(本题包括2小题,共18分)
21.(8分)现有饱和一元醇的混合物和饱和一元羧酸的混合物在一定条件下反应生成多种酯的混合物,酯的相对分子质量分别为M1,M2,M3,并依次增加14。经分析,相对分子质量为M2的酯,其氧元素所占的质量分数为31.4%,并有三种酯的同分异构体。请回答:
⑴相对分子质量为M2的酯的化学式为________________。
⑵饱和一元羧酸的化学式分别为_________________,__________________。
⑶参加反应的醇结构简式为
_____________、_____________、_________________、______________(不必填满)。
⑷与相对分子质量为M1的酯互为同分异构体,能发生银镜反应、能与金属钠反应产生氢气的有机物的同分异构体有_____种。
22.(10分)三十烷醇是一种优良的植物生长调节剂,有促进种子萌芽,促进植物根系发育和叶绿素的合成等多种功能。工业上以十二二酸为原料合成三十烷醇的过程如下:
|
|
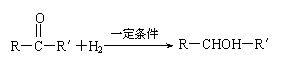
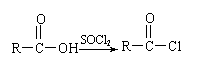
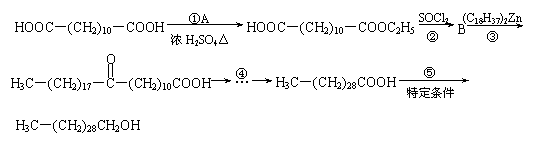

已知:
请回答下列问题:
⑴B物质的结构简式________。
⑵写出转化①的化学方程式________________________________________________________;反应类型是___________。
⑶若转化④是通过若干个反应完成的,请设计由C→D的转化途径(用化学方程式表示):
六、(本题包括2小题,共18分)
23.(6分)将一块金属钠投入到100mLMgCl2和AlCl3的混合溶液中,发现沉淀先多后少。反应完毕后收集到13.44L气体(标准状况下),同时得到21.4g白色沉淀,将此沉淀溶于过量的NaOH溶液中,充分反应后沉淀质量减轻了15.6g。求原溶液中Mg2+、Al3+的物质的量浓度。
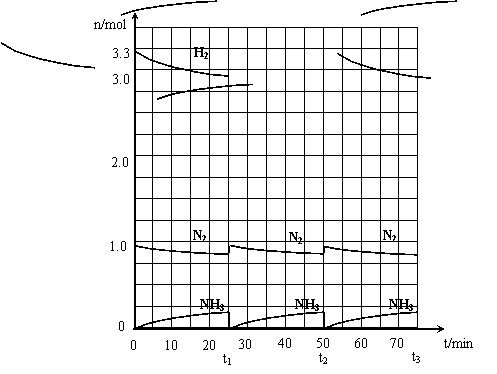
24.(12分)在实验室中进行合成氨工业的模拟实验,当反应进行一段时间,并建立相应的平衡以后,及时分离出氨并补充与起始原料比相同的氮气和氢气,以实现连续的生产过程,在1L的密封容器中,在一定条件下发生如下反应。
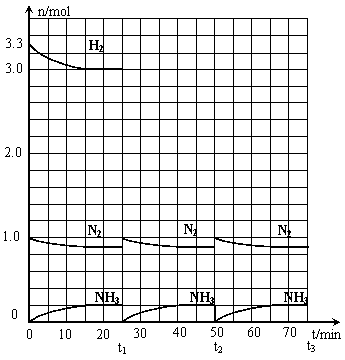 N2(g)+3H2(g)
N2(g)+3H2(g)![]() 2NH3(g);ΔH<0
2NH3(g);ΔH<0
请根据图示回答下列问题:
⑴反应起始时,氮气与氢气的物质的量之比
n(N2)∶n(H2)=_____∶_____。
在15分钟时合成氨反应第一次达到平衡,其间以H2的浓度变化所表示的平均化学反应速率为
______________________。
⑵在t1时,曲线发生变化的原因是___________________________、____________________________。
请计算氢气在t1起点时的坐标(______,______)以及在t2平衡时的坐标(_______,________)。并在图中画出在t1~t2之间氢气的物质的量变化曲线。
⑶为达到图示中t2的平衡状态,在t1~t2之间需要采取的措施是_____________。
a.扩大容器的体积 b.升高温度 c.降低温度 d.缩小容器的体积
⑷经历十次上述的循环过程,计算在t11达到平衡时,N2和H2的物质的量之比n(N2)∶n(H2)=____∶____,整个过程中N2和H2的总转化率之比a(N2)∶a(H2)=____∶____。
⑸根据以上计算结果,请你建议合成氨反应的最佳原料比是:n(N2):n(H2)=______。
高三化学模拟训练一参考答案
一、1.D 2.B 3.C 4.A 5.B 6.B
二、7.AC 8.AB 9.AD 10.A 11.C 12.AD 13.C 14.BC 15.AB
三、(本题包括2小题,共22分)
16.⑴①AD (2分) ②O2、C2H2、NO、NO2选填两个(2分,答对一个给1分,写名称不给分,其他合理答案也给分(如NH3、HCl、H2S、SO2、Cl2) ③AC(2分)(答对一个给1分)
⑵AC(每个1分,每选错一个倒扣1分,扣完为止,本大题均按此评价)
17.⑴CADB(2分) ⑵饱和NaHCO3溶液(1分) 除去CO2中的HCl(1分)
⑶温度超过35℃,碳酸氢铵开始分解,温度太低,反应速率降低,不利于反应进行(2分)
水浴加热(1分) ⑷NaHCO3的溶解度最小(1分) NaCl、NH4Cl、NH4HCO3(1分)
⑸NaHCO3、NaCl、NH4Cl、NH4HCO3 (2分) 结晶(1分) ⑹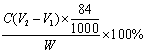 (2分)
(2分)
四、(本题包括3小题,共32分)
18.⑴K2O·V2O5·2UO3·3H2O(2分)(不必考虑物质的排列顺序)
⑵1、1、1、2、1(2分) H2C2O4(2分) 0.51(2分)
19.⑴CO2 (2分) Al(2分)
⑵![]() (2分) 非极性(2分)
(2分) 非极性(2分)
⑶AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-(2分)或2AlO2-+CO2+3H2O=2Al(OH)3↓+CO32-
20.⑴NaHCO3 CH3COONa (或其它有机酸的盐) ⑵氢键 正四面体 Na+[![]() ]2-Na+ ⑶①acb ②990.7kJ/mol (每空2分)
]2-Na+ ⑶①acb ②990.7kJ/mol (每空2分)
五、(本题包括2小题,共18分)
21.⑴C5H10O2 (1分) ⑵C2H4O2和C3H6O2(2分) ⑶CH3CH2CH2OH、CH3CH(OH)CH3、CH3CH2OH(3分) ⑷5种
22.⑴
|
⑶①CH3(CH2)17CO(CH2)10COOH+H2![]() CH3(CH2)17CH(OH)(CH2)10COOH
CH3(CH2)17CH(OH)(CH2)10COOH
②CH3(CH2)17CH(OH)(CH2)10COOH![]() CH3(CH2)16-CH=CH-(CH2)10COOH+H2O
CH3(CH2)16-CH=CH-(CH2)10COOH+H2O
(或CH3(CH2)17CH(OH)(CH2)10COOH![]() CH3(CH2)17-CH=CH-(CH2)9COOH+H2O)
CH3(CH2)17-CH=CH-(CH2)9COOH+H2O)
③CH3(CH2)16-CH=CH-(CH2)10COOH+H2![]() CH3(CH2)28COOH
CH3(CH2)28COOH
(三步各2分,共6分)
六、(本题包括2小题,共18分)
23.(6分)1mol·L-1(3分) 3mol·L-1(3分)
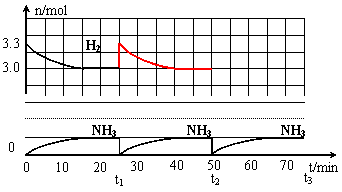 24.⑴1∶3.3,0.02 mol/(L·min)(各1分);⑵分离氨气、补充物质的量之比为n(N2)∶n(H2)=1∶3.3的氮气和氢气(1分) (25,3.33) (1分) (50,3.03) (1分) ⑶a、b (1分)
24.⑴1∶3.3,0.02 mol/(L·min)(各1分);⑵分离氨气、补充物质的量之比为n(N2)∶n(H2)=1∶3.3的氮气和氢气(1分) (25,3.33) (1分) (50,3.03) (1分) ⑶a、b (1分)
⑷n(N2)∶n(H2)=3∶11 (1分)
a(N2)∶a(H2)=11∶10 (1分)
⑸n(N2)∶n(H2)=1∶3 (2分)
图像如右
 | ||||||