高三12月份化学月考试题
本试卷分第一卷和第二卷两部分,共150分。考试时间120分钟。
第一卷(选择题,共72分)
一、选择题(本题包括8小题,每题4分共32分。每小题只有一个选项符合题意。)
1.下列变化过程属化学变化的是
A.石墨![]() 金刚石 B.
金刚石 B.![]() C+
C+![]() H→
H→![]() N+γ
N+γ
C.原油![]() 汽油+…… D.碘的升华
汽油+…… D.碘的升华
2.设NA表示阿伏加德罗常数的值,下列说法正确的是
A.1 mol NaHSO4晶体中离子总数为3NA
B.7.1g Cl2与足量NaOH(aq)反应时转移的电子总数为0.2 NA
C.1 L1 mol·L-1的Na2CO3(aq)中CO32-与HCO3-的离子数之和为NA
D.3.2gS在足量的氧气中完全燃烧所转移的电子总数为0.4NA
3.下列离子在溶液中能大量共存,加入(NH4)2Fe(SO4)2·6H2O晶体后,仍能大量共存的是 ( )
A.Na+ 、H+ 、Cl- 、NO3- B.K+ 、Ba+ 、OH- 、I-
C.Na+、 Mg2+ 、Cl- 、SO42- D.Cu2+ 、 S2- 、Br- 、ClO-
4.下列说法正确的是
A.H与D,16O与18O互为同位素;H216O、D216O、H218O、D218O互为同素异形体;甲醇、乙二醇和丙三醇互为同系物
B.在1mol石墨晶体中,C原子数与化学键数之比为1:2
C.HI的相对分子质量大于HF,所以HI的沸点高于HF
D.由IA族和VIA族元素形成的原子个数比为1:1、电子总数为38的化合物,是含有共价键的离子型化合物
5.某一密闭绝热容器中盛有饱和Ca(OH)2溶液,当加入少量CaO粉末,下列说法正确的是
①有晶体析出 ②c[Ca(OH)2]增大 ③pH不变 ④c(H+)c(OH-)的积不变
⑤c(H+)一定增大
A ① B ①③ C ①②④ D ①⑤
6.实验是研究化学的基础,下图中所示的实验方法、装置或操作完全正确的是
A.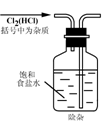 B.
B.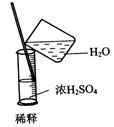
C.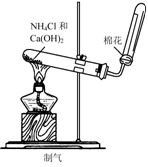 D.
D.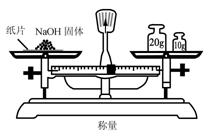
7.北京大学和中国科学院的化学工作者合作已成功研制出碱金属与C60形成的球碳盐K3C60,实验测知该物质属于离子晶体,且有良好的超导性,下列K3C60的组成和结构的分析正确的是
A.K3C60中既有离子键 ,又有极性键
B.1molK3C60中含有的离子数目为63×6.02×1023
C.该晶体熔融状态下能导电 D.该物质的化学式可定为KC20
8.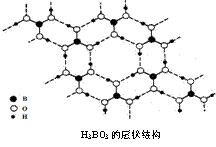 正硼酸(H3BO3)是一种片层状结构白色晶体,层内的H3BO3分子通过氢键相连(如下图)。下列有关说法正确的是:
正硼酸(H3BO3)是一种片层状结构白色晶体,层内的H3BO3分子通过氢键相连(如下图)。下列有关说法正确的是:
A.正硼酸晶体属于原子晶体
B.H3BO3分子的稳定性与氢键有关
C.分子中硼原子最外层为8e-稳定结构
D.含1molH3BO3的晶体中有3mol氢键
二、选择题(本题包括10小题,每小题4分,共40分。每小题有一个或两个选项符合题意。若正确答案只包括一个选项,多选时,该小题为0分;若正确答案包括两个选项,只选一个且正确的得2分,选两个且都正确的得满分,但只要选错一个,该小题就为0分)
9.恒温下的下列实验过程中,有关溶液的浓度和质量始终不变的
A.向浓氨水中持续通入干燥洁净的空气(不含CO2)
B.向KNO3饱和溶液中加入ngKNO3晶体 C.向98.3%浓H2SO4中加入ngSO3
D.向CuSO4饱和溶液中加入ng无水CuSO4
10.500mL KNO3和Cu(N03)2的混合溶液中c(NO3-)=6.0 mol·L-1,用石墨作电极电解此溶液,当通电一段时间后,两极均收集到22.4 L气体(标准状况),假定电解后溶液体积仍为500 mL,下列说法正确的是
A.原混合溶液中c(K+)为2 mol·L-1 B.上述电解过程中共转移4 mol电子
C.电解得到的Cu的物质的量为0.5 mol D.电解后溶液中c(H+)为2 mol·L-1
11.某酸的酸式盐NaHY在水溶液中,HY-的电离程度小于HY-的水解程度。有关的叙述中,正确的是
A .H2Y在电离时为:H2Y+H2O![]() HY-+H3O+
HY-+H3O+
B .在NaHY的溶液中,离子浓度为:c(Na+)>c(Y2-)>c(HY-)>c(OH-)>c(H+)
C.在Na2Y的溶液中,离子浓度为:c(Na+)>c(Y2-) >c(OH-)>c(HY-)>c(H+)
D. HY-的水解方程式为:HY-+ H2O![]() H3O++Y2-
H3O++Y2-
12.硝苯地平缓释片(Nifedipine Sustained Release Tablets)用于治疗各种类型的高血压及心绞痛,其结构式如右图所示:
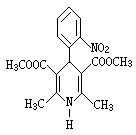 下列关于硝苯地平缓释片的说法正确的是
下列关于硝苯地平缓释片的说法正确的是
A.硝苯地平缓释片的分子式为C17H17N2O6
B.1mol硝苯地平缓释片在水溶液中最多能消耗4molNaOH
C.1mol硝苯地平缓释片在一定条件下能和5molH2发生加成反应
D.硝苯地平缓释片中N的化合价为-3
13.蛇纹石由MgO、A12O3、Si02、Fe203组成。现取一份蛇纹石试样进行实验,首先将其溶于过量的盐酸,过滤后,在所得的沉淀X和溶液Y中分别加入NaOH溶液至过量。下列叙述不正确的是
A.沉淀X的成分是Si02
B.将蛇纹石试样直接溶于过量的NaOH溶液后过滤,可得到红色颜料Fe2O3,
C.在溶液Y中加入过量的NaOH溶液,过滤,得到的沉淀的主要成分是Fe(OH)3和Mg(OH)2
D.溶液Y中的阳离子主要是Mg2+、Al3+、Fe3+、H+
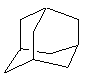 14、金刚烷(C10H16)是一种重要的脂肪烷烃,其结构高度对称,如右
14、金刚烷(C10H16)是一种重要的脂肪烷烃,其结构高度对称,如右
图所示。金刚烷能与卤素发生取代反应,其中一氯一溴金刚烷
(C10H14ClBr)的同分异构体数目是
A、4种 B、6种 C、8种 D、10种
15. 锂电池用金属锂和石墨作电极材料,电解质溶液是由四氯铝锂(LiAlCl4)溶解在亚硫酰氯( ![]() )中形成的,以下电池的总反应方程式为:8Li+3SOCl2=6LiCl+ Li2SO3+2S,
)中形成的,以下电池的总反应方程式为:8Li+3SOCl2=6LiCl+ Li2SO3+2S,
下列叙述中正确的是
A.电解质溶液中混入水,对电池反应无影响 B.金属锂作电池的负极,石墨作电池的正极
C. 电池工作过程中,亚硫酰氯(SOCl2)被还原为Li2SO3
D.电池工作过程中,金属锂提供电子的物质的量与析出硫的物质的量之比为4 :1
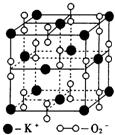 16.高温下,超氧化钾(KO2)晶体结构与NaCl相似,其晶体结构的
16.高温下,超氧化钾(KO2)晶体结构与NaCl相似,其晶体结构的
一个基本重复单元如右图所示,已知晶体中氧的化合价可看作部
分为0价,部分为—2价。则下列说法正确的是
A.晶体中与每个K+距离最近的K+有12个
B.晶体中每个K+周围有8个O2—,每个O2—周围有8个K+
C.超氧化钾晶体中阳离子与阴离子的个数比为1:2
D.晶体中,0价氧原子与-2价氧原子的数目比为1:1
17.常温下,0.1 mol·L-1某一元酸(HA)溶液中![]() =1×10-8,下列叙述正
=1×10-8,下列叙述正
确的是
A.该溶液中由水电离出的c(H+)=1×10-11 mol·L-1
B.浓度均为0.1mol/L的HA和NaA溶液等体积混合后,若溶液呈酸性,
则c(A-)>c(HA)>c(Na+)>c(H+)>c(OH-)
C.0.1 mol·L-1HA溶液与0.05 mol·L-1 NaOH溶液等体积混合后所得溶液中
c(A-) + c(HA) = c(Na+)
D.0.1 mol·L-1HA溶液与0.05 mol·L-1 NaOH溶液等体积混合后所得溶液中
2c(H+)+ c(HA) = c(A-) + 2c(OH-)
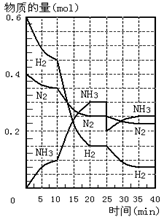 18.500℃、20Mpa时,将H2和N2置于一容积为2L的密闭容器中发生反应。反应过程中H2、N2和NH3物质的量变化如图所示,下列说法正确的是
A.反应开始到第一次平衡时,N2的平均反应速率为0.005mol/(L·min)
18.500℃、20Mpa时,将H2和N2置于一容积为2L的密闭容器中发生反应。反应过程中H2、N2和NH3物质的量变化如图所示,下列说法正确的是
A.反应开始到第一次平衡时,N2的平均反应速率为0.005mol/(L·min)
B.从曲线变化可以看出,反应进行到10min至20min钟时可能是使用了催化剂
C.从曲线变化可以看出,反应进行至25min钟时,分离出0.1mol的氨气
D.在25min钟时平衡正向移动但达到新平衡后NH3的体积分数比原平衡小
化 学 答 题 卷
请将第一卷选择题一、二的正确答案填写在下列表格中:(共72分)
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 |
|
|
|
|
|
|
|
|
|
|
| 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 |
|
|
|
|
|
|
|
|
|
|
第二卷(非选择题,共78分)
三、实验题(本题包含两小题,共22分)
19.Ⅰ(4分)下列有关实验说法正确的是___________
A.进行中和热测定实验时,需要测出反应前盐酸和NaOH溶液的温度及反应后溶液的最高温度
B.除去铝器皿表面的碳酸钙而不损伤铝器皿,可用冷的浓硫酸。
C.水中含有少量苯和硝基苯,可用活性碳吸附除去
D.观察钾元素焰色反应的操作是:将铂丝放在稀盐酸中洗涤,然后蘸取固体氯化钾,置于煤气灯的火焰上进行灼烧,透过蓝色钴玻璃进行观察。
E.检验某溶液中含SO42-的操作与现象是:取试样少量,滴加氯化钡溶液有白色
沉淀,再加入盐酸,沉淀不消失,可确证其中含有SO42-
F.准确取用20.00mL的溴的四氯化碳溶液的方法是:取一支25mL的碱式滴定
管,先用溴的四氯化
碳溶液润洗,再加溶液至1.00mL处,用手挤压玻璃球,放溶液至21.00mL处。
Ⅱ(8分)氧化铜是一种黑色固体,可溶于稀硫酸。某同学想知道是稀硫酸的哪一种粒子(H2O,H+,SO![]() )能使氧化铜溶解。请你和他一起通过如图Ⅰ、Ⅱ和Ⅲ三个实验完成这次探究活动。
)能使氧化铜溶解。请你和他一起通过如图Ⅰ、Ⅱ和Ⅲ三个实验完成这次探究活动。
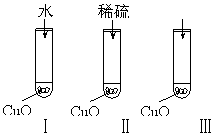 |
①你提出的假设是 ;
②通过实验Ⅰ可以证明 ;
③要证明另外两种粒子能否溶解氧化铜,还需要进行实验Ⅱ和Ⅲ,
在Ⅲ中应加入 ;
④探究结果为 。
你认为除实验Ⅱ和Ⅲ所用的试剂外,还能溶解氧化铜的一种常见物质是 。
20.(10分)间接碘量法测定胆矾中铜含量的原理和方法如下:
已知:在弱酸性条件下,胆矾中Cu2+与I—作用定量析出I2,I2溶于过量的KI溶液中:
I2+I-==I3-,又知氧化性:Fe3+>Cu2+>I2>FeF63-
析出I2可用cmol/LNa2S2O3标准溶液滴定:2S2O32-+I3-==S4O62-+3I-。
准确称取ag胆矾试样,置于250mL碘量瓶(带磨口塞的锥形瓶)中,加50mL蒸馏水、5mL3mol/LH2SO4溶液,加少量NaF,再加入足量的10%KI溶液,摇匀。盖上碘量瓶瓶盖,置于暗处5min,充分反应后,加入1~2mL0.5%的淀粉溶液,用Na2S2O3标准溶液滴定到蓝色褪去时,共用去VmL标准液。
①实验中,在加KI前需加入少量NaF,推测其作用可能是
②实验中加入稀硫酸,你认为硫酸的作用是
③本实验中用碘量瓶而不用普通锥形瓶是因为:
④硫酸铜溶液与碘化钾溶液反应生成白色沉淀(碘化亚铜)并析出碘,该反应的离子方程式为:
⑤根据本次实验结果,该胆矾试样中铜元素的质量分数ω(Cu)=
四.填空题(包含4小题,40分)
21.(8分)我国是最早记载丹砂的药用价值和炼制方法的,为了使人们重视丹砂,
1982年我国发行面值为10分的丹砂邮票。汞单质和化合物在工业生产和科学研
究上有其广泛用途。丹砂炼汞的反应包括以下两个反应:
![]() 反应Ⅰ HgS
+O2 Hg +SO2
反应Ⅰ HgS
+O2 Hg +SO2
![]() 反应Ⅱ 4HgS
+4CaO 4Hg +3CaS + CaSO4
反应Ⅱ 4HgS
+4CaO 4Hg +3CaS + CaSO4
请试完成下列空白:
①HgS与氧气反应,氧化剂是 。 ②请标出反应Ⅱ中电子转移的方向和数目。
③得到的汞中含有铜等杂质,工业上常用5%的硝酸洗涤,写出除去少量铜杂质反应的离子方程式: 。
④已知Hg(NO3)2溶液中加入Hg,存在如下平衡:Hg + Hg2+
![]() Hg22+ ,提
Hg22+ ,提
高Hg22+浓度的方法是: 。
22.(8分)在一定温度下,向一个容积不变的容器中,加入3molSO2和2molO2 及固体催化剂,使之发生反应: 2SO2(g)
+ O2 (g) ![]() 2SO3 (g) △H=-196.6kJ/mol
2SO3 (g) △H=-196.6kJ/mol
平衡时容器内气体压强为起始时的90%。此时
Ⅰ、加入3molSO2和2molO2 发生反应,达到平衡时,放出的热量为 。
Ⅱ、保持同一反应温度,在相同的容器中,将起始物质的量改为amolSO2、bmolO2、cmolSO3(g),欲使平衡时SO3的体积分数为2/9
①达到平衡时,Ⅰ与Ⅱ放出的热量 (填序号)。
A.一定相等 B.前者一定小 C.前者大于或等于后者 D.前者小于或等于后者
②a、b、c必须满足的关系是(一个用a、c表示,另一个用b、c表示) 、 。
③欲使起始时反应表现为向正反应方向进行,a的取值范围是: 。
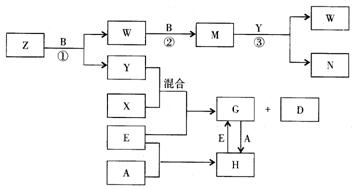 23.(8分)A、B、C、D、E是五种中学化学常见的单质,已知A、B、C、D在常温下均为气态,E为金属。其中D能分别跟A、B、C在一定条件下化合,生成对应的化合物为X、Y、Z,其中常温下,Y为液体,X、Z为气体。有关的转化关系如下图所示(反应条件均已略去)。回答下列问题:
23.(8分)A、B、C、D、E是五种中学化学常见的单质,已知A、B、C、D在常温下均为气态,E为金属。其中D能分别跟A、B、C在一定条件下化合,生成对应的化合物为X、Y、Z,其中常温下,Y为液体,X、Z为气体。有关的转化关系如下图所示(反应条件均已略去)。回答下列问题:
⑴ A的化学式为_______________;
⑵ 写出反应③的化学反应方程式_________________________________;
⑶ Z和W在催化剂作用下反应生成C和Y,这是一个很有实际意义的反应,可以消除W对环境的污染,该反应的化学方程式为__________________________;
⑷ 将过量的E加到N的稀溶液中,若过程中转移电子的数目为3.01×![]() ,则参加反应的E的质量为________g;
,则参加反应的E的质量为________g;
⑸ 将Z与N反应后的产物溶于水中,则常温该溶液的pH_____7,其原因是(用离子方程式表示)___________________________________________。
24.(10分)有机物A(C8H8O2)为一种无色液体。从A出发可发生如下一系列反应
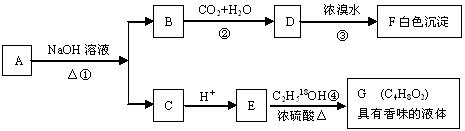
请回答:
(1)A和F的结构简式:A , F 。
(2)反应②的离子反应方程式: 。
反应④的化学反应方程式: 。(请注明示踪18O原子)
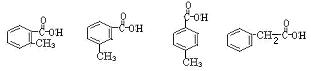
(3)A的同分异构体甚多,其中属于羧酸类的化合物,且含有苯环结构的异构体有多种。写出其结构简式_____________________________________________ _____________________________________________________________________
25.(8分) 从物质A开始有如图所示的转化关系(其中部分产物已略去)。已知H能使溴的CCl4溶液褪色;1mol F(分子式C4H6O2)与足量新制的Cu(OH)2在加热条件下充分反应可生成2molCu2O。分析图表并回答问题。
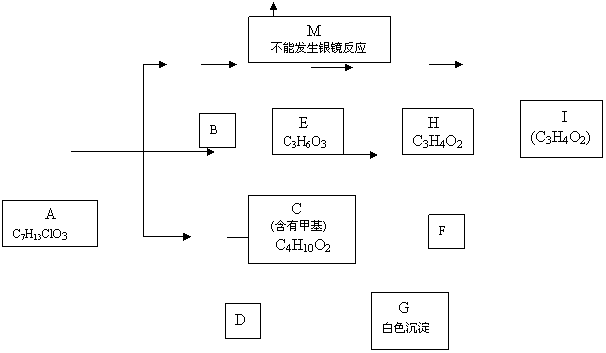 |
(1)写出下列物质可能的结构简式:
B ; M ;
![]()
![]() (2)指出反应类型: D G
E H
(2)指出反应类型: D G
E H
(3)写出下列反应的化学方程式:
![]() C F
C F
![]() H I
H I
五、计算题(本题包含两小题,共16分)
25.(6分)向Cu与CuO的混合物中加入混酸(硝酸和硫酸)后加热,使之恰好完全反应(设反应中不产生SO2和Cu(NO3)2),硝酸的还原产物只有NO,且得到NO8.96L(标准状况)。将溶液冷却后刚好全部结晶(无其它任何残留物),得到CuSO4·5H2O 250g。求:⑴混酸中硝酸和硫酸的物质的量之比。
⑵原混合物中Cu和CuO的物质的量之比。⑶混酸中硫酸的质量分数。
26.(10分)自然界存在着一种白云石的矿石,其化学式是 xCaCO3·yMgCO3.以它为原料,可制取耐火材料等。(下面所涉及的气体体积均在标准状况下测定)
(1)称取27.6g白云石,加热到质量不再变化,试计算生成耐火材料MgO的物质的量(用x 、y的代表式表示)。
(2)若在上述反应中,收集到CO2体积6.72L,试写出白云石的化学式(取x、y的最小正整数比)。
(3)若把收集到6.72mL CO2用来制取化肥,即将CO2通入200mL2.25mol/L氨水中,充分反应后,试确定溶液中CO32-和HCO3-的物质的量之比(不考虑离子的水解)。
(4)若称取白云石m g,研碎后与过量炭粉混合,放在特定仪器中隔离空气强热一段时间后,测得白云石分解率为a,生成V L一氧化碳。试计算一氧化碳的体积V (用m、a代数式表示) 。
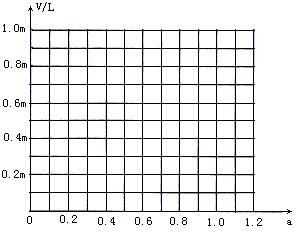 (已知 CaO+3C
(已知 CaO+3C ![]() CaC2
+CO;2MgO+5C
CaC2
+CO;2MgO+5C![]() Mg2C3+2CO)
Mg2C3+2CO)
请在下图中画出V和a的关系图。
高三化学试题参考答案:
(共72分)
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 |
| A | D | C | D | D | C | C | D | B |
| 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 |
| AB | AC | C | B | C | BD | A | AD | BC |
第二卷(非选择题,共78分)
三、实验题(本题包含两小题,共22分)
19.Ⅰ(4分) ____AC_______
Ⅱ。
①你提出的假设是 H2O、H+、SO![]() 中的某一种粒子能够使CuO溶解 ;
中的某一种粒子能够使CuO溶解 ;
②通过实验Ⅰ可以证明水不能使氧化铜溶解,而是另外的H+、SO![]()
两种粒子中的一种粒子使CuO溶解;
③要证明另外两种粒子能否溶解氧化铜,还需要进行实验Ⅱ和Ⅲ,
在Ⅲ中加入含有SO![]() 的Na2SO4(或K2SO4)等溶液;
的Na2SO4(或K2SO4)等溶液;
④探究结果为氧化铜固体溶于稀H2SO4是稀硫酸H+在起作用,而H2O,SO![]() 两种粒子都不能使CuO溶解。
两种粒子都不能使CuO溶解。
你认为除实验Ⅱ和Ⅲ所用的试剂外,还能溶解氧化铜的一种常见物质是硝酸或盐酸。
20.(10分)
①掩蔽Fe3+,防止造成偏大的误差
②提供酸性条件,抑制Cu2+的水解
③:防止空气中的氧气与碘化钾反应,防止生成的碘升华
④2Cu2++4I-=2CuI+I2
⑤ω(Cu)= 64CV/1000aX100%
21.(
![]() ①HgS与氧气反应,氧化剂是HgS 、O2。 ②请标出反应Ⅱ中电子转移的方向和数目。
①HgS与氧气反应,氧化剂是HgS 、O2。 ②请标出反应Ⅱ中电子转移的方向和数目。
③: 3Cu+8H++2NO3-=3Cu2++2NO+4H2O 。
④增大Hg2+的浓度 。
22.
Ⅰ、 98.3 kJ 。Ⅱ 、 C。
② a+c=3 、 2b+c=4 。
③欲使起始时反应表现为向正反应方向进行,a的取值范围是: 2<a≤3 。
23、⑴ ___Cl2___;⑵___3NO2+H2O=2HNO3+NO_________;
⑶ __4NH3+6NO=5N2+6H2O________;
⑷ ___14___g;
⑸_____NH4++H2O![]() _NH3·H2O+H+。
_NH3·H2O+H+。
24. (1)A ![]() , F
, F 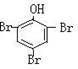 。
。
(2)C6H5O— + CO2 + H2O ==== C6H5OH + HCO3— 。
C2H518OH +CH3COOH=====CH3CO18OC2H5 + H2O
 (3
(3
25.(1)B: CH3CHCOONa M:CH3CCOOH;
![]() (2) D G 复分解反应 ; E H 消去反应
(2) D G 复分解反应 ; E H 消去反应
![]() (3)C F:HOCH2CHCH2OH+O2
OHCCHCHO+2H2O
(3)C F:HOCH2CHCH2OH+O2
OHCCHCHO+2H2O
 |
![]() H I:nCH2=CHCOOH
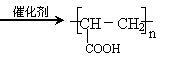
H I:nCH2=CHCOOH
25. ⑴2:5;⑵3:2;⑶51.1%
26. (1)n(MgO)=27.6y/(100x+84y) ;
(2) CaCO3·MgCO3
(3)1:1
(4) 则V(CO) =0.73ma
图略