高三化学上册每周一练(1)
班别 座号 姓名 评分
一.选择题(本题包括5小题,每小题4分,共20分。每小题只有一个选项符合题意)
1.某学生用化学知识解决生活中的问题,下列家庭小实验不合理的是
A.用食醋除去暖水瓶中的薄层水垢
B.用米汤检验食盐中是否含碘酸钾(KIO3)
C.用纯碱(Na2CO3)溶液洗涤餐具上的油污
D.用灼烧并闻气味的方法区别纯棉织物和纯羊毛织物
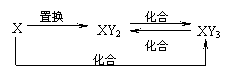 2.元素X的单质Y及X与Y形成的化合物能按如下图所示的关系发生转化:
2.元素X的单质Y及X与Y形成的化合物能按如下图所示的关系发生转化:
则X为
A.Fe B.Cu C.S D.C
3.除去下列物质中的少量杂质需要采用过滤操作的是
A.碳酸钠固体中混有少量碳酸氢钠
B.氯化钠固体中混有少量硝酸钾
C.苯中混有少量的苯酚
D.淀粉溶液中混有少量氯化钠
4.下列既能发生氧化还原反应,又能发生复分解反应的离子组是
A.Na+、H+、NO3–、HS- B.NH4+、Na+、MnO4-、I–
C.K+、Ba2+、Br–、NO3– D.Mg2+、Ag+、OH-、PO43-
 5.右图是某学校实验室从化学试剂商店买回的硫酸试剂
5.右图是某学校实验室从化学试剂商店买回的硫酸试剂
标签上的部分内容。据此下列说法正确的是
A.该硫酸的物质的量浓度为9.2mol/L
B.1molZn与足量的该硫酸反应产生2g氢气
C.配制200mL4.6mol/L的稀硫酸需取该硫酸50 mL
D.该硫酸与等质量的水混合所得溶液的物质的量浓度
大于9.2mol/L
二、选择题(本题包括5小题,每小题6分,共30分。每小题有一个或两个选项符合题意。若正确答案只包括一个选项,多选时,该题为0分;若正确答案包括两个选项,只选一个且正确的给2分,选两个且都正确的给4分,但只要选错一个,该小题就为0分)
6.阿伏加德罗常数约为6.02×1023 mol-1,下列叙述中不正确的是
A.将162.5g FeCl3转化为氢氧化铁胶体后,氢氧化铁胶体粒子数小于6.02×1023
B.在含196g H2SO4的浓硫酸溶液中加入足量的锌粉使其充分反应,则反应结束时,转移电子数约为4×6.02×1023
C.在石墨晶体中,平均0.3 mol碳碳共价键所含有的碳原子数约为 ![]() ×6.02×1023
×6.02×1023
D.1mol C10H22分子中共价键总数约为31×6.02×1023
7.下列实验操作的先后顺序合理的是
A.制取乙酸乙酯,应先将乙醇、乙酸混合,后加入到浓硫酸中
B.酸碱中和滴定中,应先将锥形瓶用待测液润洗,后加入一定体积的待测液
C.配制SnCl2溶液时,应先将SnCl2固体溶于浓盐酸中,后加水稀释
D.用分液漏斗滴液,应先旋开分液漏斗的活塞,后打开漏斗上口的玻璃塞
8.下列反应的离子方程式书写正确的是
A.实验室用大理石与醋酸反应制取二氧化碳:CaCO3+2H+=Ca2++CO2↑+H2O
B.向过氧化钠固体中滴加水:Na2O2+H2O =2Na++2OH-+O2↑
C.将溶质物质的量之比为4∶3的 NaHSO4和 Ba(OH)2两溶液混合:
4H++3SO42-+3Ba2++4OH-=3BaSO4↓+4H2O
D.硫酸亚铁溶液中加入用硫酸酸化的过氧化氢溶液:
Fe2++2H++H2O2=Fe3++2H2O
9.X+、Y+、M2+、N2-均为含有一定数目电子的短周期元素的简单离子,离子半径大小关系是:N2->Y+、Y+>X+、Y+>M2+,下列比较正确的是
A.原子半径:N可能比Y大,也可能比Y小
B.M2+、N2-核外电子数:可能相等,也可能不等
C.原子序数:N>M>X>Y
D.碱性:M(OH)2>YOH
10.一定条件下CuS与稀HNO3发生反应,所得还原产物为NO,氧化产物为SO42—。现将0.06molCuS加入到50mL4.2mol/LHNO3中,充分反应之后,忽略溶液体积变化,下列说法正确的是
A.被还原的硝酸为0.16mol
B.反应后溶液中仍有硝酸剩余
C.反应后溶液的pH=1
D.CuS未全部参加反应
三.(本题包括3小题,共50分)
11.随着材料科学的发展,金属钒及其化合物得到了越来越广泛的应用,并被誉为“合金的维生素”。
![]() 钒元素广泛分散于各种矿物中,钾钒铀矿的主要成分可用化学式表示为K2H6U2V2O15,测定其中钒元素含量的方法是:先把矿石中的钒元素转化为V2O5(钒元素的化合价不变),V2O5在酸性溶液里转化为VO2+,再用草酸等测定钒。总反应可表示为:□VO2+ + □H2C2O4
+
□H+ □VO2+ + □CO2 + □H2O
钒元素广泛分散于各种矿物中,钾钒铀矿的主要成分可用化学式表示为K2H6U2V2O15,测定其中钒元素含量的方法是:先把矿石中的钒元素转化为V2O5(钒元素的化合价不变),V2O5在酸性溶液里转化为VO2+,再用草酸等测定钒。总反应可表示为:□VO2+ + □H2C2O4
+
□H+ □VO2+ + □CO2 + □H2O
⑴请将上述反应配平。
⑵现有钾钒铀矿样品10.2g,用上述方法来测定钒的含量,结果消耗0.9g草酸,那么此钾钒铀矿中钒元素的质量分数是 。若用氧化物的形式表示钾钒铀矿的主要成分,其化学式为 。
12.某未知溶液X中可能含有K+、Fe2+、NH4+、Cl-。检验其中是否含有K+,通常有如下两套实验方案。
方案一:焰色反应法
用洁净的玻璃棒蘸取未知液X置于酒精灯外焰上灼烧,观察到火焰呈黄色,则证明其中不含K+。对上述实验过程中的错误和疏漏之处加以纠正、补充:
、 、
。
方案二:亚硝酸钴钠法
在CH3COOH酸化的溶液中,K+与亚硝酸钴钠[Na3Co(NO2)6]反应生成黄色沉淀[K2NaCo(NO2)6],该原理可用于K+的检验。注意:NH4+也能与Na3Co(NO2)6生成黄色沉淀,会干扰K+离子的检验。
请你利用上述反应原理设计一个实验方案,检验未知溶液X中是否含有K+。
、 、
。
13.下面是某化学学习小组的同学进行研究性学习的过程,请你参与并协助他们完成相关学习任务。
【研究课题】探究草酸晶体受热分解的产物
【查阅资料】该小组同学通过网络查询,获得草酸及草酸晶体的一些相关知识:
| 名称 | 分子式 | 颜色、状态 | 溶解性 | 熔点(℃) | 密度(g/cm3) |
| 草酸 | H2C2O4 | — | 易溶于水 | 189.5 | 1.900 |
| 草酸晶体 | H2C2O4·2H2O | 无色晶体 | — | 101.5 | 1.650 |
备注:草酸晶体失去结晶水后,175℃以上开始分解。
【提出猜想】⑴ ;
⑵分解产物中的气体可能是CO、CO2或它们的混合物。
 【设计方案】⑴请设计完成“猜想⑴”的实验方案[用简要的实验装置图表示,要体现所使用仪器(加热和夹持仪器不必画出)和试剂]。
【设计方案】⑴请设计完成“猜想⑴”的实验方案[用简要的实验装置图表示,要体现所使用仪器(加热和夹持仪器不必画出)和试剂]。
⑵化学学习小组的同学继续利用下图所示装置进行“猜想⑵”的实验探究。已知:A、C、F中盛装澄清石灰水,B中盛装浓NaOH溶液,D中装有碱石灰,E中装有CuO。
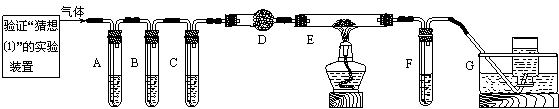 |
①证明分解产物中有CO2的现象是 ;证明分解产物中有CO的现象是 。
②若未连接装置G,要达到同样的目的,可采取的措施是 。
【交流讨论】小李同学继续查阅相关资料发现:草酸是二元弱酸,酸性比碳酸强,在受热分解过程中有少量升华;草酸钙和草酸氢钙均为白色不溶物。小李通过进一步研究,对实验中CO2的检验提出质疑。试根据相关信息,指出原设计中存在的问题,并提出实验的改进措施。
。
高三化学每周一练(1)
答案
1.B 2.A 3.B 4.A 5.C 6.BC 7.C 8.C 9.B 10.AB
![]() 11.⑴ 2VO2+ + H2C2O4
+ 2H+ 2VO2+
+ 2CO2 + 1H2O (3分)
11.⑴ 2VO2+ + H2C2O4
+ 2H+ 2VO2+
+ 2CO2 + 1H2O (3分)
⑵ 10%(3分); K2O·V2O5·U2O6·3H2O或K2O·V2O5·2UO3·3H2O (2分)
12.(8分)应使用铂丝或无锈铁丝蘸取溶液(2分) 应透过蓝色钴玻璃观察(2分)
向未知溶液X中加入稍过量的NaOH溶液并加热;静置、冷却后取上层清液少许;用醋酸酸化后再加入亚硝酸钴钠,观察是否有黄色沉淀生成。(或者取未知液X蒸干并灼烧,将所得固体溶于水,过滤;取少量滤液,用醋酸酸化后再加入亚硝酸钴钠,观察是否有黄色沉淀生成。)(4分)
13.(15分)【提出猜想】⑴草酸晶体中含有结晶水,受热时会有水生成(2分)
 【设计方案】⑴
【设计方案】⑴
(4分)
⑵①装置A中澄清石灰水变浑浊(2分) 装置C中澄清石灰水不变浑浊,装置E中黑色氧化铜变为红色固体,装置F中澄清石灰水变浑浊(不写全不给分)(2分)
②在装置F出气导管的末端放一个燃着的酒精灯(2分)
【交流讨论】在未洗气的情况下通入石灰水,还可能因草酸蒸气与石灰水反应生成了草酸钙沉淀,对实验有干扰,因而在装置A之前可增加一个装有水的洗气装置(3分)