高三化学上册每周一练(3)
班别 座号 姓名 评分
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| 答案 |
一.选择题(本题包括5小题,每小题4分,共20分。每小题只有一个选项符合题意)
1.今年是第37个“世界地球日”,宣传主题是“善待地球——珍惜资源、持续发展”。下列活动或行为不符合这一主题的是
A.发展循环经济,构建资源节约型社会及清洁生产技术
B.采用绿色化学生产工艺,建立环境友好型化工体系
C.大力开发可再生资源,推广用乙醇汽油代替传统的燃油
D.设计化学实验方案时,提倡用尽可能多的样品和试剂以提高实验效果
2.在右下图的实验装置中,从实验开始过一段时间,对看到的现象叙述不正确的是
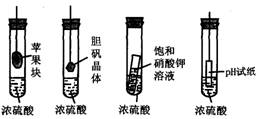
A.苹果块会干瘪 B.胆矾晶体表面有“白斑”
C.小试管内有晶体析出 D.pH试纸变红
3.向一种溶液中滴加另一种溶液后,溶液的颜色有明显变化的是
A.溴水中滴加亚硫酸钠溶液 B.稀醋酸溶液中滴加酚酞指示剂
C.硫酸铜溶液中滴加硝酸钡溶液 D.硫酸亚铁溶液中滴加硫氰化钾溶液
4.X、Y是周期表前二十号元素,已知X、Y之间原子序数相差3,X、Y易形成化合物M。下列有关说法正确的是
A.X、Y可能都是金属
B.若X的单质常温下是气体,则Y的单质常温下也是气体
C.若X、Y处于同一周期,则化合物M可能是非极性分子
D.X、Y两元素周期数差1,属于离子化合物的M只有三种
5.将铝粉与某铁的氧化物FeO·2Fe2O3粉末配制成铝热剂,分成两等份。一份直接放入足量的烧碱溶液中,充分反应后放出气体在标准状况下的体积为15.68L;另一份在高温下恰好反应完全,反应后的混合物与足量的盐酸反应后,放出的气体在标准状况下的体积为
A.11.20L B.15.68L C.22.40L D.31.36L
二、选择题(本题包括5小题,每小题6分,共30分。每小题有一个或两个选项符合题意。若正确答案只包括一个选项,多选时,该题为0分;若正确答案包括两个选项,只选一个且正确的给2分,选两个且都正确的给4分,但只要选错一个,该小题就为0分)
6.设NA表示阿伏加德罗常数的值,下列叙述中正确的是
A.常温常压下,8.8g CO2和N2O混合物中所含有的原子数为0.6 NA
B.Cu和足量的稀硝酸反应产生4.48L气体时,转移的电子数为0.6 NA
C.标准状况下,3.36L丁烷中含有的非极性键数为0.6NA
D.在1L0.2mol/L的硫酸铁溶液中含有的硫酸根离子数为0.6 NA
7.下列反应的离子方程式正确的是
A.铜片插入氯化铁溶液中 Cu+Fe3+=Cu2++Fe2+
B.电解饱和食盐水 2Cl—+2H+![]() H2↑+C12↑
H2↑+C12↑
C.向溴化亚铁溶液中通入过量的氯气![]() 2Fe2++Cl2=2Fe3++2Cl-
2Fe2++Cl2=2Fe3++2Cl-
![]() D.向硫酸铝铵[NH4Al(SO4)2]溶液中滴加足量Ba(OH)2溶液
D.向硫酸铝铵[NH4Al(SO4)2]溶液中滴加足量Ba(OH)2溶液
NH4++Al3++2SO42—+2Ba2++5OH-=AlO2-+2BaSO4↓+NH3·H2O+2H2O
8.下列各组离子在指定条件下,—定能大量共存的是
A.能使蓝色石蕊试纸变红色的溶液中:K+、Na+、CO32-、NO3-
B.c(H+)=10—1mol/L的溶液中:Cu2+、Al3+、SO42—、NO3—
C.能使碘化钾淀粉试纸变蓝的溶液中:Na+、NH4+、S2-、Br-
D.水电离出的c(H+)=10-12mol/L的溶液中:Na+、Mg2+、Cl-、SO42-
9.A是一种常见的单质,B、C为中学常见的化合物,A、B、C均含有元素X。它们有如下的转化关系(部分产物及反应条件已略去):
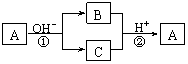 |
下列判断正确的是
A.X元素可能为Al B.X元素一定为非金属元素
C.反应①和②互为可逆反应 D.反应①和②一定为氧化还原反应
10.铜的冶炼大致可分为:⑴富集,将硫化物矿进行浮选;
⑵焙烧,主要反应为:2CuFeS2+4O2==Cu2S+3SO2+2FeO(炉渣);
⑶制粗铜,在1200℃发生的主要反应为:2Cu2S+3O2 ==2Cu2O+2SO2;
2Cu2O+ Cu2S=6 Cu+SO2↑; ⑷电解精炼。
下列说法正确的是
A.上述灼烧过程的尾气均可直接排空
B.由6mol CuFeS2生成6molCu,上述共消耗15molO2
C.在反应2Cu2O+ Cu2S==6Cu+SO2↑中,作氧化剂的只有Cu2O
D.电解精炼时,粗铜应与外电源正极相连
三.(本题包括3小题,共50分)
11.证明KClO3中含有K、Cl、O三种元素的实验步骤及每一步的实验目的是
① ;
② ;
③ ;
④ 。
12.(某地有软锰矿(主要成份为MnO2,含少量Al2O3、SiO2)和闪锌矿(主要成份ZnS,含少量FeS、CuS、CdS、SiO2),科研人员采用新工艺生产二氧化锰和锌,同时还得副产品镉和X、Y、Z等。工业流程图如下图(框图中水省略):
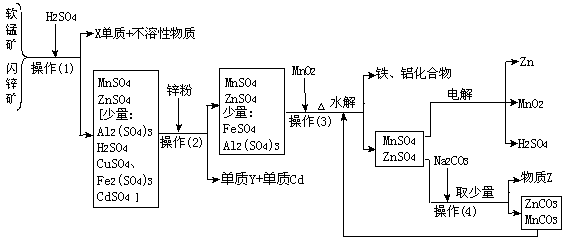
请回答:
(1)副产品X的名称是 ,Y的名称是 、Z的化学式为 。
(2)他们的主要产品中的元素在周期表中,锌属 族,X在 周期。
(3)图中“操作(1)~(4)”都包含的共同一种操作,在实验室中该操作的名称为 。
(4)操作(1)中,在稀H2SO4存在下MnO2把硫化物氧化成硫单质和+2价硫酸盐。如果硫化物用MS表示,请写出MnO2与硫化物反应的化学方程式: 。
(5)操作(3)生成的铁、铝化合物的化学式为 。
(6)请写出电解制得锌和二氧化锰的化学方程式 。
(7)旧工艺生产二氧化锰,是将软锰矿与煤混合粉碎后高温焙烧,再用硫酸浸取焙烧料净化后电解。对比旧工艺,新工艺有好多个优点,请你至少说出新工艺的一个优点:
。
13.空气中的SO2含量和可吸入颗粒的含量(可用g/cm3表示)都是重要的空气质量指标。在工业生产上规定:空气中二氧化硫的最大允许排放浓度不得超过0.02mg/L。
⑴为测定某地方的空气中SO2和可吸入颗粒的含量,甲同学设计了如下图所示的实验装置:
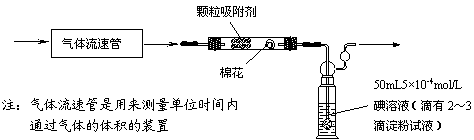
①应用上述装置测定空气中的SO2含量和可吸入颗粒的含量,除测定气体流速(单位:cm3/min)外,还需要测定 。
②已知:碘单质微溶于水,KI可以增大碘在水中的溶解度。
请你协助甲同学完成100mL5×10-4mol/L碘溶液的配制:
第一步:准确称取1.27g碘单质加入烧杯中, ;
第二步: ;
 第三步:从第二步所得溶液中,取出10.00mL溶液于100mL容量瓶中,加水稀释至刻度线。
第三步:从第二步所得溶液中,取出10.00mL溶液于100mL容量瓶中,加水稀释至刻度线。
⑵乙同学拟用下列简易装置测定空气中的SO2含量:准确移取50mL5×10-4mol/L的碘溶液,注入右图所示广口瓶中,加2~3滴淀粉指示剂,此时溶液呈蓝色。在指定的测定地点抽气,每次抽气100mL,直到溶液的蓝色全部褪尽为止,记录抽气次数(n)。
①假设乙同学的测量是准确的,乙同学抽气的次数至少为 次,方可说明该地空气中的SO2含量符合排放标准。
②如果乙同学用该方法测量空气中SO2的含量时,所测得的数值比实际含量低,请你对其可能的原因(假设溶液配制、称量或量取及各种读数均无错误)提出合理假设:
_________________________________________________________________________________________________________________________________________________________。
③丙同学认为:乙同学的实验方案需要抽气的次数太多,操作麻烦。与乙讨论后,决定将抽气次数降到100次以下,请你设计合理的改进方案:
。
⑶改变合适的吸收液,乙同学使用的装置还可以测定新装修的居室空气中甲醛的浓度,吸收剂最好选用 (选填:①浓硫酸、②银氨溶液、③新制的氢氧化铜、④酸化的高锰酸钾溶液)。
高三化学每周一练(3)答案
1.D 2.D 3.A 4.C 5.A 6.AD 7.D 8.B 9.BD 10.BD
11. (12分) (每空3分)
①混入少量MnO2后加热并用带火星的木条检验生成的气体以证明KClO3中含有O;
②将加热后的固体溶于水并过滤以除去MnO2;
③用一根洁净的铂丝沾取滤液在无色火焰灼烧上以证明KClO3中含有K;④取滤液少许,向其中加入用HNO3酸化的AgNO3溶液以证明KClO3中含有Cl (各 1分)
12.(20分) (每空2分)
(1)(3分)硫 铜 Na2SO4
(2)(2分)ⅡB 三
(3)过滤(1分)
(4)(2分)MnO2+MS+2H2SO4==MnSO4+ MSO4+S↓+2H2O
|
(6)(2分)MnSO4+ ZnSO4+2H2O=MnO2+Zn+2H2SO4
(7)(1分)新工艺不需要高温焙烧,大大节约了能源(燃料)(或旧工艺高温焙烧产生大气污染物SO2,新工艺不产生有害气体;或新工艺许多物质都可以循环利用)
13.(18分) (每空3分)
⑴ ①溶液蓝色恰好褪去所需的时间,吸收前后颗粒吸附剂、棉花、盛放容器的总质量
②同时加入少量碘化钾固体,用适量水使之完全溶解 将第一步所得溶液全部转入部1000mL的容量瓶中,定容,摇匀
⑵ ①800 ②抽气速度过快,或装置气密性较差
③将50mL5×10-4mol/L的碘溶液的体积减小为5mL,并将广口瓶改为试管
⑶ ④