高三化学上册每周一练(4)
班别 座号 姓名 评分
一.选择题(本题包括10小题,每小题5分,共50分。每小题有1个或2个选项符合题意)
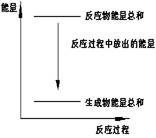 1.对于Zn(s)+H2SO4(l)==ZnSO4(l)+H2(g);ΔH
<0 的化学反应下列叙述不正确的是
1.对于Zn(s)+H2SO4(l)==ZnSO4(l)+H2(g);ΔH
<0 的化学反应下列叙述不正确的是
A.反应过程中能量关系可用右图表示
B.ΔH的值与反应方程式的计量系数有关
C.若将该反应设计成原电池锌为负极
D.若将其设计为原电池当有32.5g锌溶解时, 正极放出气体一定为11.2L
2.在下列各说法中,正确的是
A.△H > 0 kJ·mol-1表示放热反应,△H < 0 kJ·mol-1表示吸热反应
B.热化学方程式中的化学计量数表示物质的量,可以是分数
C.1 mol H2SO4与1 molBa(OH)2反应生成BaSO4沉淀时放出的热叫做中和热
D.1 mol H2与0.5 molO2反应放出的热就是H2的燃烧热
3.强酸和强碱稀溶液的中和热可表示为:
H+(aq)+OH-(aq)=H2O(1);ΔH=-57.3kJ·mol-1
已知:CH3COOH(aq)+NaOH(aq)=CH3COONa(aq)+H2O(1);ΔH1
![]() H2SO4(浓)+NaOH(aq)=
H2SO4(浓)+NaOH(aq)=![]() Na2SO4(aq)+H2O(1);ΔH2
Na2SO4(aq)+H2O(1);ΔH2
HNO3(aq)+KOH(aq)=KNO3(aq)+H2O(1);ΔH3
上述反应物除已注明的外均为稀溶液,则ΔH 1、ΔH 2、ΔH 3的关系正确的是
A.ΔH1=ΔH2=ΔH3 B.ΔH2<ΔH1<ΔH3
C.ΔH2<ΔH 3<ΔH1 D.ΔH2=ΔH3<ΔH1
4.根据热化学方程式:S(s)+O2(g)=SO2(g);△H=-297.23 kJ/mol ,下列说法正确的是:
A.1molSO2 (g)的能量总和大于1molS(s)和1mol O2(g)的能量总和
B.1molSO2(g)的能量总和小于1molS(s)和1molO2(g)的能量总和
C.S(g)+O2(g)=SO2(g);△H= -Q kJ/mol ; Q的值大于297.23
D.S(g)+O2(g)=SO2(g);△H= -Q kJ/mol ; Q的值等于297.23
5.已知:H2O (g) = H2O (l);△H = Q1 kJ/mol
C2H5OH (g) = C2H5OH (l);△H = Q2 kJ/mol
C2H5OH (g) + 3O2 (g) =2CO2 (g) + 3H2O (g) ;△H = Q3 kJ/mol
若使23g 酒精液体完全燃烧,最后恢复到室温,则放出热量为
A.Q1+ Q2 +Q3 B.0.5(Q1 + Q2 +Q3)
C.0.5Q1 —1.5Q2 + 0.5Q3 D.1.5Q1 —0.5Q2 + 0.5Q3
6.已知25℃、101kPa下,石墨、金刚石燃烧的热化学方程式分别为:
C(石墨)+O2(g)=CO2(g);ΔH= —393.51 kJ.mol-1
C(金刚石)+O2(g)=CO2(g);ΔH= —395.41 kJ.mol-1
据此推理所得到的下列结论正确的是
A.金刚石的燃烧热比石墨的燃烧热小
B.石墨晶体中碳碳键的强度小于金刚石中的碳碳键
C.等等质量石墨的能量比金刚石的能量高
D.由石墨制备金刚石一定是吸热反应
7.下列关于反应能量的说法正确的是
A.Zn(s)+CuSO4(aq)=ZnSO4(aq)+Cu(s);△H = –216 kJ·mol-1,E反应物>E生成物
B.CaCO3(s)=CaO(s)+CO2(g);△H = +178.5 kJ·mol-1,E反应物>E生成物
C.HI(g) =![]() H2(g)+
H2(g)+
![]() I2(s);△H = –26.5kJ·mol-1
I2(s);△H = –26.5kJ·mol-1
1mol HI在密闭容器中分解后放出26.5kJ的能量
D.H+(aq)+OH —(aq)=H2O(l);△H = –57.2 kJ·mol —1
含1molNaOH水溶液与含0.5mol H2SO4的浓硫酸混合后放热57.2 kJ
8.在一定条件下化学反应:2SO2(g)+O2(g)![]() 2SO3(g);△H=-197 kJ/mol
现有容积相同的甲、乙、丙三个容器,在上述条件下分别充入的气体和反应放出的热量(Q)如下表所列:
2SO3(g);△H=-197 kJ/mol
现有容积相同的甲、乙、丙三个容器,在上述条件下分别充入的气体和反应放出的热量(Q)如下表所列:
| 容器 | SO2 (mol) | O2 (mol) | N2 (mol) | Q( kJ) |
| 甲 | 2 | 1 | 0 | Q1 |
| 乙 | 1 | 0.5 | 0 | Q2 |
| 丙 | 1 | 0.5 | 1 | Q3 |
根据以上数据,下列叙述不正确的是
A.在上述条件下反应生成1 molSO3气体放热98.5 kJ
B.在上述条件下每摩该反应进行到底时放出的热量为197 kJ
C.Q1=2Q2=2Q3=197
D.2Q2=2Q3<Q1<197 kJ
9.根据下表中列出的数据,判断下列热化学方程式书写不正确的是
| 化 学 键 | H-H | Cl-Cl | H-Cl |
| 生成1mol化学键时放出的能量 | 436kJ·mol-1 | 243kJ·mol-1 | 431kJ·mol-1 |
A.![]()
B.![]()
C.![]()
D.![]()
10.断裂一个给定的键时所消耗的能量称为离解能,提供下列烷烃的C—H键的离解能:
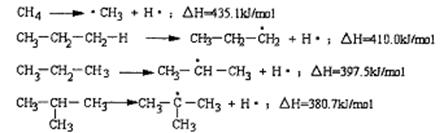
根据提供数据判断下列说法不正确的是
A.离解能愈小,C—H键易断裂,氢原子越易被取代
B.在光照条件下丙烷与氯气发生取代反应CH3CH2CH2Cl与CH3CHClCH3的物质的量之比为1:1
C.异丁烷与氯气发生取代反应,(CH3)3CCl占一氯代物的物质的量分数大于10%
D.C2H6中C—H的离解能介于410.0 kJ /mol~435.1kJ/mol
三.(本题包括5小题,共50分)
11.(6分)已知下列热化学方程式的热效应:
(1)Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g);△H1=-26.7kJ·mol-1
(2)3Fe2O3(s)+CO(g)=2Fe3O4(s)+CO2(g);△H2=-50.75kJ·mol-1
(3)Fe3O4(s)+CO(g)=3FeO(s)十CO2(g);△H3=-36.5kJ·mol-1
计算下列反应的△H4:
FeO(s)+CO(g)=Fe(s)+CO2(g);△H4=
12.(6分)已知下列两个热化学方程式; H2(g)+![]() O2(g)===H2O(1); △H=-285.0kJ/mol;
O2(g)===H2O(1); △H=-285.0kJ/mol;
C3H8(g)+5O2(g)===3CO2(g)+4H2O(1); △H=-2220.0kJ/mol
(1)实验测得H2和C3H8的混合气体共5mol,完全燃烧生成液态水时放热6262.5kJ,则混合气体中H2和C3H8的体积比是 。
(2)已知:H2O(1)=H2O(g);△H=+44.0kJ/mol。写出丙烷燃烧生成CO2和气态水的热化学方程式:
13.(8分)称取等质量(均为ag)胆矾两份。把一份溶于bg水中,测知其溶解时吸收Q1kJ热量;把另一份脱水后溶于bg水中,测得其溶解时放热Q2kJ。
(1)胆矾的溶解热为______kJ·mol—1;
(2)无水硫酸铜的溶解热为______kJ·mol—1;
(3)从以上数据可知,胆矾脱水是______过程,1mol胆矾脱水需______kJ·mol—1热量。
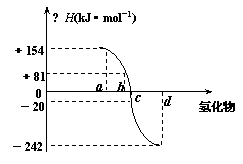 14.(8分)已知:在热力学标准态(298K、1.01×105Pa)下,由稳定的单质发生反应生成1mol化合物的反应热叫该化合物的生成热(△H)。右图为氧族元素氢化物a、b、c、d的生成热数据示意图。试回答下列问题:
14.(8分)已知:在热力学标准态(298K、1.01×105Pa)下,由稳定的单质发生反应生成1mol化合物的反应热叫该化合物的生成热(△H)。右图为氧族元素氢化物a、b、c、d的生成热数据示意图。试回答下列问题:
⑴ 出氧族元素中含有18e-的两种氢化
。
⑵ 你归纳:非金属元素氢化物的稳定性与氢化物的反应热△H的关系
。
 ⑶
硒化氢在热力学标准态下,发生分解反应的热化学反应方程式:
。
⑶
硒化氢在热力学标准态下,发生分解反应的热化学反应方程式:
。
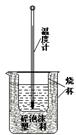
15.(10分)实验室利用如右图装置进行中和热的测定。回答下列问题:
(1) 图中有两处未画出,它们是 、 ;
(2) 果用0.5 mol/L的盐酸和氢氧化钠固体进行实验,则实验中所
测出的“中和热”将 (填“偏大”、“偏小”或“不变”);
原因是 ;
在操作正确的前提下提高中和热测定的准确性的关键是 ;
16.(12分)某种发动机燃料由A、B两种物质混合而成,A、B两种物质含有C、H、O三种元素中的两种或三种。
已知常温下A、B及CO、H2的燃烧热如下:
| 物 质 | A | B | CO | H2 |
| 燃烧热/Kj·mol-1 | 725 | 5518 | 283 | 286 |
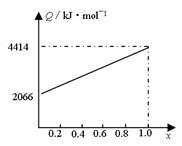 A、B按不同比例混合的燃料91.2g,在足量的氧气中燃烧时,放出的热量Q与B的物质的量分数x的关系如右图。
A、B按不同比例混合的燃料91.2g,在足量的氧气中燃烧时,放出的热量Q与B的物质的量分数x的关系如右图。
⑴ A、的相对分子质量为A________,B________。
⑵ 物质的量的A、B混合的燃料73g,在160LO2中完全燃 烧,得到104L气体,通过碱石灰吸收后剩余3.2L(气体体积均在标准状况下测定)。由此可推得混合物中n (C)∶n (H)∶n (O)=___________,A分子式为_________,B分子式为____________。
⑶ mol等物质的量的A、B混合的燃料,在一定量的氧气中燃烧,放出热量2980kJ,则反应中生成CO_________ mol。
高三化学每周一练(4)答案
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| 答案 | D | B | C | BC | A | D | A | B | B | B |
11.△H4=+7.28kJ·mol-1
12.(1)1:1;
(2)C3H8(g)+5O2(g)===3CO2(g)+4H2O(g); △H=-2044.0kJ/mol
13.(1)250Q1/a
(2)-250Q2/a
(3)吸热 250(Q1+Q2)/a
14.(1)![]()
(2)非金属元素氢化物越稳定,△H越小,反之亦然
(3)H2Se(g)=Se(s)+H2(g);△H=-81kJ/mol
15.(1) 环形玻璃棒 烧杯上方的泡沫塑料盖
(2)偏大 固体NaOH溶于水放热 提高装置的保温效果
16.(1)32 114
(2)9∶22∶1 CH3OH C8H18
(3)0.5