高三化学上册第一次月考试卷
命题人:李新朵
相对原子质量:H—1 C—12 Na—23 O—16 P—31 Si—28 S—32 Cu—64
注意事项:
1.本试卷分第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分。满分100分。考试时间90分钟。
2.答卷前考生务必将自己的班级、姓名、学号和考试科目用钢笔分别填在第II卷密封线内。
3.第Ⅰ卷答案务必答在第Ⅱ卷的答题栏中,否则不得分;第II卷用钢笔或圆珠笔直接答在试题卷上。
4.考试结束,将第II卷上交(第I卷自己保留好,以备评讲)。
第I卷(选择题,共54分)
一、选择题(本题包括18小题,每小题3分,共54分,每小题只有一个正确答案)
1、2008年夏季奥运会将在北京举行,届时要突出“绿色奥运、科技奥运、人文奥运”理念。“绿色奥运”是指( )
A. 加大防恐力度,并加大各国运动员的营养搭配,使他们全身心投入比赛
B. 严禁使用兴奋剂,使运动员公平竞争
C. 把环境保护作为奥运设施规划和建设的首要条件
D.奥运场馆建设均使用天然材料,不使用合成材料
2、下列叙述正确的是( )
A. 直径介于1nm~10nm之间的微粒称为胶体
B. 电泳现象可证明胶体属于电解质溶液
C. 利用丁达尔效应可以区别溶液与胶体
D. 胶体粒子很小,可以透过半透膜
3、关于晶体的说法正确的是( )
A. 晶体中只要有阴离子就一定有阳离子
B. 晶体中只要有阳离子就一定有阴离子
C. 原子晶体的熔点一定比金属晶体的熔点高
D. 分子晶体的熔点一定比金属晶体的熔点低
4、实现下列变化时,需克服相同类型作用力的是( )
A. 石墨和干冰的熔化 B. 食盐和冰醋酸的熔化
C. 液溴和汞的气化 D. 纯碱和苛性钾的熔化
5、强酸和强碱的稀溶液的中和热可表示为:
H+ (aq) + OH- (aq) = H2O(l);ΔH= - 57.3 kJ·mol-1
已知:CH3COOH+ NaOH=CH3COONa+ H2O;ΔH1= - Q1 kJ·mol-1
1/2 H2SO4(浓)+ NaOH=1/2 Na2SO4+ H2O;ΔH2= - Q2 kJ·mol-1
HNO3 + NaOH=NaNO3 + H2O;ΔH3= - Q3 kJ·mol-1
上述反应均为溶液中的反应,则Q1、Q2、Q3的关系正确的是( )
A. Q3=Q2>Q1 B. Q1>Q3>Q2 C. Q1 = Q2 = Q3 D. Q2>Q3>Q1
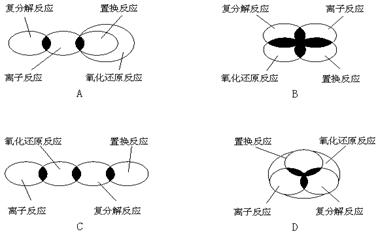
6、离子反应、复分解反应、置换反应和氧化还原反应之间可用集合关系表示,其正确的是:( )
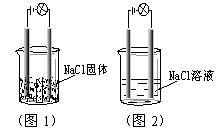 7、一化学兴趣小组在家中进行化学实验,按照图1连接好线路发现灯泡不亮,按照图2连接好线路发现灯泡亮,由此得出的结论正确的是( )
7、一化学兴趣小组在家中进行化学实验,按照图1连接好线路发现灯泡不亮,按照图2连接好线路发现灯泡亮,由此得出的结论正确的是( )
A.NaCl是非电解质
B.NaCl溶液是电解质
C.NaCl在水溶液中电离出了可以自由移动的离子
D.NaCl溶液中水电离出大量的离子
8、已知硫酸锰(MnSO4)和过量过硫酸钾(K2S2O8)两种盐溶液在Ag+催化下可发生氧化还原反应,生成高锰酸钾、硫酸钾和硫酸。则下列说法正确的是( )
A. 反应中水参加反应
B. 反应后溶液呈无色
C. 该反应的还原剂为K2S2O8
D. MnSO4和K2S2O8的化学计量数分别为5、2
9、将分别盛有熔融的氯化钾、氯化镁、氧化铝的三个电解槽串联,在一定条件下通电一段时间后,析出钾、镁、铝的物质的量之比为( )
A. 1:2:3 B.3:2:1 C.6:3:1 D.6:3:2
10、用惰性电极电解下列溶液,一段时间后,再加入一定质量的另一种物质(中括号内),溶液能与原来溶液完全一样的是( )
A. CuC12 [CuO] B. NaOH [NaOH]
C. NaC1 [HC1] D. CuSO4 [Cu(OH)2]
11、根据下列反应判断有关物质的还原性由强到弱的顺序正确的是( )
①H2SO3+I2+H2O 2HI+H2SO4
②2FeCl3+2HI 2FeCl2+2HCl+I2
③3FeCl2+4HNO3 2FeCl3+NO↑+2H2O+Fe(NO3)3
A.H2SO3>I->Fe2+>NO B.I-> H2SO3> Fe2+>NO
C.Fe2+> I-> H2SO3>NO D.NO> Fe2+> H2SO3> I-
12、燃烧lg乙炔生成二氧化碳和液态水,放出热量50kJ,则这一反应的热化学反应方程式为( )
A.2C2H2(g)+5O2(g) 4CO2(g)+2H2O(l);△H=+50kJ/mol
B.C2H2(g)+5/202(g) 2CO2(g)+H2O(l);△H=-1300kJ
C.2C2H2+5O2 4CO2+2H2O;△H=-2600kJ
D.2C2H2(g)+5O2(g) 4CO2(g)+2H2O(l);△H=-2600kJ/mol
13、在给定的四种溶液中,加入以下各种离子,各离子能在原溶液中大量共存的有( )
A.滴加石蕊试液显红色的溶液
Fe3+ 、NH![]() 、Cl- 、SCN-
、Cl- 、SCN-
B.pH值为1的溶液
Cu2+、Na+ 、Mg2+、NO![]()
C.水电离出来的c(H+)=10-13mol/L的溶液 K+、HCO![]() 、Br-、Ba2+
、Br-、Ba2+
D.所含溶质为Na2SO4的溶液 K+
、CO![]() 、NO
、NO![]() 、Al3+
、Al3+
14、下列离子方程式书写正确的是( )
A、等体积等物质的量浓度的氢氧化钡稀溶液与碳酸氢铵稀溶液混合
Ba2++OH一+HCO3一=BaCO3↓+H2O
B.氯化铝溶液中加入过量的氨水
A13++4NH3·H2O=4NH4++A1O2-+2H2O
C. 向次氯酸钙溶液中通人过量的二氧化硫
Ca2++2C1O一+SO2+H2O=CaSO3↓+2HClO
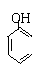 D.
碳酸钠溶液中加入过量的苯酚
D.
碳酸钠溶液中加入过量的苯酚
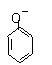 |
+CO32-→ +HCO3-
15、在反应:11P+15CuSO4+24H2O=5Cu3P+6H3PO4+15H2SO4 中,7.5mol CuSO4可氧化的P 原子的物质的量为( )
A.1.5mol B.5.5mol C.3mol D.2.5mol
16.实验是研究化学的基础,下图中所示的实验方法、装置或操作完全正确的是( )
A.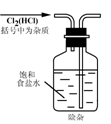 B.
B.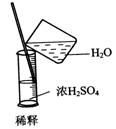
C.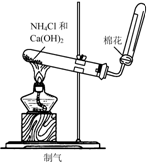 D.
D.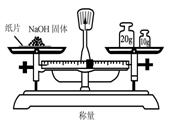
17、在常温下,发生下列几种反应:
① 16H++10Z一+2XO4一=2X2++5Z2+8H2O ② 2A2++B2=2A3++2B一 ③2B一+Z2=B2+2Z一根据上述反应,判断下列结论中错误的是( )
A. 溶液中可发生:Z2+2A2+=2A3++2Z一 B.Z2在①、③反应中为还原剂
C.氧化性强弱的顺序为:XO4一>Z2>B2>A3+ D.X2十是XO4一的还原产物
18、炽热的炉膛内有反应:C(s) + O2(g) == CO2(g);△H=-393.5KJ/mol,往炉膛内通入水蒸气时,有如下反应:C(s) + H2O(g) == H2(g) + CO(g);△H=+131KJ/mol,
CO(g) + O2(g) == CO2(g);△H=-283KJ/mol,
H2(g) + O2(g) == H2O(g);△H=-241.5KJ/mol,
由以上反应推断往炽热的炉膛内通入水蒸气时( )
A.不能节省燃料,但能使炉火瞬间更旺
B.虽不能使炉火瞬间更旺,但可以节省燃料
C.既能使炉火瞬间更旺,又能节省燃料
D.既不能使炉火瞬间更旺,又不能节省燃料
(以上选择题答案务必答在第Ⅱ卷的答题栏中,否则不得分)
 长葛三高2007-2008学年第一次月考试卷
长葛三高2007-2008学年第一次月考试卷
高三化学
选择题答题表:
一、选择题:(本题包括18小题,每小题3分,共54分,每小题只有一个正确答案)
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 |
| 答案 |
|
|
|
|
|
|
|
|
|
| 题号 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 |
| 答案 |
|
|
|
|
|
|
|
|
|
第II卷(非选择题,共46分)
二、填空题:(本题包括6小题,共46分)
19.(4分)有一环保汽车,是以氢气作燃料的,请按题目要求作答:
(1)氢气在发动机内燃烧过程中,生成物只有水蒸气,不会使空气中的________含量偏高,因而能减缓温室效应现象的发生.
(2)如果每mol氢气燃烧后生成水蒸气并放出241.8kJ的热量,写出氢气燃烧的热化学方程式
20、(6分)有一瓶澄清透明溶液,可能含有NH4+、Fe2+、Fe3+、Ba2+、Al3+、SO42-、HCO3-、NO3-、C1-中的一种或几种。取该溶液进行以下实验:
(1) 溶液滴在蓝色石蕊试纸上,试纸呈红色;
(2) 取部分溶液浓缩后加入铜片和浓硫酸共热,有红棕色气体生成;
(3) 取少量溶液,加入硝酸酸化的氯化钡溶液,产生白色沉淀;
(4) 将(3)中的沉淀滤出,滤液中加入硝酸银溶液,生成白色沉淀;
(5) 另取部分溶液,逐滴加入稀NaOH溶液,使溶液从酸性逐渐转变为碱性,在滴加过程先看到生成沉淀,随之沉淀部分溶解,并呈红褐色。
根据上述实验事实确定:在该溶液中肯定存在的离子是 ,肯定不存在的离子是 ,不能确定是否存在的离子是 。
21. (10分)已知NaNO2能发生如下反应: 2NaNO2+4HI=2NO+I2+2NaI+2H2O。
(1)上述反应的氧化剂是 。若有0.75mo1的还原剂被氧化,则被还原的氧化剂是 mol。
(2)NaNO2有像食盐一样的咸味,误食会使人中毒,可以用试剂和生活中常见的物质进行实验鉴别NaNO2和 NaCl,现有物质①自来水 ②碘化钾一淀粉试纸 ③淀粉 ④白糖 ⑤食醋 ⑥白酒,在进行实验时,必须选用的物质有 (填编号)。
(3)某厂废液中含2%的NaNO2,直接排放会造成污染,下列试剂中: ①NaCl
②NH4C1 ③H2O2 ④浓H2SO4 能使NaNO2转化为不引起二次污染物质N2的是 (填编号),反应的化学方程式为 。
22.(8分) 在50mL 0.2mol/L的硫酸铜溶液中插入两个电极,通电电解(不考虑水分蒸发),则:⑴若两极均为铜片,试说明电解过程中溶液溶质浓度将怎样变化 。
⑵若阳极为纯锌,阴极为铜片,阳极反应式是
⑶如果两极均为铜片且不考虑H+在阴极上放电当电路中有0.01mol电子
通过时,阴极增重______________g,阴极上的电极反应式是 。
23.(8分)电解原理在化学工业中有广泛应用。右图表示一个电解池,装有电解液![]() ;X、Y是两块电极板,通过导线与直流电源相连。请回答以下问题:
;X、Y是两块电极板,通过导线与直流电源相连。请回答以下问题:
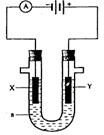 (1)若X、Y都是惰性电极,
(1)若X、Y都是惰性电极,![]() 是饱和NaCl溶液,实验开始时,同时在两边各滴入几滴酚酞试液,则①电解池中X极上的电极反应式为__________。在X极附近观察到的现象是__________。
是饱和NaCl溶液,实验开始时,同时在两边各滴入几滴酚酞试液,则①电解池中X极上的电极反应式为__________。在X极附近观察到的现象是__________。
②Y电极上的电极反应式为_________,检验该电极反应产物的方法是 __________。
(2)如用电解方法精炼粗铜,电解液a选用CuSO4溶液,则
①X电极的材料是_______,电极反应式为__________。
②Y电极的材料是_______,电极反应式为___________。
(说明:杂质发生的电极反应不必写出)
24.(10分)下图表示各物质之间的转化关系。已知:A、B、I都是XY2型化合物,且阳离子相同,A、B晶体中阴、阳离子个数比都是1∶1,但I晶体中阴、阳离子个数比是2∶1,I常用作干燥剂。
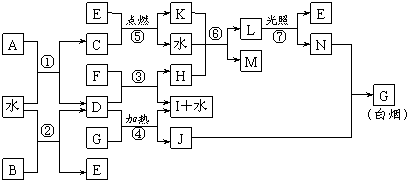 |
请按要求填空:
⑴G的电子式是_______________;
⑵反应⑥的化学方程式是__________________________________,反应⑤在空气中发生时的现象是________________________________,已知C的燃烧热是1300 kJ·mol-1,表示C的燃烧热的热化学方程式是________________________________________。
⑶根据上图中物质之间的转化关系及题中所给信息判断,B的化学式是_________。
高三化学参考答案
一、选择题:(本题包括18小题,每小题3分,共54分,每小题只有一个正确答案)
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 |
| 答案 | C | C | A | D | D | A | C | A | D |
| 题号 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 |
| 答案 | C | A | D | B | D | A | C | B | A |
二、填空题:(本题包括6小题,共46分)
19.(4分)CO2,
2H2(g)+O2(g)=2H2O(g); △H=-483.6kJ/mol
20.(6分)Fe3+、NO3-、Al3+、SO42-;
HCO3-、Ba2+、Fe2+;
NH4+、C1-
21.(10分) (1) NaNO2 0.75mo1
(2) ②⑤
(3) ② NH4Cl + NaNO2 ==N2 ↑+ NaCl + 2H2O
22.(共8分)(1)不变
(2) Zn -2e-=Zn2+
(3) 0.32 Cu2+ +2e-=Cu
23.(8分)每空1分 (1)①2H++2e-=H2↑ 放出气体,溶液变红。
② 2Cl--2e-=Cl2↑ 把湿润的碘化钾淀粉试纸放在Y电极附近,试纸变蓝色。
(2)①纯铜 Cu2++2e-==Cu ②粗铜 Cu-2e-=Cu2+
24.⑴![]() ⑵Ca(ClO)2+CO2+H2O=CaCO3+2HClO 火焰明亮并伴有浓烈黑烟 CH≡CH(g)+
⑵Ca(ClO)2+CO2+H2O=CaCO3+2HClO 火焰明亮并伴有浓烈黑烟 CH≡CH(g)+![]() O2(g)→2CO2(g)+H2O(l);ΔH=-1300 kJ·mol-1(热化学方程式中数据与本答案不同不给分) ⑶CaO2
(每空2分,共10分。)
O2(g)→2CO2(g)+H2O(l);ΔH=-1300 kJ·mol-1(热化学方程式中数据与本答案不同不给分) ⑶CaO2
(每空2分,共10分。)