高三化学第一学期期中试题
高三化学试题
原子量:C: 12 H: 1 Na: 23 Cl: 35.5 Cu: 64 K: 39 S: 32 O: 16 Fe: 56
一、选择题(每小题只有一个选项符合题意,每题3分)
1.核磁共振(NMR)技术已广泛应用于复杂分子结构的测定和医学诊断等高科技领域。已知只有质子数或中子数为奇数的原子核有NMR现象。试判断下列哪组原子均可产生NMR现象
A.18O 31P 119Sn B.27Al 19F 12C
C.元素周期表中VA族所有元素的原子 D.元素周期表中第I周期所有元素的原子
2.Na2Sx在碱性溶液中可被NaClO氧化为Na2SO4,而NaClO被还原为NaCl,若反应中Na2Sx与NaClO的物质的量之比为1∶16,则x值是
A.2 B.3 C.4 D.5
3.分别取80℃的等质量的甲、乙两种化合物的饱和溶液,降温至20℃后,所析出的甲的质量比乙的大(甲和乙均无结晶水),下列关于甲、乙溶解度的叙述中肯定正确的是
A.20℃时乙的溶解度比甲大 B.80℃时甲的溶解度比乙大
C.温度对乙的溶解度影响较大 D.温度对甲的溶解度影响较大
4.某原子的4d亚层中有1个电子,其第五电子层中共有的电子数为
A.0 B.2 C.3 D.8
5.有M、R两种主族元素,已知M![]() 离子与R
离子与R![]() 离子核外电子数之和为20,则下列说法不正确的是
离子核外电子数之和为20,则下列说法不正确的是
A.M与R的质子数之和一定等于19 B.M、R可能分别处于第二周期和第三周期
C.M、R可能分别处于第三周期和第二周期 D.M和R的质子数之差可能等于7
6.下列叙述正确的是
A.共价化合物中原子都一定满足最外层8电子结构
B.通过共价键形成的分子一定是共价化合物
C.共价化合物中可能含有离子键
D.粒子间通过共价键形成的晶体,具有较高的熔、沸点
7.具有如下电子层结构的原子,其相应元素一定属于同一主族的是
A.3p亚层上有2个未成对电子的原子和4p亚层上有2个未成对电子的原子
B.3p亚层上只有1个空轨道的原子和4p亚层上只有1个空轨道的原子
C.最外层电子排布为1s2的原子和最外层电子排布为2s22p6的原子
D.最外层电子排布为1s2的原子和最外层电子排布为2s2的原子
8.目前普遍认为,质子和中子都是由被称为u夸克和d夸克的两类夸克组成,u夸克带电量为![]() e,d夸克带电量
e,d夸克带电量![]() e,e为基元电荷。下列论断可能正确的是
e,e为基元电荷。下列论断可能正确的是
A.质子由1个u夸克和1个d夸克组成,中子由1个u夸克和2个d夸克组成
B.质子由2个u夸克和1个d夸克组成,中子由1个u夸克和2个d夸克组成
C.质子由1个u夸克和2个d夸克组成,中子由2个u夸克和1个d夸克组成
D.质子由2个u夸克和1个d夸克组成,中子由1个u夸克和1个d夸克组成
9.水的状态除了气、液和固态外,还有玻璃态,它是由液态水急速冷却到165K时形成的,玻璃态的水无固定形状,不存在晶体结构,且密度与普通液态水的密度相同,有关玻璃态水的叙述正确的是
A.水由液态变为玻璃态,体积缩小 B.水由液态变为玻璃态,体积膨胀
C.玻璃态是水的一种特殊状态 D.玻璃态水是分子晶体
10.CO2、BF3、CCl4都是非极性分子,NH3、H2S都是极性分子,由此可推出ABn型分子是非极性分子的经验规律,正确的是
A.所有原子在同一平面内 B.分子中不含有氢原子
C.A的化合价等于主族序数(n>1) D.A的相对原子质量小于B
二、选择题(每小题有一个或二个选项符合题意,每题4分)
11.下列说法正确的是
A.1mol冰醋酸中含有6.02×1023个CH3COO-
B.标准状况下,含4molHCl的浓盐酸与足量MnO2反应可生成22.4LCl2
C.同温同压下,两种气体物质的量之比等于密度比
D.同温同压下,两种气体的摩尔质量之比等于密度比
12.下列离子方程式书写正确的是
A.碳酸氢钠溶液中加入过量的氢氧化钠溶液:![]()
B.氯化铁溶液中通入硫化氢气体:![]()
C.次氯酸钙溶液中通入过量二氧化碳:
![]()
D.氯化亚铁溶液中加入硝酸:![]()
13.室温下,某溶液中水电离出的![]() 和
和![]() 乘积为
乘积为![]() ,该溶液 一定不能大量共存是
,该溶液 一定不能大量共存是
A.![]() 、
、![]() 、
、![]() B.
B.![]() 、
、![]() 、
、![]()
C.![]() 、
、![]() 、
、![]() D.
D.![]() 、
、![]() 、
、![]()
14.物质氧化性、还原性的强弱,不仅与物质的结构有关,还与物质的浓度和反应温度等有关。下列各组物质由于浓度不同而能发生不同氧化还原反应的是
A.Cu与HNO3溶液 B.Cu与FeCl3溶液 C.Zn与H2SO4 D.Fe与HCl溶液
15.X、Y、Z三种元素的原子,其最外电子层排布分别为ns1、3s23p1和2s22p4,由这三种元素组成的化合物的化学式可能是
A.XYZ2 B.XYZ3 C.X2YZ2 D.X3YZ3
16.下列关于氢原子电子云图的说法中正确的是
A.黑点密度大,电子数目大
B.黑点密度大,单位体积内电子出现的机会大
C.电子云图是对电子运动无规律性的描述
D.电子云图是用统计方法描述电子运动的结果
17.A、B属于短周期中不同主族的元素,A、B原子的最外层电子中,成对电子和未成对电子占据的轨道数相等,若A元素的原子序数为![]() ,则B元素原子序数为
,则B元素原子序数为
A.![]() B.
B.![]() C.
C.![]() D.
D.![]()
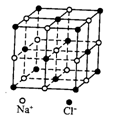 18.用NA表示阿伏加德罗常数,下列说法正确的是
18.用NA表示阿伏加德罗常数,下列说法正确的是
A.乙烯和丙烯的混合物1.4g中含有0.1NA个碳原子
B.6.8g熔融的KHSO4中含有0.1NA个阳离子
C.23.4gNaCl晶体中含有0.1NA个如图所示的结构单元
D.电解精炼铜时转移0.1NA个电子时阳极溶解3.2g铜
19.科学家发现铂的两种化合物a和b。
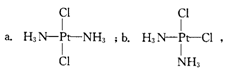
实验测得a和b具有不同的特性。A具
有抗癌作用,而b没有,则下列关于a、b的叙述正确的是
A.a和b属于同一种物质 B.a和b互为同分异构体
C.a和b的空间构型是平面四边形 D.a和b的空间构型是四面体
20.固体A的化学式为NH5,能跟水反应,它的所有原子的电子层结构都跟该原子同周期的稀有气体原子一样,则下列说法中,不正确的是
A.1molNH5中有5NA个N—H键(NA为阿伏加德罗常数)
B.NH5中既有共价键,又有离子键,是离子晶体
C.NH5跟水反应是氧化还原反应
D.NH5跟水反应的化学方程式为:![]()
三、实验题
21.(4分)现有下列仪器和用品:①托盘天平 ②玻璃棒 ③烧杯 ④量筒 ⑤铁架台
⑥铁圈 ⑦滤纸 ⑧胶头滴管,进行过滤操作需用以上仪器和用品中的_______,还缺少的仪器是________;若要用NaOH固体配制0.5mol/L NaOH溶液一定要用到的仪器有__________,还需增加的玻璃仪器是_____________。
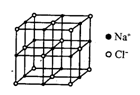 22.(11分)随着科学技术的发展,阿伏加德罗常数测定手段越来越多,测定精确度也越来越高,现有一种简单可行的测定方法,具体步骤为:
22.(11分)随着科学技术的发展,阿伏加德罗常数测定手段越来越多,测定精确度也越来越高,现有一种简单可行的测定方法,具体步骤为:
(1)将固体NaCl研细、干燥后,准确称取mg NaCl固体并转移到定容仪器A中。
(2)用滴定管向A仪器中滴加苯,不断振荡,继续加苯至A仪器的刻度线,计算出NaCl固体的体积为Vcm3。
①步聚(1)中A仪器最好用________(仪器名称)。
②步骤(2)中用酸式滴定管好还是碱式滴定管好,_______;理由是__________。
③能否用胶头滴管代替步骤(2)中的滴定管;理由是____________________。
④能否用水代替苯________;理由是_____________________________________。
⑤已知NaCl晶体的结构如图所示,用X射线测得NaCl晶体靠得最近的![]() 与
与![]() 间的平均距离为a cm,则用上述测定方法测得阿伏加德罗常数NA的表达式为NA=_______________。
间的平均距离为a cm,则用上述测定方法测得阿伏加德罗常数NA的表达式为NA=_______________。
23.(20分)用废铁屑与稀硫酸反应,可制得硫酸亚铁。在10℃和50℃时,FeSO4在100g水中的溶解度分别为20.5g和48.6g。常温下,从溶液析出的晶体是FeSO4·7H2O。现取200mL 0.500mol/L H2SO4溶液,将8.00g废铁屑加入到上述稀H2SO4中,并不断搅拌,反应约15min后过滤。滤液在80℃经蒸发、浓缩,冷却至10℃后析出FeSO4·7H2O晶体。
(1)若加入的废铁不是粉状而是块状,对反应的影响是__________。
A.会降低反应速率 B.会减少绿矾产量
C.需要加热才反应 D.将增大反应体系的pH
(2)反应15min后过滤,其目的是___________________。
(3)滤液中除FeSO4和可能未反应完全的H2SO4外,最可能存在的无机杂质是____。它是由_________而产生的,其检测的方法是_______________。
(4)设H2SO4与铁完全反应,当将滤液蒸发浓缩后,冷却至50℃时,溶液的体积约为50.0mL,该溶液是否达饱和?试通过计算加以说明。(50℃时,FeSO4饱和溶液的密度为1.36g/cm3)
(5)若要计算在80℃下将溶液蒸发至体积为70.0mL,再冷却至10℃时,所得到的FeSO4·7H2O的质量,你认为_________(填编号)。
A.前面提供的数据已经足够
B.还需要提供10℃时饱和溶液的密度:1.42g/cm3
C.还需要提供80℃时溶液的密度:1.30g/cm3
D.还需要提供结晶后剩余溶液的体积:52.0mL
(6)根据第(5)小题你的选择项(如选A则直接计算,如选B、C或D则可选用其数据)计算从80℃50.0mL溶液冷却至10℃时结晶析出的FeSO4·7H2O的质量。(计算结果保留3位有效数字)
四、填空题
24.(6分)在世纪交际之时,罗马尼亚国炼金废水泄入多瑙河,导致大量鱼类等水生物死亡,沿河居民已长期停止使用此水源,酿成世界级污染事件。炼金废水中含有络离子[Au(CN)2]-,其电离出的CN-有毒,当与H+结合生成HCN时,其毒性更强。回答下列问题:
(1)剧毒物HCN的结构式为__________,其水溶液酸性很弱,可知NaCN溶液pH______7(填“>”“=”或“<”)。
(2)与弱电解质碳酸的电离方程式相似,[Au(CN)2]-也存在着两步电离,其一级电离方程式是______________。
(3)处理这种废水时,是在碱性条件下用NaClO将CN-氧化为![]() 和N2,其离子方程式为________________。
和N2,其离子方程式为________________。
25.(9分)有一种稀有气体化合物六氟铂酸氙XePtF6,研究报告指出:关于XePtF6的结构有![]() 两种可能,巴特列用不可能参加氧化还原反应的五氟化碘作溶剂,将XePtF6溶解,然后在此溶液中加入RbF可得到RbPtF6:加入CsF可得到CsPtF6,这些化合物都不溶于CCl4等非极性溶剂。试回答:
两种可能,巴特列用不可能参加氧化还原反应的五氟化碘作溶剂,将XePtF6溶解,然后在此溶液中加入RbF可得到RbPtF6:加入CsF可得到CsPtF6,这些化合物都不溶于CCl4等非极性溶剂。试回答:
(1)XePtF6中各元素的化合价分别是__________________。
(2)XePtF6是__________(填“离子”或“共价”)化合物。
(3)写出Xe与PtF6反应生成XePtF6的反应式:__________;而且O2与PtF6可发生类似的反应,其反应式是_______________。上述两反应属______________。
a. 均为氧化还原反应 b. 前者是氧化还原反应,后者是非氧化还原反应
c. 均为非氧化还原反应
26.(6分)W、X、Y、Z四种短周期元素的原子序数X>W>Z>Y。W原子的最外层没有p电子,X原子核外s电子与p电子数之比为1∶1, Y原子最外层s电子与p电子数之比为1∶1, Z原子核外电子中p电子数比Y原子多2个。
(1)W元素的单质与H2O反应离子方程式_________________________________。
(2)W、X元素的最高价氧化物对应水化物的碱性强弱为________<_______(用分子式表示)。这四种元素原子半径的大小为_____>_____>_____>____(填元素符号)。
27.(8分)元素的原子在分子中吸引电子的能力可以用电负性x 表示。下表是某些短周期元素的x值:
| 元素符号 | x值 | 元素符号 | x值 |
| Li | 0.98 | Be | 1.57 |
| B | 2.04 | C | 2.55 |
| N | 3.04 | O | 3.44 |
| F | 3.98 | Na | 0.93 |
| Mg | 1.31 | Al | 1.61 |
| P | 2.19 | S | 2.58 |
(1)根据表中数据归纳元素的电负性与原子吸引电子的能力的关系_________。
(2)试推测,周期表所列元素中除放射性元素外,电负性最小的元素与电负性最大的元素形成的化合物的电子式为___________。
(3)若NCl3最初水解产物是NH3和HClO,则x(Cl)的最小范围:_____<x(Cl)<____(填表中数值);若已知x(P)<x(Cl),则PCl3水解的化学反应方程式是_______。
28.(8分)现代原子结构理论主为,在同一电子层上,可有s、p、d、f、g、h……等亚层,各亚层分别有1、3、5……个轨道。试根据电子填入轨道的顺序预测:
(1)第8周期共有____________种元素;
(2)原子核外出现第一个6f电子的元素的原子序数是________。
(3)根据“稳定岛”假说,第114号元素是一种稳定同位素,半衰期很长,可能在自然界都可以找到。试推测第114号元素属于_________周期,_________族元素,原子的外围电子构型是__________。
29.(8分)某核素R具有微弱放射性,其原子核内中子数比质子数多43。由它组成的固体单质A,在一定条件下密度为![]() 。用X射线研究其固体表明:在边长为
。用X射线研究其固体表明:在边长为![]() cm的立方体中含有20个原子。R在化学反应中常表现为
cm的立方体中含有20个原子。R在化学反应中常表现为![]() 价、
价、![]() 价,在溶液中
价,在溶液中![]() 稳定,而
稳定,而![]() 具有强氧化性,可将NO氧化为HNO3。氧化物R3O4的性质与Fe3O4有些类似。R的另一种质量数比R少2的同位素较为稳定,与铁可形成合金,在潮湿的环境中易形成铁锈。R的单质及化合物在工业生产、医疗卫生、科学技术等各个领域都有很多用途,请回答:
具有强氧化性,可将NO氧化为HNO3。氧化物R3O4的性质与Fe3O4有些类似。R的另一种质量数比R少2的同位素较为稳定,与铁可形成合金,在潮湿的环境中易形成铁锈。R的单质及化合物在工业生产、医疗卫生、科学技术等各个领域都有很多用途,请回答:
(1)R原子的摩尔质量为______________。
(2)R元素处于周期表中第_________周期_________族。
(3)使少量![]() 加到FeCl2溶液中,会发生反应,其离子方程式为________________。
加到FeCl2溶液中,会发生反应,其离子方程式为________________。
(4)R3O4因具有氧化性,被大量用于油漆涂料,涂在钢铁表面,有利于形成耐腐蚀的钝化层。R3O4与定量的HNO3反应,生成R的氧化物、R的硝酸盐和水三种物质。此反应的方程式为____________________________________。
高三化学试题答题卷
班别____________ 姓名_____________ 座号 ___________ 评分 _________
三、实验题
21.(4分)_______________,_______________;_______________,___________。
22.(11分)①_______________。②___________;_________________________________
___________________。③_________,________________________________________。
④________________;___________________________________________________。
⑤NA=________________________________。
23.(1)______________。(2)_________________________________________________。
(3)__________,______________________________;__________________________
________________________________________________________。
(4)
(5)_________。
(6)
四、填空题
24.(6分)(1)_______________,____________。(2)___________________________。
(3)____________________________________________________________________。
25.(9分)(1)______________________。(2)_____________________________。
(3)_________________________________________;________________________;
________________。
26.(6分)(1)______________________________________________________________。
(2)_____________<______________, _________>________>__________>_________。
27.(1)__________________________________________________。(2)____________。
(3)________, ________, ________________________________________________。
28.(8分)(1)_______________________。(2)____________________________。
(3)____________________,______________________,_______________________。
29.(1)___________________。(2)____________________, _____________________。
(3)____________________________________________________________________。
(4)____________________________________________________________________。
高三化学试题参考答案
一、二、选择题
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| 答案 | C | D | D | B | D | D | B | B | C | C |
| 题号 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 |
| 答案 | D | AD | BD | AC | AD | BD | BC | AC | BC | A |
21.答案:②③⑤⑥⑦; 漏斗;①②③⑧;容量瓶。
22.解析:⑤![]()
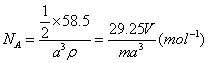
答案:①容量瓶 ②酸式 苯通常溶解碱式滴定管的橡皮管 ③不能 实验中需要准确量取苯的体积 ④不能 NaCl易溶于水,如用水,则不能准确测出NaCl的体积 ⑤![]()
23.(1)AB;
(2)除去过量的铁屑;
(3)Fe2(SO4)3,FeSO4被空气氧化生成Fe2(SO4)3,取少许滤液,加入KSCN溶液,观察溶液是否变血红色。
(4)设反应后饱和溶液体积V。
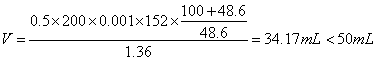
所以,蒸发后溶液尚未饱和。
(5)C
(6)⑤中所给80℃时,50.0mL溶液中含溶剂水质量为
![]()
设析出的![]() 的质量为
的质量为![]()
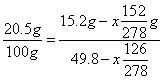
![]()
24.(1)![]() >
>
(2)![]()
(3)![]()
25.(1)![]()
(2)离子
(3)![]()
![]()
![]()
26.(1)![]()
![]()
(2)![]()
![]() >
>![]() >
>![]() >
>![]()
27.(1)元素的电负性越大,原子吸引电子的能力越强
![]()
(2)
(3)2.58 3.04 ![]()
28.(1)50
(2)139
(3)七 IV A 7S27P2
29.(1)![]()
(2)六 IV A
(3)![]()
(4)![]()
![]()