高三化学第一学期期中调研测试
化学试卷
本试卷分试题卷和答题卡两部分。试题卷1至8页。共150分。考试时间120分钟。
第Ⅰ卷(选择题,共64 分)
注意事项:
1、答卷前,考生务必将本人的学校、班级、姓名、考试号填在答题卷的密封线内。
2、将答案填在答题卷相应的位置上。在试卷上答题无效。
3.考试结束,请将答题卷和答题卡一并交给监考人员。
可能用到的相对原子质量:
H:1 C:12 N:14 O:16 Na:23 S:32 Mg :24 Ba:137
一、选择题(本题包括8小题,每小题4分,共32分。每小题只有一个选项符合题意。)
 1.2006年6月5日是第35个世界环境日,我国环保总局确定的主题见右图。下列措施不符合这一主题的是
1.2006年6月5日是第35个世界环境日,我国环保总局确定的主题见右图。下列措施不符合这一主题的是
A.用“绿色化学”工艺,使原料尽可能转化为所需要的物质
B.回收废电池,减少对环境的污染
C.为使农作物高产,大量施用化肥和农药
D.推广垃圾分类存放,分类回收,分类处理
2.分类方法在化学学科的发展中起到了非常重要的作用。下列分类标准合理的是
① 根据酸分子中含有的H原子个数将酸分为一元酸、二元酸等
② 根据反应中是否有电子的转移将化学反应分为氧化还原反应和非氧化还原反应
③ 根据分散系是否具有丁达尔现象将分散系分为溶液、胶体和浊液
④ 根据反应中的热效应将化学反应分为放热反应和吸热反应
A.①③ B.②④ C.①②④ D.②③④
3.下列说法错误的是
A.胶体能发生电泳现象是由于胶体粒子带电
B.治疗肾功能衰竭等疾病,常将病人的血液进行透析,透析的原理与渗析相似
C.纯铁的熔点比生铁的高
D.常温下浓硫酸可贮存于铁制或铝制容器中,说明常温下铁和铝与浓硫酸不反应
4.下列反应的离子方程式表示正确的是
A.澄清石灰水中通入过量二氧化碳:OH-+ CO2 = HCO3-
B.铜片跟三氯化铁溶液反应:Fe3+ + Cu = Cu2+ + Fe2+
C.碳酸钙跟醋酸反应:CaCO3 + 2H+ = Ca2+ + H2O + CO2↑
D.Fe3O4与稀HNO3反应:Fe3O4 + 8H+ = Fe2+ + 2Fe3+ + 4H2O
 5.最近意大利罗马大学的FulvioCacace等人获得了极具理论研究意义的N4分子。N4分子结构如右图所示,下列说法正确的是
5.最近意大利罗马大学的FulvioCacace等人获得了极具理论研究意义的N4分子。N4分子结构如右图所示,下列说法正确的是
A.N4属于一种新型的化合物 B.N4转化为N2属于物理变化
C.N4沸点比P4(白磷)高 D.N4与N2互为同素异形体
6.阿伏加德罗常数约为6.02×1023 mol-1,下列说法中正确的是
A.1 L 0.1 mol/L的CH3COOH中H+的数目等于6.02×1022
B.7.8 g Na2O2固体中含阴离子的数目为6.02×1022
C.标准状况下,11.2 L 四氯化碳中所含分子数为3.01×1023
D.l mol SiO2固体中含有Si-O键的数目为1.204×1024
7.室温下,在一定体积某浓度的Ba(NO3)2溶液中,逐滴加入pH=1的稀硫酸至溶液中的Ba2+恰好完全沉淀时,测得溶液pH=2,若忽略两溶液混合时的体积变化,则稀硫酸的体积与Ba(NO3)2溶液的体积比是
A.10∶1 B.1∶10 C.9∶1 D.1∶9
8.将饱和硫酸铜溶液分成两等份,一份维持温度不变加入少量无水硫酸铜粉未,另一份升温至50 ℃,在这两种情况下均保持不变的是
A.硫酸铜的溶解度 B.溶液的质量
C.溶液中溶质的质量分数 D.溶液中Cu![]() 的数目
的数目
二、选择题(本题包括8小题,每小题4分,共32分。每小题有一个或两个选项符合题意。若正确答案只包括一个选项,多选时,该小题为0分;若正确答案包括两个选项,只选一个且正确的给2分,选两个且都正确的给满分,但只要选错一个该小题就为0分。)
9.合成氨工业对国民经济和社会发展具有重要的意义。哈伯法合成氨需要20~50 MPa的高压和500℃的高温,用铁作为催化剂。最近美国俄勒冈大学的化学家使用了一种名为trans-Fe(DMeOPrPE)2的催化剂,在常温下用氮气和氢气合成出氨。下列说法正确的是
A.哈伯法合成氨是吸热反应,新法合成氨是放热反应
B.新法合成比哈伯法合成,能节约能源,具有很好的发展前景
C.新法合成能在常温下进行是因为不需要断裂化学键
D.新的催化剂降低了反应的活化能,提高了活化分子百分数
10.某一无色溶液,若向其中加入铝粉,有气体放出,则该溶液可能大量存在的一组离子是
A.Fe2+、H+、NO3-、Na+ B.OH-、Br-、SO42-、Na+
C.SO42-、Br-、OH-、Fe3+ D.H+、Br-、CO32-、K+
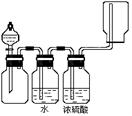 11.下图装置可以用来发生、干燥、收集(不考虑尾气处理)气体。该装置适用于
11.下图装置可以用来发生、干燥、收集(不考虑尾气处理)气体。该装置适用于
A.锌和盐酸生成氢气
B.高锰酸钾和浓盐酸生成氯气
C.生石灰与和浓氨水生成氨气
D.过氧化钠和水生成氧气
12.已知:101 k Pa时辛烷的燃烧热为5518 kJ · mol—1,强酸和强碱在稀溶液中发生反应时的中和热为57.3 kJ · mol-1,则下列热化学方程式书写正确的是
① 2C8H18( l ) + 25O2(g) = 16CO2(g) + 18H2O(g);△H = -11 036 kJ · mol-1
②2C8H18( l ) + 25O2(g) = 16CO2(g) + 18H2O(l);△H = -11 036 kJ· mol-1
③ H+ + OH- = H2O;△H = -57.3 kJ · mol-1
④ 2NaOH(aq) + H2SO4(aq) = Na2SO4(aq) +2 H2O( l );△H = -114.6 kJ · mol-1
A.①③ B.②③ C.②④ D.只有②
13.我国镍氢电池居世界先进水平,国产大功率镍氢动力电池已广泛用于我海军潜艇。常见镍氢电池的某极是储氢合金LaNi5,电池的总反应为:LaNi5H6
+ 6NiO(OH) ![]() LaNi5 + 6Ni(OH)2(LaNi5H6中各元素化合价均为零),下列说法正确的是
LaNi5 + 6Ni(OH)2(LaNi5H6中各元素化合价均为零),下列说法正确的是
A.放电时储氢合金作正极
B.充电时储氢合金作阴极
C.放电时,电子由负极通过外电路流向正极
D.充电时阴极反应:Ni(OH)2 + OH――e-= NiO(OH)+H2O
14.下列实验中,最终溶液颜色有明显变化的是
A.往NaOH溶液中加入少量明矾溶液
B.往FeCl3溶液中滴入KI溶液,再滴入淀粉溶液
C.往FeSO4溶液中滴入少量KSCN溶液
D.往NaHSO3溶液中加入少量Na2O2固体
15.铝分别与足量的稀硫酸和氢氧化钠溶液反应,当两个反应放出的气体在相同状况下体积相等时,反应中消耗的H2SO4和NaOH的物质的量之比为
A.1∶1 B.2∶1 C.3∶2 D.2∶3
16.室温下,在25 mL 0.1 mol/LNaOH溶液中逐滴加入0.2 mol/L CH3COOH溶液,
曲线如下图所示,若忽略两溶液混合时的体积变化,有关粒子浓度关系比较错误的是
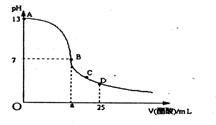 A.在A、B间任一点,溶液中一定都有
A.在A、B间任一点,溶液中一定都有
c(Na+)+ c(H+)= c(CH3COO-)+c(OH-)
B.在B点:a>12.5,且有
c(Na+)=c(CH3COO-)>c(OH-)=c(H+)
C.在C点:c(Na+)>c(CH3COO-) >c(H+)>c(OH-)
D.在D点:c(CH3COO-)+c(CH3COOH)= 0.2 mol/L
第Ⅱ卷(非选择题,共86分)
三、(本题包括3小题,共23分)
17.(4分)下列有关化学实验的基本操作及安全知识的叙述,错误的是 (填序号)。
A.用托盘天平称取10.50 g干燥的NaCl固体
B.过滤时,玻璃棒靠在三层滤纸边沿稍下方,
C.测定烧杯中溶液的pH时,用pH试纸直接在烧杯中蘸取溶液
D.中和热的测定实验中,可用金属丝(棒)代替环形玻璃棒
E.配制浓硫酸和浓硝酸的混合酸时,将浓硫酸沿器壁慢慢加入到浓硝酸中,并不断搅拌
F.实验时,不慎打翻燃着的酒精灯,可立即用湿抹布盖灭火焰
G.采取降温结晶可以提纯混有少量氯化钠的硝酸钾
H.配制一定浓度的溶液时,若定容时不小心加水超过容量瓶的刻度线,应立即用滴管吸去多余的部分。
18.(9分)现行高中化学教材(必修加选修)中对铝与氧化铁发生的“铝热反应”的现象有这样的描述:“反应放出大量的热,并发出耀眼的光芒。”“纸漏斗的下部被烧穿,有熔融物落入沙中。”
(1)写出上述“铝热反应”的化学方程式__________________________________
(2)完成下列探究方案:
猜想:熔融物的主要成分可能是铁铝合金
探究过程:
| 实验步骤 | 实验现象 | 主要化学方程式 |
19.(10分)KMnO4溶液常用做氧化还原反应滴定的标准液,由于KMnO4的强氧化性,它的溶液易被空气中或水中某些少量还原性物质还原,生成难溶性物质MnO(OH)2,因此精确配制KMnO4标准溶液的操作是:(1)称取稍多于所需量的KMnO4固体溶于水,将溶液加热并保持微沸1 h;(2)用微孔玻璃漏斗过滤除去难溶的MnO(OH)2;(3)过滤得到的KMnO4溶液贮存于棕色试剂瓶放在暗处;(4)利用氧化还原滴定方法,在700C-800C条件下用基准试剂(纯度高、稳定性好的物质)溶液测定其浓度。回答下列问题:
(1)为什么要称取稍多于所需的KMnO4固体?________________________________
(2)为什么不用普通滤纸过滤器过滤?________________________________________
(3)如何保证在70℃~80℃条件下进行滴定操作:______________________________
(4)下列物质中,可以用于测定KMnO4溶液浓度的基准试剂是_______
A.H2C2O4•2H2O B.FeSO4•7H2O C.浓盐酸 D.Na2SO3
(5)若准确称取W g草酸晶体(H2C2O4•2H2O)溶于水配成500 mL水溶液,取25.00 mL置于锥形瓶中,用高锰酸钾溶液滴定至终点,消耗高锰酸钾溶液V mL。
6H++2MnO4-+5H2C2O4•2H2O =2Mn2++10CO2↑+18H2O
问:
①滴定时,高锰酸钾溶液应装在________________;
②滴定终点标志是____________________;
③KMnO4溶液的物质的量浓度为_______________;
④若滴定前平视,滴定后俯视,则测得的浓度值将________(填“偏高”或偏低“)
四、(本题包括2小题,共25分)
20.(13分)现有下列短周期元素性质的有关数据:
| 元素编号 | a | b | c | d | e | f | g | h | i | j |
| 原子半径/pm | 111 | 77 | 70 | 104 | 143 | 99 | 117 | 186 | 160 | 64 |
| 最高化合价或 最低化合价 | +2 | -4 | -3 | +6 | +3 | -1 | +4 | +1 | +2 | -1 |
(1)根据元素周期律确定a至j十种元素在周期表中的位置,将它们的元素编号填入下表相应的空格内。
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 | ||
| 1 | ||||||||||
| 2 | ||||||||||
| 3 | ||||||||||
(2)上述10种元素形成的氢化物中,分子间存在氢键的有(填氢化物的化学式)_____ __。
(3) i在b的氧化物中燃烧的方程式为 。
(4) h和d所形成的化合物的电子式为 。
(5)原子数相同,电子总数相同的分子或离子互称等电子体。在元素周期表中,与碳相邻的两种元素可形成具有石墨型晶体结构的“白石墨”,“白石墨”和石墨具有等电子体特征,画出“白石墨”的最小结构单元的结构式____________。
21.(12分)下图表示各物质之间的转化关系,其中A、B、C、G为单质。②为工业生产中常见反应,E是一种具有漂白作用的盐,Y易潮解,M是一种两性化合物,L是一种白色沉淀。
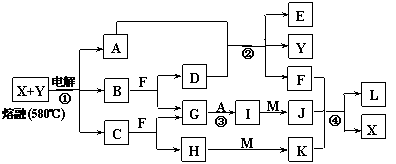 |
试回答下列有关问题:
⑴M的化学式 ,Y在实验室中的用途 (列举一例)。
⑵X的熔点为801℃,实际工业冶炼中常常加入一定量的Y共熔,猜想工业上这样做的目的: 。工业生产中,还常常利用电解X和F的混合物制取 。
⑶反应②的化学方程式是 。
⑷反应④的离子反应方程式是
五、(本题包括2小题,共18分)
22.(8分)(1)肼(N2H4)—空气燃料电池是一种环保型碱性燃料电池,电解质溶液是20%~30%的KOH溶液。肼—空气燃料电池放电时,负极的电极反应式是 ,正极的电极反应式是 。传统制备肼的方法,是以NaClO氧化NH3,制得肼的稀溶液。该反应的离子方程式是 。
(2)金属铌(Nb)能与卤素形成簇状化合物,其特点是六个Nb原子形成八面体骨架,卤原子通过双桥基(-X-)或三桥基(![]() )与Nb原子相连,结构单元之间通过双桥基相连。下图为一种NbaXb的结构单元,试写出该物质的化学式:
)与Nb原子相连,结构单元之间通过双桥基相连。下图为一种NbaXb的结构单元,试写出该物质的化学式:
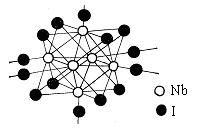 _____________________________________
_____________________________________
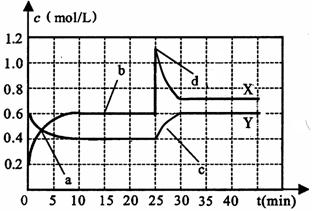
23.(10分)已知NO2和N2O4可以相互转化:2NO2(g)![]() N2O4(g);△H<0。现将一定量NO2和N2O4的混合气体通入一体积为1 L的恒温密闭容器中,反应物浓度随时间变化关系如下图所示。
N2O4(g);△H<0。现将一定量NO2和N2O4的混合气体通入一体积为1 L的恒温密闭容器中,反应物浓度随时间变化关系如下图所示。
 |
根据上图,回答下列问题:
(1)图中共有两条曲线X和Y,其中曲线 表示N2O4浓度随时间的变化;a、b、c、d四个点中,表示化学反应处于平衡状态的点是 。
(2)25 min~30 min内用NO2表示的平均化学反应速率v(NO2)= mol/(L·min);反应进行至25 min时,曲线发生变化的原因是 。
(3)若要达到与最后相同的化学平衡状态,在25 min时还可以采取的措施是 。
A、升高温度 B、缩小容器体积 C、加入催化剂 D、加入一定量的N2O4
六、(本题包括2小题,共20分)
24.(10分)向碳酸镁和硫酸钠的混合物中,加足量盐酸完全溶解后,在标准状况下,收集到0.56 L二氧化碳。向反应后的溶液中加入足量的氢氧化钡溶液,可得到6.11 g沉淀。试求:原混合物中碳酸镁和硫酸钠的质量。
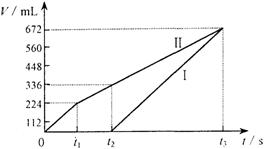 25.(10分)常温下电解200 mL一定浓度的NaCl与CuSO4混合溶液,理论上两极所得气体的体积随时间变化的关系如右图Ⅰ、Ⅱ所示(气体体积已换算成标准状况下的体积),根据图中信息进行下列计算:
25.(10分)常温下电解200 mL一定浓度的NaCl与CuSO4混合溶液,理论上两极所得气体的体积随时间变化的关系如右图Ⅰ、Ⅱ所示(气体体积已换算成标准状况下的体积),根据图中信息进行下列计算:
(1)原混合溶液NaCl和CuSO4的物质的量浓度。
(2)t2时所得溶液的pH。
(3)电解至t3时,消耗水的质量。