高三化学第一学期第二次月考试卷
命题人:黄星
(本试卷共七大题,31小题。满分150分。考试时间120分钟。)
可能用到的相对原子质量: H:1 C:12 N:14 O:16 Na:23 Mg:24 Al:27 S:32 Cl:35.5 K:39 Ca:40 Fe:56 Cu:64 Br:80
一、选择题(本题包括5小题,每小题2分,共10分,每小题只有一个正确答案)
1.用铁片与稀硫酸反应制取氢气时,下列措施不能使氢气的生成速率加快的是 ( )
A.加热 B.滴加少量的CuSO4溶液
C.不用稀硫酸改用98%的浓硫酸 D.不用铁片改用铁粉
2.下列物质不能直接由单质化合得到的是
A.CuCl2 B.FeCl2 C.FeS D.Na2O2
3.“摇摇冰”是一种即用即冷的饮料。吸食时将饮料罐隔离层中的化学物质和水混合后摇动即会制冷。该化学物质是
A.硫酸钡 B.固体硝酸铵 C.固体氢氧化钠 D.生石灰
4.下列变化一定属于化学变化的是
①风化 ②变色 ③燃烧 ④爆炸 ⑤白磷转变成红磷 ⑥工业制氧气 ⑦久置氯水变成无色
A.①②③④ B.①③⑤⑦ C.③④⑤⑦ D.①③④⑦
5.已知NaH和H2O反应生成H2和NaOH,反应中1molNaH
A.失去1mol电子 B.得到1mol电子 C.失去2mol电子 D.没有电子得失
二、选择题(本题包括12小题,每小题3分,共36分,每小题只有一个正确答案)
6.某酒精厂由于管理不善,酒精滴漏到某种化学品上而酿成火灾。该化学品可能是
A.KMnO4 B.NaCl C.(NH4)2SO4 D.CH3COOH
7.已知下列氧化剂均能氧化+4价硫元素,为了除去稀H2SO4中混有的H2SO3,以得到纯净的稀H2SO4,最合理的氧化剂是
A.KMnO4 B.Ca(ClO)2 C.H2O2 D.Cl2
8、将下列选项中的非电解质加入(或通入)氢硫酸溶液后,可使反应后溶液酸性最终增强的是
A .氯气 B .氯化氢水溶液 C .硫酸铜晶体 D .二氧化硫
9.下列叙述中,不正确的是
A.原电池负极上发生的反应是氧化反应
B.失电子能力弱的物质获得电子的能力一定强
C.阳离子在氧化还原反应中,可能表现氧化性,也可能表现还原性
D.氯气分子在反应中,作氧化剂的同时也可能是还原剂
10.在海洋底部存在大量称为“可燃冰”的物质,其蕴藏量是地球上煤、石油的几百倍,因而是一种等待开发的巨大能源物质。初步查明可燃冰是甲烷、乙烷等可燃性气体的水合物。有关可燃冰的下述推测中不正确的是
A.高压、低温有助于可燃冰的形成
B.常温、常压下可燃冰是一种稳定的物质
C.可燃冰的微粒间可能存在一种比范德华力更强的相互作用力
D.构成可燃冰的原子间存在极性共价健
11.用NA表示阿佛加德罗常数,下列说法正确的是
A.常温常压下,1mol碳烯(:CH2)所含电子总数为6NA
B.1molNa2O2溶于水时转移的电子数为NA
C.在标准状况下,含NA个氦原子(He)的氦气所含的分子数是0.5NA
D.1摩Fe完全转化为氢氧化铁胶体溶液中的Fe(OH)3,则胶体中Fe(OH)3胶粒数为NA
12.表示下列变化的化学用语正确的是
![]() A.NaHCO3水解:HCO3-+H2O H3O++CO32-
A.NaHCO3水解:HCO3-+H2O H3O++CO32-
B.金属铝溶于NaOH溶液:Al+2OH-=AlO2-+H2↑
C.钢铁吸氧腐蚀的正极反应:2H2O+ O2+4e=4OH-
D.硫酸与氢氧化钠溶液反应的热化学方程式: H2SO4+2NaOH=Na2SO4+2H2O +114.6 kJ
13.40℃时,等质量的两份饱和石灰水,一份冷却至10℃,另一份加少量CaO并保持温度仍为40℃,这两种情况都不改变的是
A.Ca(OH)2的溶解度 B.溶液的质量 C.溶质的质量分数 D.溶液中Ca2+数目
14.运用元素周期律分析下面的推断。其中错误的是
A.已知Ra是第七周期、IIA族的元素,故Ra(OH)2的碱性比Mg(OH)2的碱性强
B.已知As是第四周期、VA族的元素,故AsH3的稳定比NH3的稳定性强
C.已知Cs的原子半径比Na的大,故Cs与水反应比Na与水反应更剧烈
D.已知Cl的核电荷数比Al的核电荷数大,故 Cl的原子半径比Al的原子半径小
![]() 15.在容积固定的密闭容器中存在如下反应:A(g)+3B(g)
2C(g)+Q (Q﹥0),某研究小组研究了其他条件不变时,改变某一条件对上述反应的影响,并根据实验数据作出下列关系图:下列判断一定错误的是
15.在容积固定的密闭容器中存在如下反应:A(g)+3B(g)
2C(g)+Q (Q﹥0),某研究小组研究了其他条件不变时,改变某一条件对上述反应的影响,并根据实验数据作出下列关系图:下列判断一定错误的是
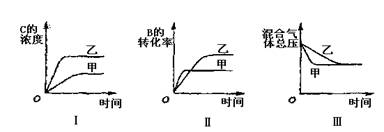
A.图I研究的是不同催化剂对反应的影响,且乙使用的催化剂效率较高
B.图I研究的是压强对反应的影响,且乙的压强较高
C.图II研究的是温度对反应的影响,且甲的温度较高
D.图III研究的是不同催化剂对反应的影响,且甲使用的催化剂效率较高
16.PH值和体积都相等的盐酸、硫酸和醋酸三种溶液分别与足量的小苏打反应,下列有关叙述正确的是
A.硫酸与小苏打反应最剧烈 B.相同条件下,三者产生的气体体积相同
C.醋酸与小苏打反应放出的气体最多 D.盐 酸、醋 酸 与小苏 打反应产生的气体体积相同
17.“茶倍健”牙膏中含有茶多酚,但茶多酚是目前尚不能人工合成的纯天然、多功能、高效能的抗氧化剂和自由基净化剂。其中没食子儿茶素(EGC)的结构如下图所示。关于EGC的下列叙述中正确的是
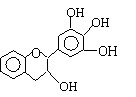 A、分子中所有的原子共一平面
A、分子中所有的原子共一平面
B、1molEGC与4molNaOH恰好完全反应
C、易发生氧化反应和取代反应,难发生加成反应
D、遇FeCl3溶液不发生显色反应
三、选择题(本题包括5小题,每小题4分,共20分,每小题有1一2个正确答案)
18.下列各种溶液中,能大量共存的离子组是
A.pH=1的溶液中:Mg2+、Fe3+、NO3-、[Ag(NH3)2]+
B.[H+]=10-14mol·L-1 的溶液中:Na+,AlO2- ,S2-,SO42-
C.pH=3的溶液中:Mg2+,Fe3+,Cu2+,SO42-
D.使紫色石蕊试液变红色的溶液中:K+,Na+,Ca2+,HCO3-
19.下列反应的离子方程式错误的是
A.等物质的量的Ba(OH)2与NH4HSO4在溶液中反应:
Ba2++2OH—+NH4++H++SO42—==BaSO4↓+NH3·H2O+H2O
B.碳酸钡溶于醋酸溶液BaCO3+2H+ ===Ba2++CO2↑+H2O
C.金属钠与饱和食盐水:Na+2H2O===Na++2OH—+H2↑
D.向碳酸氢钠溶液中滴入过量澄清石灰水:
Ca2++OH—+HCO3—====CaCO3↓+H2O
20..常温下经测定某溶液中离子只有Na+、Ac—、H+、OH―四种,且离子浓度大小的排列顺序为:c(Ac—)>c(Na+)>c(H+)>c(OH―)。其可能的情形是
A、该溶液由pH=3的HAc与pH=11的NaOH溶液等体积混合而成
B、0.2mol/L的HAc溶液与0.1mol/L的NaOH溶液等体积混合
C、在上述溶液中加入适量NaOH,可能使溶液中离子浓度大小改变为:
c(Ac—)>c(Na+) >c(OH—) >c(H+)
D、该溶液由0.1mol/L的HAc溶液与等物质的量浓度等体积的NaOH溶液混合而成
21.在一恒容的容器中充入2molA和1molB发生反应2A(气)+B(气)===XC(气),达到平衡后,C的体积分数为W%。若维持容器中的容积和温度不变,按起始物质的量:A为 0.6mol,B为0.3mol,C为1.4mol充入容器,达到平衡后,C的体积分数仍为W%,则X值为
A.只能为2 B.只能为3 C.可能是2,也可能是3 D.无法确定
22.在含有1mol KAl(SO4)2的溶液中逐滴加入2mol Ba(OH)2
溶液,下列有关说法中正确的是
A.先生成沉淀,后沉淀全部溶解
B.当溶液中Al3+、SO42—全部沉淀出来时,沉淀的总物质的量最大
C.最后得到的沉淀是BaSO4
D.最后的沉淀为2mol BaSO4、1mol Al(OH)3
四、填空题(本题包括3小题,共29分)
23.(11分)我国“神舟”五号、六号载人飞船的成功发射,标志着“炎黄子孙千年飞天梦想实现了,中国人的太空时代开始了。”
⑴ 火箭升空时,由于与大气层的剧烈摩擦,产生高温。为了防止火箭温度过高, 在火箭表面涂上一种特殊的涂料,该涂料的性质最可能的是
A.在高温下不融化 B.在高温下可分解气化
C.在常温下就分解气化 D.该涂料不可能发生分解
⑵ 火箭升空需要高能的燃料,经常是用N2O4和N2H4作为燃料,其反应的方程式是:
N2 O4 + N2H4 → N2
+ H2O 。请配平该反应方程式:
N2O4 + N2H4
===== N2 +
H2O
该反应中被氧化的原子与被还原的原子物质的量之比是 。
这个反应应用于火箭推进器,除释放大量的热和快速产生大量气体外,还有一个很大的优点是
。
⑶ 为了向宇航员提供氧气,飞船上有专门的供氧装置。现有供氧剂过氧化钠与超氧化钾(KO2)。① 写出它们与二氧化碳反应的化学方程式(超氧化钾与二氧化碳的反应产物与过氧化钠类似): ________
;
_____________________________________。
② 你选择的供氧剂是: ____ ,原因是: ________________
。
24.(12分)A、B、C、D均为4种常见的短周期元素,常温下A、B可形成两种常见的液态化合物,其最简式分别为BA和B2A;B与D可形成分子X,也可形成阳离子Y,X、Y在水溶液中酸、碱性正好相反,D元素气态氢化物的水溶液与其最高价氧化物的水化物的水溶液酸、碱性也相反;C+的焰色反应呈黄色。
(1)C元素在周期表中位于 __ 周期________族,C+ 离子的电子排布式为_______________________;D元素的最高价氧化物的水化物与其氢化物的水溶液互相反应的离子方程式 ____ ;阳离子Y与水反应的离子方程式为 ____ ;最简式为BA的分子的电子式可表示为_________________。
(2)M、N是由A、B、C、D四种元素中任意三种元素组成的不同类型的强电解质,M的水溶液呈碱性,N的水溶液呈酸性,且M溶液中水的电离程度小于N溶液中水的电离程度。 则M、N分别为(填化学式) ____ 、____________ 。
25.(6分)高炉炼铁中发生的基本反应之一如下:FeO(固)+CO(气)≒Fe(固)+CO2(气)-Q ,其平衡常数可表达为 K=![]() ,已知1100℃时,K=0.263
。
,已知1100℃时,K=0.263
。
(1)温度升高,化学平衡移动后达到新的平衡,高炉内CO2和CO和体积比值
平衡常数K值 (本小题空格均备选:增大、减小或不变)
(2)1100℃时测得高炉中[CO2]=0.025mol/L [CO]=0.1mol/L,在这种情况下,该反应是否处于化学平衡状态 (选填是或否),此时,化学反应速度是V正 V逆(选填大于、小于或等于),其原因是___________________________________________________。
五、实验题:(20分)
26.(6分)下列有关实验的叙述,正确的是(填序号)(少一个扣一分,多一个倒扣一分,扣完为止) 。
(A)配制500mL某物质的量浓度的溶液,可用两只250mL的容量瓶
(B)用渗析法分离淀粉中混有的NaCl杂质
(C)无法用分液漏斗将甘油和水的混合液体分离
(D)用酸式滴定管量取20.00mL高锰酸钾溶液
(E)为了测定某溶液的pH,将经水润湿的pH试纸浸入到待测溶液,过一会取出,与标准比色卡进行对比
(F)用浓氨水洗涤做过银镜反应的试管
(G)配制银氨溶液时,将稀氨水慢慢滴加到硝酸银溶液中,产生沉淀后继续滴加到沉淀刚好溶解为止
(H)浓硫酸不小心沾到皮肤上,立刻用稀NaOH溶液洗涤
(J)在氢氧化铁胶体中加少量硫酸会产生沉淀
(K)用结晶法可以除去硝酸钾中混有的少量氯化钠
27.(14分)已知在pH为4~5的溶液中,![]() 几乎不水解,而
几乎不水解,而![]() 几乎完全水解。某学生拟用电解
几乎完全水解。某学生拟用电解![]() 溶液的方法测定铜的相对原子质量.其实验流程图如下:
溶液的方法测定铜的相对原子质量.其实验流程图如下:

试回答下列问题:
(1) 步骤①中加入A的化学式为________,其作用是_____________;沉淀物B是________(填化学式)。
(2)步骤②中所用部分仪器如下图所示:则A应连接直流电源的________极,写出B电极上发生反应的电极方程式________________________________________。
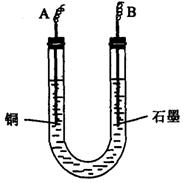
(3)下列实验操作属必要的是________(填字母)。
A.称量电解前电极的质量
B.电解后电极在烘干前,必须用蒸馏水冲洗
C.刮下电解后电极上的铜,并清洗、称量
D.电极在烘干称重的操作中必须按如下顺序:烘干→称重→再烘干→再称重进行两次
E.在空气中烘干电极,必须采用低温烘干法
(4)电解后向溶液中加入石蕊试液,观察到的现象是_________________________。
(5)铜的相对原子质量的计算式是_________________。
(6)从能量转化的角度来看,步骤②的变化是将________能转化为________能。
六、有机题:(共20分)
28.(10分)实验测得某烃中碳元素的质量分数为91.3%,相对分子质量为92,则该烃的分子式为____________。若该烃为芳香烃,在其分子的“C-C”键或“H-C”键中
![]()
插入基团“ ”可形成六种含苯环的酯,请写出其中四种酯的结构简式:
__________________________________、____________________________________、
__________________________________、____________________________________。
29.(10分)已知:①R— —
—![]()
②苯环上原有的取代基对新导入的取代基进入苯环的位置有显著影响.当一取代苯进行取代反应时,新引进的取代基因受原取代基的影响而取代邻、对位或间位。使新取代基进入它的邻、对位的取代基:-CH3、-NH2;使新取代基进入它的间位的取代基:-COOH、-NO2;
以下是用苯作原料制备一系列化合物的转化关系图:

(1)A转化为B的化学方程式是______________________________________________。
(2)图中“苯→①→②”省略了反应条件,请写出①、②物质的结构简式:
①________________________,②_______________________________。
(3)B在苯环上的一氯代物有 种同分异构体。
(4)有机物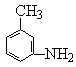 的所有原子 (填“是”或“不是”)在同一平面上。
的所有原子 (填“是”或“不是”)在同一平面上。
七、计算题(共15分)
30.(6分)用密度为1.19g/cm3、质量分数为36.5%的浓盐酸252mL与足量的二氧化锰反应,生成的氯气在标准状况下的体积为16.8L。计算:
(1)在反应中被氧化的HCl的物质的量为多少?
(2)浓盐酸中HCl的物质的量浓度最小值为多少?
31、(9分)向Cu与CuO的混合物中加入混酸(硝酸和硫酸)后加热,使之恰好完全反应,反应中不产生SO2和Cu(NO3)2,硝酸的还原产物只有NO,且得到NO8.96L(标准状况)。将溶液冷却后刚好全部结晶(无其它任何残留物),得到CuSO4·5H2O 250g。
求:(1)混酸中硝酸和硫酸的物质的量之比。
(2)原混合物中Cu和CuO的物质的量之比。
(3)混酸中硫酸的质量分数。
高三化学第二次月考答卷
班级________学号 姓名 得分
一、二、三选择题答案:(共66分)
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 |
| 21 | 22 | ||||||||
四、填空题(本题包括3小题,共29分)
23.(11分)
⑴该涂料的性质最可能的是
⑵请配平该反应方程式:
N2O4 + N2H4
===== N2 +
H2O
该反应中被氧化的原子与被还原的原子物质的量之比是 。
还有一个很大的优点是
。
⑶ 过氧化钠与二氧化碳反应的化学方程式: ________
; 超氧化钾(KO2)与二氧化碳反应的化学方程式__________________________________。
你选择的供氧剂是: __ ,原因是: ________________
。
24.(12分) (1)C元素在周期表中位于 __ 周期________族,C+ 离子的电子排布式为_______________________;D元素的最高价氧化物的水化物与其氢化物的水溶液互相反应的离子方程式 ____ ________________ ;阳离子Y与水反应的离子方程式为 ____ ________________ ;最简式为BA的分子的电子式可表示为_________________。
(2)M、N分别为(填化学式) ____ 、____________ 。
25.(6分) (1)高炉内CO2和CO和体积比值 平衡常数K值
(2)该反应是否处于化学平衡状态 ,化学反应速度是V正 V逆,其原因是___________________________________________________。
五、实验题:(共20分)
26.(6分)正确的是) 。
27.(14分)(1)步骤①中加入A的化学式为________,其作用是_____________;沉淀物B是________
(2)步骤②中所用部分仪器如下图所示:则A应连接直流电源的________极,写出B电极上发生反应的电极方程式________________________________________。
(3)下列实验操作属必要的是________。
(4)电解后向溶液中加入石蕊试液,观察到的现象是_________________________。
(5)铜的相对原子质量的计算式是_________________。
(6)从能量转化的角度来看,步骤②的变化是将________能转化为________能。
六、有机题:(共20分)
28.(10分)该烃的分子式为____________。
请写出其中四种酯的结构简式:
__________________________________、____________________________________、
__________________________________、____________________________________。
29.(10分)
(1)A转化为B的化学方程式是______________________________________________。
请写出①、②物质的结构简式:
①________________________,②_______________________________。
(3)B在苯环上的一氯代物有 种同分异构体。
(4)有机物 的所有原子 (填“是”或“不是”)在同一平面上。
的所有原子 (填“是”或“不是”)在同一平面上。
七、计算题(共15分)
30.(6分)
31、(9分)
参考答案
一、二、三选择题答案:(1-5每小题2分,6-17每小题3分,18-22每小题4分)
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| C | B | B | B | A | A | C | D | B | B |
| 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 |
| B | C | C | B | A | C | C | BC | BC | AB |
| 21 | 22 | ||||||||
| C | BC |
23.(11分)⑴ B;
⑵ 1N2O4 + 2N2H4
= 3N2 + 4H2O 2∶1;产物无污染。
⑶ ① 2Na2O2 + 2CO2
= 2Na2CO3 + O2 ;4KO2+ 2CO2 = 2K2CO3
+ 3O2 。
② KO2,原因是:单位质量产生氧气多。
24.(12分)
25.(6分)(1)增大,增大,(2)否,大于,此时[CO2]/[CO]<0.263,因温度不变,K值不变。为增大[CO2]/[CO]比值,需V正>V逆
26、(6分)(BCDGJK)(少一个扣一分,多一个倒扣一分,扣完为止)
27.(14分)(1)CuO (1分);
与![]() 反应,调节溶液的pH在4~5之间使
反应,调节溶液的pH在4~5之间使![]() 完全水解(2分);
完全水解(2分);
![]() (1分)
(1分)
(2)负(1分)
![]() (2分)
(2分)
(3)A、B、D、E;(2分)
(4)溶液变为红色(1分)
(5)![]() (2分)
(2分)
(6)电,化学 (2分)
28.(10分)C7H8(2分)
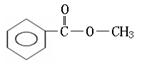
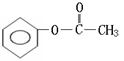
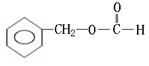
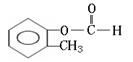 (邻、间、对)
(邻、间、对)
[以上六种任选四种](各2分)
29.(10)  (各2分,共6分)
(各2分,共6分)
(3)4 (2分) (4)不是 (2分)
30.(6分)解:MnO2+4H++2Cl-
Mn2++2H2O+Cl2↑
n(Cl2)=0.75mol
需浓盐酸的体积252mL
所以HCl的物质量浓度应大于11.9mol·L-1 (3分)
被氧化的HCl的物质的量为1.5mol (3分)
31.(9分)
(1)n(HNO3)∶n(H2SO4)=(8.96/22.4)∶(250/250)=0.4∶1=2∶5(2分)
(2)硝酸是氧化剂,铜是还原剂,相关反应为:3Cu+8H++2NO3—=3Cu2++2NO↑+4H2O (1分)
n(NO)=0.4mol;n(Cu)=0.4×3/2=0.6mol;n(CuO)=1 – 0.6=0.4mol ;
n(Cu)∶n(CuO)=0.6∶0.4=3∶2 (2分)
(3)原混酸的总质量为:(250+30×0.4) —(64×0.6+80×0.4)=191.6g (2分)
ω(H2SO4)=98/191.6=51.1% (2分)
用其它方法解题酌情给分