高三化学第一学期统练试卷(六)
可能用到的相对原子质量:H-1 C-12 N-14 O-16 F-19 Na-23 S―32 Cl-35.5 K-39 Ca-40 Fe―56 Cu―64
第Ⅰ卷(选择题 共45分)
一、选择题(本题包括18小题,每小题2.5分,共45分。每小题只有一个选项符合题意。)
1. 下列分子中所有原子都满足最外层8电子结构的是
A.N2 B.H2O C.BF3 D.SF6
2. 下列各组物质的分类正确的是
A.同位素: H2 D2 T2
B.非电解质: NH3、C2H5OH
C.非极性分子:C60、CO2、CH2Cl2
D.同系物: ![]() -OH、CH3-
-OH、CH3-![]() -OH、CH3-
-OH、CH3-![]() -CH2OH
-CH2OH
3. 某物质有以下性质:①是电解质,②溶解时有化学键的破坏,③熔化时没有化学键的破坏,则该物质固态时属于
A.原子晶体 B.离子晶体 C.分子晶体 D.金属晶体
4.
居室装修用石材的放射性常用![]() 作为标准,居里夫人(Marie Curie)因对Ra元素的研究两度获得诺贝尔奖。下列叙述中正确的是
作为标准,居里夫人(Marie Curie)因对Ra元素的研究两度获得诺贝尔奖。下列叙述中正确的是
A.Ra元素位于元素周期表中第六周期ⅡA族 B.RaCl2的熔点比CaCl2高
C.一个![]() 原子中含有138个中子
D.Ra(OH)2是一种两性氢氧化物
原子中含有138个中子
D.Ra(OH)2是一种两性氢氧化物
5. 已知几种阴离子还原性强弱顺序为F-<Cl-<Br-<I-<S2-。某溶液含有相同浓度的F-、Cl-、Br-、I-、S2-,当向其中逐滴加入新制的饱和氯水直至过量时,最后被氧化的离子是
A. Br- B. Cl- C. F- D. S2-
6.
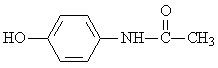 百服宁口服液为解热镇痛药,主要用于治疗头痛、发烧。其主要化学成分的结构简式如右图所示,下列有关该有机物叙述正确的是
百服宁口服液为解热镇痛药,主要用于治疗头痛、发烧。其主要化学成分的结构简式如右图所示,下列有关该有机物叙述正确的是
A.分子式为C8H10NO2
B.该有机物属于α—氨基酸
C.该有机物属于α—氨基酸的同分异构体有3种
D.该有机物与FeCl3溶液发生显色反应
7. 阿伏加德罗常数约为6.02×1023mol-1,下列说法中一定正确的是
A.1molFeCl3完全转化为Fe(OH)3胶体后生成6.02×1023个胶粒
B.标准状况下,2.24 L 乙醇完全燃烧所得CO2分子数为0.2 ×6.02×1023
C.1L0.1mol·L-1的醋酸溶液中的所有分子总数大于0.1×6.02×1023
D.通过化学反应制得1molO2,转移电子的数目一定是4×6.02×1023
8. 某无色溶液中滴入酚酞试液显红色,该溶液中可以大量共存的离子组是
A.Mg2+、Al3+、HCO3-、SO32- B.K+、Na+、AlO2-、NO3-
C.K+、Ca2+、MnO4-、Cl- D.NH4+、Fe3+、SO42-、SCN-
9.
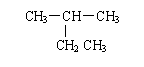 下列有机物命名正确的是
下列有机物命名正确的是
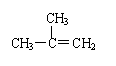 A.
2-乙基丙烷 B.CH3CH2CH2CH2OH 1-丁醇
A.
2-乙基丙烷 B.CH3CH2CH2CH2OH 1-丁醇

C. 间二甲苯 D. 2—甲基—2—丙烯
10.
![]() 已知热化学方程式 2SO3(g) 2SO2(g)
+ O2(g);△H1 =
+197kJ/mol,
已知热化学方程式 2SO3(g) 2SO2(g)
+ O2(g);△H1 =
+197kJ/mol,
![]() 热化学方程式 2SO2(g) + O2(g) 2SO3(l);△H2 = — a
kJ/mol
热化学方程式 2SO2(g) + O2(g) 2SO3(l);△H2 = — a
kJ/mol
则下列说法正确的是
A.a>197 B.a<197 C.a=197 D.热方程式中化学计量数可表示分子个数
11.
 最近意大利罗马大学的FulvioCacace等人获得了极具理论研究意义的N4分子。N4分子结构如右图所示,已知断裂1moIN-N吸收167kJ热量,生成1molN≡N放出942kJ热量,根据以上信息和数据,下列说法正确的是
最近意大利罗马大学的FulvioCacace等人获得了极具理论研究意义的N4分子。N4分子结构如右图所示,已知断裂1moIN-N吸收167kJ热量,生成1molN≡N放出942kJ热量,根据以上信息和数据,下列说法正确的是
A.N4属于一种新型的化合物 B.N4与N2互为同分异构体
C.N4沸点比P4(白磷)高 D.1mo1N4气体转变为N2将放出882kJ热量
12. 化学实验室中常将溶液或试剂进行酸化,下列酸化处理正确的是
A.定量检验C2H5Cl时,将C2H5Cl和NaOH混合后,加盐酸酸化
B.为提高KMnO4溶液的氧化能力,用盐酸将KMnO4溶液酸化
C.鉴定检测液中是否有Fe2+时,用硝酸酸化,再加KSCN溶液
D.鉴别溶液中是否有SO42—溶液可用盐酸酸化
13. 下列事实能用勒夏特列原理解释的是
A.配制FeCl3溶液时加入少量的盐酸
B.钢铁在潮湿的环境中容易生锈
C.工业合成氨时使用铁触媒为催化剂
D.经粉碎的黄铁矿在沸腾炉中燃烧得较快、较完全
14. 常温下,向一定浓度的弱酸HA中逐滴加入氢氧化钠,在此过程中,不可能出现的结果是
A.当pH<7时,c(A—)>c(Na+)>c(H+) >c(OH—)
B.当pH=7时,c(Na+)>c(A—)>c(OH—)=c(H+)
C.当pH>7时,c(Na+)>c(A—)>c(OH—) >c(H+)
D.当pH>7时,c(Na+)> c(OH—)>c(A—) >c(H+)
15.
在容积固定的密闭容器中存在如下反应:
A(g)+3B(g) ![]() 2C(g);△H<0某研究小组研究了其他条件不变时,改变某一条件对上述反应的影响,并根据实验数据作出下列关系图:
2C(g);△H<0某研究小组研究了其他条件不变时,改变某一条件对上述反应的影响,并根据实验数据作出下列关系图:
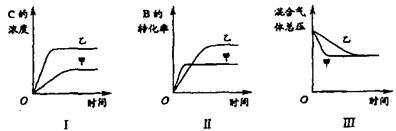 |
下列判断一定正确是
A.图I研究的是不同催化剂对反应的影响,且乙使用的催化剂效率较高
B.图Ⅱ研究的是压强对反应的影响,且甲的压强较高
C.图Ⅱ研究的是温度对反应的影响,且甲的温度较高
D.图Ⅲ研究的是压强对反应的影响,且甲的压强较高
16.
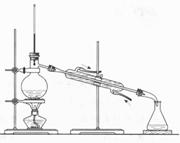
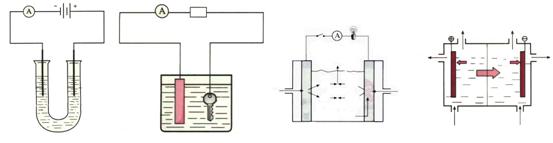
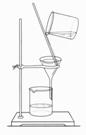 以下实验装置一般不用于分离物质的是
以下实验装置一般不用于分离物质的是
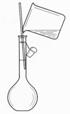 | 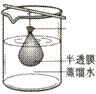 | ||
A. B. C. D.
17. t℃时,将100 g某物质A的溶液蒸发掉10 g水,恢复至t℃,析出2.5 g晶体;再蒸发掉10 g水,恢复至t℃,析出7.5 g晶体。下列说法中正确的是
A.t℃时原溶液是饱和溶液 B.若A是CuSO4,则7.5 g晶体中含水2.7 g
C.t℃时A的溶解度一定为75 g D.原溶液中A的质量分数为40%
18. 常温下,将pH=2的盐酸与pH=13Ba(OH)2溶液混合后,所得溶液的pH=11,则盐酸与Ba(OH)2溶液的体积比为
A.1:11 B.11:1 C.1:9 D.9:1
第Ⅱ卷(共55分)
二、填空题
19. (5分)臭氧(O3)可以使湿润的淀粉-碘化钾试纸变蓝,化学方程式:
KI+O3+H2O→KOH+I2+O2(未配平)
(1)该反应中氧化剂的名称为 ,还原产物的化学式为
(2)配平后的化学方程式是
(3)若消耗0.1 mol氧化剂,反应中转移电子的物质的量为
20.
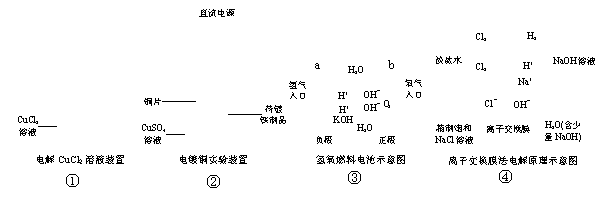
 (12分)下面是常见的电化学装置图,①③④中均为惰性电极,请回答下列问题
(12分)下面是常见的电化学装置图,①③④中均为惰性电极,请回答下列问题
(1) 写出装置①中发生反应的总化学方程式_____________________________________。
(2) 装置②中铜片为_________极,若铜片和铁制品的质量相等,电解一段时间后,电路中有2mol电子转移,此时铜片和铁制品的质量差为_________g。
(3) 装置③中b极为________极,该极的电极反应方程式为_______________________。
(4) 装置④为工业上电解食盐水制取NaOH的原理示意图,其中阳离子交换膜将电解槽隔成阳极室和阴极室,阳极室加入精制的饱和食盐水,阴极室加入纯水(含一定量的NaOH)。
请解释阴极的纯水中加入NaOH的原因:____________________________________
_______________________________________________________________________。
粗盐水中含有Ca2+、 Mg2+、 Fe3+ 、 SO42- 等杂质离子,一般用BaCl2、 Na2CO3、 NaOH等试剂使杂质成为沉淀除去,请按先后顺序写出发生反应的离子方程式。
(不考虑互促水解)(横线可不填满也可补充)
______________________________ __________________________________
______________________________ __________________________________
_______________________________ _________________________________。
然后加入盐酸调节盐水的pH ,所用盐酸可由电解食盐水的产物制取,若某厂日产50%的NaOH 4吨,试计算该厂理论上每天最多可以生产36.5%的盐酸_________吨。
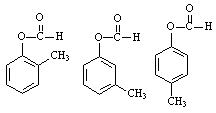
21. (7分)某有机化合物A的分子式为C8H8O2,且分子中含有苯环。
(1)若A可以与NaHCO3溶液反应放出CO2,且苯环上只有一个侧链,则A的结构简式为
_________________。
(2)写出A属于酯类且可以发生银镜反应的所有同分异构体的结构简式。
____________________________________________________________________。
从上述同分异构体中任选一种,写出其发生银镜反应的化学方程式。
_____________________________________________________________________。
22. (8分)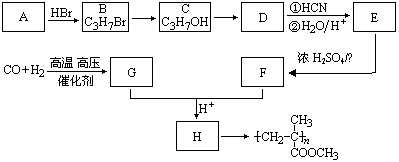 (12分)已知
(12分)已知![]() ,有机玻璃可按下列路线合成:
,有机玻璃可按下列路线合成:
试写出:
(1)A、E的结构简式分别为: 、 。
(2)B→C、E→F的反应类型分别为: 、 。
(3)写出下列转化的化学方程式:C→D ;
G+F→H 。
23. (12分)在75℃左右,用HgSO4做催化剂,乙炔可水化为乙醛,但HgSO4遇到某些特定物质常会发生催化剂中毒而失去催化作用,H2S就是其中一种。现用乙炔水化法,只用块状电石、浓硫酸、水、NaOH溶液、HgO粉末五种物质制乙醛,装置如下图所示,请回答下列问题:
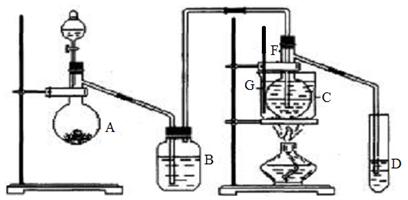
(1)实验开始时,仪器A中盛放电石,A中发生反应的化学反应方程式为
__________________________________________________________________________。
(2)B中应装____________,其作用是_____________________________________________。
(3)蒸馏烧瓶F中应先加入HgO,再从所给五种试剂中选取另外两种试剂直接加入烧瓶,请按加入的先后顺序写出另外两种试剂的名称____________ _____________。
(4)装置图中,加热F的方法叫_______,所选用温度计G的量程表示正确的是______(填代号)。
A.0℃~50℃ B.0℃~100℃ C.0℃~200℃ D.0℃~360℃
(5)检验乙醛已制出的操作及现象是_________________ _____ ____。
24.
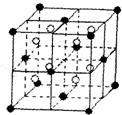
 (10分)A、B、C、D、E都是元素周期表中前20号元素,原子序数依次增大,B、C、D同周期,,A、D同主族,E和其它元素既不在同周期也不在同主族,B、C、D的最高价氧化物的水化物两两混合均能发生反应生成盐和水。
(10分)A、B、C、D、E都是元素周期表中前20号元素,原子序数依次增大,B、C、D同周期,,A、D同主族,E和其它元素既不在同周期也不在同主族,B、C、D的最高价氧化物的水化物两两混合均能发生反应生成盐和水。
根据以上信息,回答下列问题:
(1) A和D氢化物中,沸点较低的是 (填“A”或“D”);
(2)
 A和B的离子中,半径较小的是 (填离子符号)。
A和B的离子中,半径较小的是 (填离子符号)。
(3) 元素C在元素周期表中的位置是 。
(4) A和E可组成离子化合物,其晶胞(晶胞是在晶体中具有代表性的最小重复单元)结构如下图所示,阳离子(用“●”表示)于该正方体的顶点或面心;阴离子(用“〇”表示)均位于小正方体中心。该化合物的电子式是
(5) 已知晶胞1/8的体积为2.0×10-23cm3,求A和E组成的离子化合物的密度,请列式并计算,结果保留一位小数。___________________________________________________________
答 题 纸
班级_________姓名___________学号________分数_________
二、填空题
19.(5分)(1)该反应中氧化剂的名称为 ,还原产物的化学式为 。
(2)配平后的化学方程式是 。
(3)若消耗0.1 mol氧化剂,反应中转移电子的物质的量为 。
20.(13分)(1)总化学方程式_________________________________________。
(2)装置②中铜片为_________极,质量差为_________g。
(3)装置③中b极为________极,该极的电极反应方程式为____ ___________________。
(4)原因:_______________ ___________________________________________________。
离子方程式
___________________________________ ___________________________________
___________________________________ ___________________________________
___________________________________ __________________________________。每天最多可以生产36.5%的盐酸_________吨。
21.(7分) (1)A的结构简式为_____________________________。
(2)A所有同分异构体的结构简式。
__________________________________________________________ __________。
方程式_________________________________________ ___ _____________。
22.(8分)(1)A、E的结构简式分别为: 、 。
(2)B→C、E→F的反应类型分别为: 、 。
(3)写出下列转化的化学方程式:C→D ;
G+F→H 。
23.(12分)(1)A中化学反应方程式为_____________________________________________。
(2) B中应装____________,其作用是_____________________________________________。
(3)另外两种试剂的名称_____________ ____________。
(4)加热F的方法叫_______________, G的量程表示正确的是_______________ (填代号)。
(5)检验乙醛已制出的操作及现象是___________________________________________
___________________________________________________________________________。
24.(10分)
(1) A和D氢化物中,沸点较低的是 (填“A”或“D”);
(2) A和B的离子中,半径较小的是 (填离子符号)。
(3) 元素C在元素周期表中的位置是 。
(4) 该化合物的电子式是 。
(5)列式计算(保留一位小数)
_______________________________________________________________________________。
答 案
一、选择题
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 |
| A | B | C | C | A | D | C | B | B |
| 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 |
| A | D | D | A | B | C | A | B | D |
二、填空题
19.(5分)(1) 臭氧 , KOH 。(2)2KI + O3 + H2O = 2KOH + I2 + O2。(3) 0.2mol 。
20.(13分)(1)总化学方程式CuCl2 = Cu + Cl2↑。(2)__阳极___极,质量差为_128___g。
(3)__正__极,该极的电极反应方程式为O2 + 2H2O + 4e- = 4OH-。
(4)原因:增大离子浓度,增强溶液的导电性。
Ba2+ + SO42- = BaSO4↓ Ba2+ + CO32- = BaCO3↓ Ca2+ + CO32- = CaCO3↓
Mg2+ + 2OH- = Mg(OH)2↓Fe3+ + 3OH- = Fe(OH)3↓盐酸_5吨。
 21.(7分) (1)A的结构简式为 (2)A所有同分异构体的结构简式。
21.(7分) (1)A的结构简式为 (2)A所有同分异构体的结构简式。
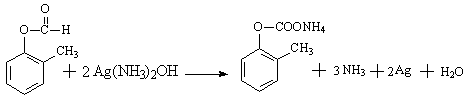
22.(8分)(1)A、E的结构简式分别为: ![]() 、。
、。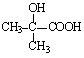
(2)B→C、E→F的反应类型分别为: 取代 、 消化 。
(3)C→D![]() ;
;
G+F→H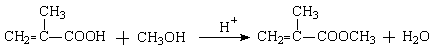 。
。
23.(12分)(1)A中化学反应方程式为CaC2+2H2O=Ca(OH)2+ C2H2↑。
(2) B中应装__NaOH_,其作用是除去反应中产生的H2S,防止催化剂中毒。
(3)另外两种试剂的名称水、浓硫酸。
(4)加热F的方法叫水浴加热, G的量程表示正确的是B___ (填代号)。
(5)检验乙醛已制出的操作及现象是从D中取少量溶液于试管中,加入新制的Cu(OH)2悬浊液,加热,若出现红色沉淀,证明乙醛已经制出。
24.(10分)
(5) A和D氢化物中,沸点较低的是 D (填“A”或“D”);
(6) A和B的离子中,半径较小的是 Na+ (填离子符号)。
(7) 元素C在元素周期表中的位置是 第3周期, ⅢA族 。
(8)
该化合物的电子式是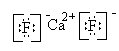 。
。
(5)列式计算(保留一位小数)
![]() =3.2g/cm-3
=3.2g/cm-3
_______________________________________________________________________________。