保密★启用前 试卷类型:A
高三化学教学质量检测试题
本试卷分第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分。第Ⅰ卷1至4页,第Ⅱ卷5至8页。满分100分,考试时间为90分钟。
第Ⅰ卷(选择题,共46分)
注意事项:
1.答第1卷前,考生务必将自己的姓名、考号、考试科目、试卷类型(A)涂写
在答题卡上。考试结束时,将试题和答题卡一并交回。
2.每小题选出答案后,用铅笔把答题卡上对应题目的答案标号涂黑,如需改动,
用橡皮擦干净后,再选涂其它答案标号,不能答在试题卷上。
可能用到的相对原子质量:H 1 C 12 N14 016 Na 23 Al 27 Cu 64
一、选择题(本题包括5小题。每小题2分,共10分。每小题只有一个选项符合题意)
1.现有以下几种措施:①对煤燃烧时产生的尾气进行除硫处理②少用原煤作燃料
③燃煤时鼓入足量空气④开发清洁能源。其中能减少酸雨产生的措施是
A.①②③ B.②③④ C.①③④ D.①②④
2.世界著名的科技史专家、英国剑桥大学的李约瑟博士考证说:“中国至少在距今3000年以前,就已经使用玻璃了。”下列有关玻璃的说法不正确的是
A.制普通玻璃的原料主要是纯碱、石灰石和石英
B.普通玻璃的成分主要是硅酸钠、硅酸钙和二氧化硅
C.玻璃在加热熔化时有固定的熔点
D.盛放烧碱溶液的试剂瓶不能用玻璃塞,是为了防止烧碱跟二氧化硅生成硅酸钠而使瓶塞与瓶口粘在一起
高三化学试题第1页(共8页)
3.现榨的苹果汁在空气中会由淡绿色变为棕黄色,其原因可能是
A.苹果汁中的Fe2+成Fe3+ B.苹果汁中含有Cu2+
C.苹果汁中含有OH- D.苹果汁中含有Na+
4.下列物质不能由铜单质跟其它物质发生化合反应得到的是
5.下列表中对于相关物质的分类全部正确的一组是
| 编号 | 盐 | 酸 | 弱电解质 | 非电解质 |
| A | Na2SO4 | H2SO4 | NaHCO3 | CO2 |
| B | NaHSO4 | CH3COOH | SO2 | CH3CH2OH |
| C | FeCl3 | NaHSO4 | H2SiO3 | Cl2 |
| D | Ba(NO3)2 | H3PO4 | H2CO3 | NH3 |
二、选择题(本题包括12小题,每小题3分,共36分。每小题只有一个符合题意)
6.阿伏加德罗常数约为6.02×1023mol-1。下列叙述中不正确的是
A.标准状况下,22.4 L CO2和CO混合气体中含有的碳原子数约为6.02×1023
B.常温常压下,0.1 mol Fe在0.1 mol C12中充分燃烧,转移的电子数约为l.806×1023
C.0.1mol CH4所含的电子数约为6.02×1023
D.1 L l mol·L-1的NaHC03溶液中离子总数大于1.204×1024
7.实验室制备硝酸铝[AI(NO3)3·9H20]可使用下列方法:
![]()
下列说法或反映上述有关反应的离子方程式错误的是
A.制备过程中加HNO3应该过量,以防止蒸发时Al(N03)3水解
B.不直接用铝片跟稀硝酸反应制硝酸铝主要是因为铝在稀硝酸中发生钝化
C.2A1+20H-+6H20=2[Al(OH)4]-+3H2↑
D.3H++Al(OH)3=A13+ +3H20
8.某溶液中只有Na+、CH3COO-、H+、OH-四种离子,且浓度大小的顺序为:
c(Na+)>c(CH3COO-)>c(0H-)>c(H+),该溶液可能是
A.由pH=l的CH3COOH溶液与pH=13的NaOH溶液等体积混合而成
B.由1 mL0.1 mol·L-1的CH3COOH溶液与10 mL 1 mol·L-1的NaOH溶液混合而成
C.由0.1mol·L-1的CH3COOH溶液与0.1 mol·L-1的NaOH溶液等体积混合而成
D.由0.1 mol·L-1的CH3COONa溶液与0.1 mol·L-1的NaOH溶液等体积混合而成
高三化学试题第2页(共8页)
9.中科大陈乾旺教授等人发RTX-r_合成金刚石的新方法,其化学原理为:
①Na+CO2 ![]() C(金刚石)+C(石墨)+Na2CO3(未配平)。该法比1955年人工首次制得金刚石的方法容易得多,其化学原理是:
C(金刚石)+C(石墨)+Na2CO3(未配平)。该法比1955年人工首次制得金刚石的方法容易得多,其化学原理是:
以下有关表述中正确的是
A.反应①和②都存在旧化学键的断裂与新化学键的形成
B.新法利用的是化学变化,旧法利用的是物理变化
C.在反应①中每生成12g金刚石需要消耗23g金属钠
D.反应①和②中,金刚石都是还原产物,Na2CO3是氧化产物
10.某化学兴趣小组欲研究H2SO4、NaCI、KCl、Na2CO3、FeCI3、NaOH的性质,对于 如何研究,他们设计了两种研究方案:
方案①:将它们按照酸、碱、盐分类,然后分别溶于水得到溶液,进行实验;
方案②:将它们按照钠盐、钾盐、铁盐和其它化合物分类,然后分别溶于水得到溶液,进行实验。
下列说法正确的是
A.常温时将少量铜粉分别投入上述溶液中,按照方案①的分类,能够完全溶解铜粉的只有酸(H2SO4)溶液和盐(FeCl3)溶液
B.设计方案②的同学取某种溶液,在其中加入上述的钾盐溶液,有白色沉淀产生,再加入稀硝酸,沉淀不消失,则该溶液中可能含有Ag+
C.按照方案①的分类,属于碱的有Na2CO3、NaOH
D.这两组同学在研究物质性质时只使用了实验法、观察法
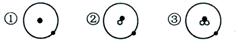 11。简单原子的原子结构可用下图形象地表示:
11。简单原子的原子结构可用下图形象地表示:
其中●表示质子或电子,o表示中子,则下
列有关①②③的叙述正确的是
A.①②③互为同位素 B.①②③为同素异形体
c.①②③是三种化学性质不同的粒子 D.①②③具有相同的质量数
12.蛇纹石由MgO、A12O3、Si02、Fe203组成。现取一份蛇纹石试样进行实验,首先将
其溶于过量的盐酸,过滤后,在所得的沉淀X和溶液Y中分别加人NaOH溶液至过量。下列叙述不正确的是
A.沉淀X的成分是Si02
B.将蛇纹石试样直接溶于过量的NaOH溶液后过滤,可得到红色颜料Fe2O3,
C.在溶液Y中加人过量的NaOH溶液,过滤,得到的沉淀的主要成分是Fe(OH)3和Mg(OH)2
D.溶液Y中的阳离子主要是Mg2+、Al3+、Fe3+、H+
高三化学试题第3页(共8页)
13。某反应在高温时能自发进行,在低温时逆反应能自发进行,则对其正反应的判断正
确的是
A.放热反应,熵增加 B.放热反应,熵减少
C.吸热反应,熵增加 D.吸热反应,熵减少
14。下列各组离子在溶液中不能大量共存,且肯定产生沉淀的是
A.[A1(OH)4]-、Na+、S042-、H+ B.HCO3-、Na+、K+、0H-
C.Al3+、Cl-、SO42-、NO3- D.SO32-、H+、S2-、Cl-
15.将pH为5的硫酸溶液稀释500倍,稀释后溶液中c(SO42-) :c(H+)约为
A.1:1 B.1:2 C.1:10 D.10:1
16.CIO2是一种消毒杀菌效率高、二次污染少的水处理剂。实验室可通过以下反应制
得C102:2KCl03+H2C204+H2SO4 2C102↑+K2SO4+2C02↑+2H20。下列说法正确的是
A.KCIO3在反应中得到电子 B。ClO2是氧化产物
C.H2C204在反应中被还原 D.1mol KCIO3参加反应有2mol电子转移
17。将某些化学知识用数轴表示,可以收到直观、简明、易记的效果。用数轴表示的下
列知识正确的是
A 硫及其化合物的化会价与氧化还原反应的关系.
 |
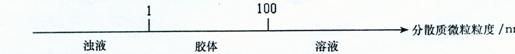 B。分散系的分类:
B。分散系的分类:
C.硫单质在02中燃烧后的产物:

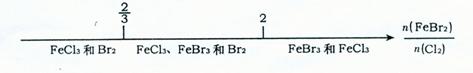
D.已知:还原性Fe2+>Br-,则FeBr2溶液与CI2反应的产物
 |
高三化学试题第4页(共8页)
保密★启用前 试卷类型:A
2006年潍坊市高三教学质量检测
化 学 试 题
![]()
第Ⅱ卷(非选择题,共54分)
注意事项:
1.第Ⅱ卷共4页,用钢笔或圆珠笔将答案直接答在试题卷上。
2.答卷前先将密封线内的项目填写清楚。
三、(本题包括2小题,共18分)
18.(8分)现有第二、三周期元素性质的部分数据,其中X数值表示不同元素的
原子吸引电子的能力大小,若X值越大,元素的非金属性越强,金属性越弱。X值相
对较大的元素在所形成的分子中化合价为负价:
| 编号 | ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | |
| X | 3.44 | 2.55 | 0.98 | 2.04 | 2.19 | 3.16 | 0.93 | 3.04 | 1.61 | |
| 常见化合价 | 最高价 | +4 | +1 | +3 | +1 | +3 | ||||
| 最低价 | -2 | -3 | -1 | -3 | ||||||
(1)画出元素⑥的离子结构示意图
(2)元素⑦和元素⑨的氢氧化物反应的离子方程式为
(3)“神舟五号”飞船内采用一种化合物来吸收航天员呼出的CO:,你认为该物质
应该是由上表中的 (填序号)元素组成的。
(4)将8g元素②的单质在足量的元素①的单质中燃烧,所得气体通入1Llm01·L。
的NaOH溶液中,完全吸收后,溶液中离子浓度由大到小的顺序
高三化学试题第5页(共8页)
19.(10分)下列框图所示反应有直接进行的,也有在溶液中进行的,其中部分产
物已略去。已知:A是固体单质,Y是一种无色液体,既可作氧化剂,又可作还原剂,
B、X、秒为气体单质,D属于可溶于水的强电解质,一个D分子含有18个电子。
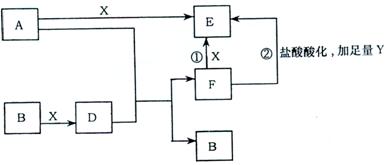 |
(1)化学式:B为 ,F为 。
(2)写出反应①和②的化学方程式
。
(3)用离子方程式表示E物质能用于净水的原理
四、(本题包括2小题,共28分)
20.某课外活动小组利用以下装置探究氯气与氨气之间的反应。其中A 、F 分别为氨气和氯气的发生装置,C为纯净的氯气于氨气反应的装置。
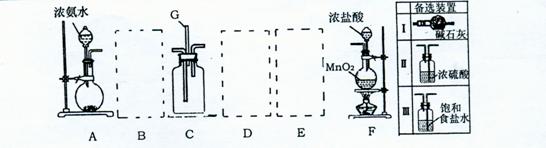 |
请回答下列问题:
(1)装置F中发生反应的离子方程式 。
(2)装置A中烧瓶内固体可以选用 (选填以下选项的代号)。
A.碱石灰 B.生石灰 C.二氧化硅D.五氧化二磷 E·烧碱
F.氢氧化钠和氯化铵的混合物
高三化学试题第6页(共8页)
(3)上图A—F是按正确实验装置顺序排列的。虚线框内应添加必要的除杂装置,
请从上图的备选装置中选择,并将编号填人下列空格:B
D ,E
(4)氯气和氨气在常温下混合就会反应生成氯化铵和氮气,写出反应的化学方程
式 。装置C内出现浓厚的白烟
并在容器内壁凝结,请设计一个实验方案检验其中的NH4+
(5)若从装置C的G处逸出的尾气只含有N2和少量Cl2,应如何处理才能不污染
环境?
21.(13分)化学反应A(g)+B(g)![]() C(g)+D(g)ΔH<0,850℃时,K=l。t℃时,在一定体积的容器中,通人一定量的A和B,发生反应,各物质浓度随时间变化如下表:
C(g)+D(g)ΔH<0,850℃时,K=l。t℃时,在一定体积的容器中,通人一定量的A和B,发生反应,各物质浓度随时间变化如下表:
t℃时物质的浓度(mol·L-1)变化
| 时间/min | A | B | C | D |
| 0 | 0.200 | 0.300 | 0 | 0 |
| 2 | 0.138 | 0.238 | 0.062 | 0.062 |
| 3 | 0.100 | 0.200 | 0.100 | 0.100 |
| 4 | 0.100 | 0.200 | 0.100 | 0.100 |
| 5 | 0.116 | 0.216 | 0.084 | |
| 6 | 0.096 | 0.266 | 0.104 |
(1)计算t℃该化学反应的平衡常数:
(2)t℃ 850℃(填大于、小于或等于)。判断依据是
(3)反应在4min~5min之间,平衡 (填“向左”、“向右”或“不”)
移动,可能的原因是
a.增加A的浓度 b.增加D的浓度 c.加压 d.使用催化剂
(4)某温度下反应C(g)+D(g)![]()
![]() A(g)+B(g)的平衡浓度符合c(C)a·c(D)=2c(A)·c(B),则此时的温度
850~C(填大于、小于或等于):
A(g)+B(g)的平衡浓度符合c(C)a·c(D)=2c(A)·c(B),则此时的温度
850~C(填大于、小于或等于):
高三化学试题第7页(共8页)
五、(本题包括l小题,8分)
22.(8分)向由Cu、Cu2O和CuO组成的混合物中,加入10mL6mol·L-1的稀硝酸溶液,恰好使混合物完全溶解,同时收集到标准状况下NO 224 mL。请回答以下问题:
(1)写出Cu20与稀硝酸反应的化学方程式
(不必配平)。
(2)产物中硝酸铜的物质的量为
(3)若原混合物中有0.01molCu,则其中Cu2O的物质的量为
CuO的物质的量为 .
化学试题参考答案及评分标准
说明:1.本答案供阅卷评分使用,考生若写出其他正确答案.可参照评分标准给分。
2.化学专用名词中出现错别字、元素符号有错误,书写不规范,都不得分。
3.除22题外,化学方程式、离子方程式未配平都不得分。漏掉反应条件扣1
分。漏掉↑↓不扣分。
第1卷 (选择题,共46分)
一、选择题(每小题2分,共lO分)
1.D 2.C 3.A 4.B 5. D
二、选择题(每小题3分。共36分)
6.B 7.B 8.C 9.A 10.B 11.A 12.B 13.C 14.D 15.C 16.A 17.D
第Ⅱ卷 (非选择题。共54分)
三、(本题包括2小题,共18分) 。
18.(1)Cl-
(2)A1(OH)3+OH- =[Al(OH)4]-或Al(OH)3+OH- =AlO2-+2H20
(3)①⑦
(4)c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+)(每空2分,共8分)
19.(1)H2 FeCI3(每空2分)
(2)①FeCl2+Cl2=2FeCl3(2分)
②2FeCl2+H202+2HCl=2FeCl3+2H20(2分) j
(3)Fe2++3H20 Fe(OH)3+3H+或Fe3++3H20=Fe(OH)3(胶体)+3H+(2分)
四、(本题包括2小题,共28分)
20.(1)Mn02+4H++2CI- ![]() Mn2+ + C12↑+2H20(2分)
Mn2+ + C12↑+2H20(2分)
(2)ABEF(3分,漏选或错选一项扣1分,扣完为止)
(3)I Ⅱ Ⅲ(每空1分,共3分)
(4)3C12+8NH3=6NH4CI+N2(2分)
高三化学试题答案第l页(共2页)
取适量该白色固体与浓的氢氧化钠溶液共热,若产生能使湿润的石蕊试纸变蓝色的无色气体,则证明有NH4+存在(3分,其他合理的答案也给分)
(5)可将尾气通过装有氢氧化钠溶液的洗气瓶后再排除(2分,也可用碱液或浓碱液,若用氨水、澄清石灰水或石灰水不得分)
21.(1)0.5(2分,若写为若写为表达式不得分)
(2)大于(2分)该反应正向为放热反应,化学平衡常数随温度的升高而减小,所以
T1℃大于850℃(3分)
(3)向左(2分) b(2分,多选,错选不得分)
(4)小于(2分)
五、(本题包括1小题,8分)
22.(1)Cu2O+HNO3 - Cu(NO3)2+NO↑+ H2O
(2)0.025mol(2分,漏掉单位扣1分,下同)
(3)0.0050mol (2分) 0.005 mol(2分)