高三化学上学期第二次联考试题
化 学 试 题
本试卷分第Ⅰ卷(选择题)和第Ⅱ卷(非选择)两部分,第1卷1至4页,第1I卷5至8页,共100分。考试时间100分钟。
注意事项:
1、请考生务必将自己的姓名、准考证号填写存指定地方。
2、答第Ⅰ卷时,每小题选出答案后,填在第Ⅱ卷答题卡上:答第Ⅱ卷直接在试卷指定区域作答。
3、考试结束,监考人员将第Ⅰ卷和第Ⅱ卷一并收回。
可能用到的原子量:
H-1 C-12 N-14 O-16 Na-23 Mg-24 Al-27 S-32 Cl-35.5 P-31
第Ⅰ卷(选择题共48分)
一、选择题(本题包括16小题,每小题3分,共48分。每小题只有1个选项符合题意)
1.2006年8月28日上午,我国首条纤维乙醇生产线——河南天冠集团3000吨级纤维乙醇项目,在镇平开发区开工奠基。这一项目打破了过去单纯以粮食类原料生产乙醇的历史,使利用秸秆类纤维质原料生产乙醇成为现实。下列有关说法中不正确的是:
A.用这种纤维乙醇部分替代成品油,有助于缓解日益增长的成品油需求。
B.这一项目不仅使秸秆类废物得到科学利用,而且能为国家节约大量粮食。
C.乙醇能部分替代汽油作车用燃料是因为乙醇与汽油组成元素相同,化学成分相似。
D.掺入10%燃料乙醇的乙醇汽油可以使汽车尾气中一氧化碳排放量下降。
2.下列各组中的物质,互为同位素的是:
A.![]() O
O![]() 与
与![]() O
O![]() B.甲醇与乙醇
B.甲醇与乙醇
C.2—甲基丁烷与戊烷 D.重氢与超重氢
3.物质氧化性、还原性的强弱,不仅与物质的结构有关,还与物质的浓度和反应温度有关,下列各组物质:①Cu与浓硝酸;②Fe与浓硫酸;③Na与氧气;④P![]() O
O![]() 与水,由于反应温度不同而能发生不同氧化还原反应的是:
与水,由于反应温度不同而能发生不同氧化还原反应的是:
A.②③④ B.②③ C.①②③ D.③④
4.要提纯下列物质(括号内物质为杂质),实验操作最合理的是:
A.CO![]() (SO
(SO![]() ):通入盛有品红溶液的冼气瓶后收集
):通入盛有品红溶液的冼气瓶后收集
B.Fe![]() (Fe
(Fe![]() ):加KSCN溶液后过滤
):加KSCN溶液后过滤
C.Cl![]() (HCl):通过盛有饱和氯化钠水溶液的洗气瓶后收集
(HCl):通过盛有饱和氯化钠水溶液的洗气瓶后收集
D.氯化铵溶液(FeCl![]() ):加足量NaOH溶液后过滤
):加足量NaOH溶液后过滤
5.下列反应的离子方程式书写正确的是:
A.向NH![]() HSO
HSO![]() 稀溶液中逐滴加入Ba(OH)
稀溶液中逐滴加入Ba(OH)![]() 稀溶液至刚好沉淀完全:
稀溶液至刚好沉淀完全:
Ba![]() +2OH
+2OH![]() +NH
+NH![]() +H
+H![]() +SO
+SO![]() ====BaSO
====BaSO![]() ↓+NH
↓+NH![]() H
H![]() O+H
O+H![]() O
O
B.碳酸钙溶于醋酸:CaCO![]() +2H
+2H![]() ====Ca
====Ca![]() +CO
+CO![]() ↑+H
↑+H![]() O
O
C.向硅酸钠溶液中通入过量的CO![]() :SiO
:SiO![]() +CO
+CO![]() +H
+H![]() O====H
O====H![]() SiO
SiO![]() ↓+CO
↓+CO![]()
D.澄清石灰水与少量苏打溶液混合:Ca![]() +OH
+OH![]() +HCO
+HCO![]() ====CaCO
====CaCO![]() ↓+H
↓+H![]() O
O
6.设N![]() 为阿伏加德罗常数,下列说法正确的是:
为阿伏加德罗常数,下列说法正确的是:
A.lmol甲基正离子(CH![]() )所含电子数为8N
)所含电子数为8N![]()
B.标准状况下将0.5
molSO![]() 气体与0.5molH
气体与0.5molH![]() S气体混合后,气体的分子总数为N
S气体混合后,气体的分子总数为N![]()
C.500mL 0.5mol/L的Ca(ClO)![]() 溶液中,含有ClO
溶液中,含有ClO![]() 的数目为0.5N
的数目为0.5N![]()
D.31g自磷分子中有N![]() 个P—P键
个P—P键
7.2006年10月8日,贵州省余庆县龙溪镇发生因为亚硝酸盐引起的食品中毒事件,17人被确定为亚硝酸盐中毒,其中一人死亡。卫生部的相关数据显示,亚硝酸盐已经成为导致化学性食物中毒的最主要原因之一。下列有关说法中不正确的是:
A.亚硝酸钠在外观、滋味上与食盐相似是容易引起误食中毒的原因之一
B.我国《食品添加剂使用卫生标准》规定任何食品中不得含有工业硝酸钠
C.长时间加热沸腾的水中的硝酸盐浓度较大,饮用后在人体内被还原成亚硝酸后,会对人体造成危害
D.可在腊肉、香肠等食品中加入少量的亚硝酸盐作为防腐剂和增色剂
8.已知2SO![]() (g)+O
(g)+O![]() (g)
(g)![]() 2SO
2SO![]() (g);△H=-197kJ/mol,同温下,往相同体积的密闭容器甲、乙中分别充入2molSO
(g);△H=-197kJ/mol,同温下,往相同体积的密闭容器甲、乙中分别充入2molSO![]() 、1molO
、1molO![]() 和1molSO
和1molSO![]() 、1molSO
、1molSO![]() 、0.5molO
、0.5molO![]() ,当它们分别达到平衡时放出的热量为Q
,当它们分别达到平衡时放出的热量为Q![]() kJ和Q
kJ和Q![]() KJ,则下列比较正确的是:
KJ,则下列比较正确的是:
A.Q![]() <1/2Q
<1/2Q![]() <98.5 B.Q
<98.5 B.Q![]() <1/2Q
<1/2Q![]() <=98.5
<=98.5
C.1/2Q![]() <Q
<Q![]() <98.5 D.Q
<98.5 D.Q![]() =1/2Q
=1/2Q![]() <98.5
<98.5
9.化学工业在经济发展中的作用举足轻重,下列有关工业生产的叙述中,正确的是:
A.硫酸生产中常采用高压条件提高SO![]() 的转化率
的转化率
B.合成氨中采用及时分离氨气提高反应速率
C.电解精炼铜时,会有金属银比铜先在阴极上析出
D.铝热反应常用于冶炼某些熔点较高的金属
l0.下列的各组离子存溶液中能够人最共存的是:
A.HCO![]() 、Ca
、Ca![]() 、Cl
、Cl![]() 、Na
、Na![]() B.HS
B.HS![]() 、Cu
、Cu![]() 、K
、K![]() 、SO
、SO![]()
B.HSO![]() 、K
、K![]() 、Cl
、Cl![]() 、Al
、Al![]() D.HPO
D.HPO![]() 、Na
、Na![]() 、NO
、NO![]() 、Ba
、Ba![]()
11.氨气跟二氧化氮在一定条件下反应可生成氮气和水,若反应使用的是![]() NH
NH![]() 和
和![]() NO
NO![]() ,则所得氮气的摩尔质量g/mol约为:
,则所得氮气的摩尔质量g/mol约为:
A.29.00 B.28.86 C.29.14 D.29.60
12.心酮胺是治疗冠心病的药物,它具有如下结构简式:
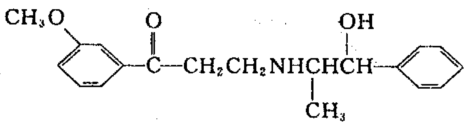
下列关于心酮胺的叙述错误的是:
A.1mol该物质最多可与7molH![]() 发生加成反应
发生加成反应
B.可以在催化剂作用下和溴反应
C.在碱性条件下可以发生水解反应
D.在一定条件下可以发生酯化反应
13.某溶液中只有NH![]() 、Cl
、Cl![]() 、H
、H![]() 、OH
、OH![]() 四种离子,且浓度大小的顺序为:c(NH
四种离子,且浓度大小的顺序为:c(NH![]() )>c(Cl
)>c(Cl![]() )>c(OH
)>c(OH![]() )>c(H
)>c(H![]() ),该溶液可能是:
),该溶液可能是:
A.由0.01molL![]() 的NH
的NH![]() ·H
·H![]() O溶液与0.01mol·L
O溶液与0.01mol·L![]() 的HCl溶液等体积混合而成
的HCl溶液等体积混合而成
B.由0.01molL![]() 的NH
的NH![]() Cl溶液与0.01mol·L
Cl溶液与0.01mol·L![]() 的HCl溶液等体积混合而成
的HCl溶液等体积混合而成
C.由10mL pH=11的NH![]() ·H
·H![]() O溶液与1mLpH=3的HCl溶液混合而成
O溶液与1mLpH=3的HCl溶液混合而成
D.由0.01mol·L的NH![]() Cl溶液与0.01mol·L
Cl溶液与0.01mol·L![]() 的NH
的NH![]() ·H
·H![]() O溶液等体积混合而成
O溶液等体积混合而成
14.下列关于胶体的认识错误的是:
A.鸡蛋清溶液中加入饱和(NH![]() )SO
)SO![]() 溶液生成白色沉淀,属于物理变化
溶液生成白色沉淀,属于物理变化
B.纳米材料微粒直径一般从几纳米到几十纳米(1nm=10![]() m),因此纳米材料属于胶体
m),因此纳米材料属于胶体
C.往Fe(OH)![]() 胶体中逐滴加入稀硫酸会先产生沉淀而后沉淀逐渐溶解
胶体中逐滴加入稀硫酸会先产生沉淀而后沉淀逐渐溶解
 D.水泥厂、冶金厂常用高压电除去烟尘,是因为烟尘微粒带电荷
D.水泥厂、冶金厂常用高压电除去烟尘,是因为烟尘微粒带电荷
15.下列关于晶体的说法一定正确的是:
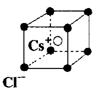
A.金属晶体的熔点都比离子晶体的熔点低
B.氯化铯晶体中每个Cs![]() 周围与其距离最近的Cs
周围与其距离最近的Cs![]() 有6个(晶体结构如右图)
有6个(晶体结构如右图)
C.石墨晶体中每个碳原子与4个碳原子以共价键相结合
D.晶体中一定存在着化学键
16.以Fe为阳极,石墨棒为阴极,对足量的Na![]() SO
SO![]() 溶液进行电解,一段时间后得到1mol Fe(OH)
溶液进行电解,一段时间后得到1mol Fe(OH)![]() 沉淀,此间共消耗水的物质的量为:
沉淀,此间共消耗水的物质的量为:
A.1.5mol B.2mol C.2.5mol D.3mol
二、(本题包括2道小题,共14分)
17.(6分)
(1)指出下列实验仪器和用品(已洗涤干净)使用时的第一步操作:
①红色石蕊试纸检验氨气的性质__________________________________________;
②滴定管(中和滴定)_____________________________________________________
(2)下列有关实验的叙述中,不正确的有:_____________________(填序号)
①蒸干AlCl![]() 溶液可得纯净的无水氯化铝;
溶液可得纯净的无水氯化铝;
②在苯酚溶液中滴入少量稀溴水溶液中立即出现白色沉淀。
③无法用分液漏斗将甘油和水的混合液体分离;
④用酸式滴定管量取20.00mL高锰酸钾酸性溶液;
⑤为了测定某溶液的pH,将未经湿润的pH试纸浸入到待测溶液,过一会取出,与标准比色卡进行对比;
⑥苯与溴水在铁粉的催化作用下制备溴苯:
18.(8分)
某课外活动小组利用下图装置进行乙醇的催化氧化实验并制取乙醛,图中铁架台等装置己略去,粗黑线表示乳胶管。请填写下列空白:
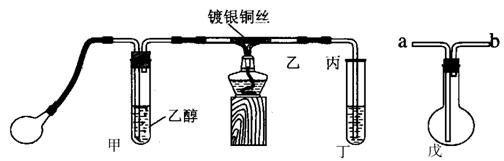
(1)甲装置常常浸在温度为70~80的水浴中,目的是________________________
(2)实验时,先加热玻璃管乙中的镀银钢丝,约1分钟后鼓入空气,此时铜可丝即呈红热状态。若把酒精灯撤走,控制一定的鼓气速度,铜丝能长时间保持红热直到实验结束。
(3)乙醇的催化氧化反应是______反应(填“放热”或“吸热”),该反应的化学方程式为______________________________________________
(4)控制鼓气速度的方法是_____________________________________________,若鼓气速度过快则会_________________________________________________________,若鼓气速度过慢则会______________________________________________________
(5)若试管丁中用水吸收产物,则要在导管乙、丙之间接上戊装置,其连接方法是(填戊装置中导管代号):乙接_____________、______________接丙。
三、(本题包括2道小题,共20分)
19.(9分)
A、B、C、D都是短期元素,原子半径:D>C>A>B。已知:A、B同周期, A、C处于同一主族;C原子核内的质子数等于A、B原子核内的质子数之和;C原子最外层电子数是D原子最外层电子数的3倍。试回答:
(1)写出元素的名称:A____________________、C_______________________。
(2)写出由B、D组成的两种化合物的电子式分别为:_____________、______________。
(3)C的固态氧化物属于______________晶体。写出表示C的氧化物的一种重要的工业用途___________________________________________________。
(4)A、C的最高价氧化物对应水化物中酸性较强的是_______________(写水化物的分子式)
(5)写出C的氧化物与D的最高价氧化物对应水化物反应的离子方程式:____________
20.(11分)
A、B、C、D、E、F六种物质在一定条件下有如所听示的相互转化关系,所有反应物和生成均已给出。
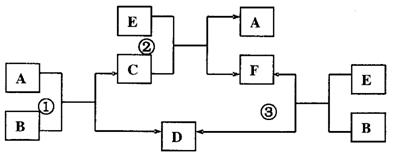
(1)若反应①、②、③均为溶液中的置换反应,A、D、E为常见金属单质,则A、D、E的还原性由强到弱的顺序为____________________。请写出满足以上要求的离子方程式:
反应①________________________________________________________________。
反应②________________________________________________________________。
(2)若反应①、②、③均为复分解反应。请写出满足要求的化学方程式:
反应①________________________________________________________________。
反应②________________________________________________________________。
(3)若B是水,C是一种有磁性的化合物,E是一种无色、无味的有毒气体,则反应①的化学方程式是_____________________________________________________。
四、(本题包括1道小题,共10分)
21.CO不仅是家用煤气的主要成分,也是重要的化工原料。美国近年来报导了一种低温低压催化工艺,把某些简单的有机物经“羰化”反应后可以最后产生一类具有优良性能的装饰性高分子涂料、粘合剂等。如下图所示:
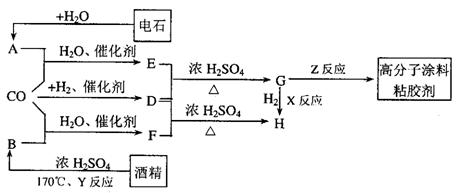
图中G(RCOOR)的一种同分异构体是E的相邻同系物;而H的一种同分异构体则是F的相邻同系物。已知D由CO和H![]() 按物质的理之比为1∶2完全反应而成,其氧化产物可发生银镜反应:H是含有4个碳原子的化合物。试写出:
按物质的理之比为1∶2完全反应而成,其氧化产物可发生银镜反应:H是含有4个碳原子的化合物。试写出:
(1)结构简式:E_____________、G_________________、R’基____________。
(2)G的两个同类别分异构体的结构简式(不带R字母)________________________及__________________________________。
(3)反应类型:X_______________、Y_________________、Z_____________________。
(4)写出下列转化的化学方程式:
![]() ①A+CO+H
①A+CO+H![]()
![]() E;②F+D
H。
E;②F+D
H。
①______________________________________________________________。
②______________________________________________________________。
五、(本题包括1道小题,共8分)
22.A是由C、H或C、H、O元素组成的有机物,取0.1molA在6.72L(标准状况)氧气中燃烧,燃烧后的产物通过足量浓硫酸,浓硫酸增重3.6g,再通过浓硫酸后的气体中点燃Mg条(足 量),生成总质量为26.4g的黑、白两种物质,且黑色生成物与白色生成物的质量比为1∶10。求:
(1)A的分子。
(2)写出属于不同类别两种有机物A的结构简式。
化学试题参考答案
一、选择题
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 |
| 答案 | C | D | B | C | A | A | B | A | D | A | B | C | D | B | B | C |
17.(8分)
(1)①用蒸馏水湿润(1分)②检查是否漏水(1分)
(2)①②⑤⑥(4分,每对一个给1分,每写错1每1个倒扣1分,扣完为止)
18.(8分)
(1)使生成乙醇蒸汽的速率加快
(3)放热 2CH![]() CH
CH![]() OH+O
OH+O![]()
![]()
![]() 2CH
2CH![]() CHO+H
CHO+H![]() O
O
(4)控制甲中单位时间内气泡数 带走过多热量,难以保证反应所需温度 反应放热太少,不能达到反应需要温度
(5)b a(每空1分)
19.(9分)
(1)硼、铝
(2)Na![]() [
[![]()
(3)离子。作耐火材料或电解冶铝
(4)H![]() BO
BO![]() (前面每空1分)
(前面每空1分)
(5)Al![]() O
O![]() +2OH====AlO
+2OH====AlO![]() +H
+H![]() O(2分)
O(2分)
20.(11分)
(1)E>A>D;(1分)
反应①:Fe+Cux ====Fe![]() +Cu:反应②:Zn+Fe
+Cu:反应②:Zn+Fe![]() ====Zn
====Zn![]() +Fe。
+Fe。
(或反应①:Cu+2Ag![]() ====Cu
====Cu![]() +2Ag;反应②:Fe+Cu
+2Ag;反应②:Fe+Cu![]() ====Fe
====Fe![]() +Cu等)
+Cu等)
(2)反应①:3NH![]() ·H
·H![]() O+AlCl
O+AlCl![]() ====3NH
====3NH![]() Cl+Al(OH)
Cl+Al(OH)![]() ↓
↓
反应②:NH![]() Cl+NaOH====NH
Cl+NaOH====NH![]() ·H
·H![]() O+NaCl。
O+NaCl。
(或反应①:HCl+CH![]() COONa====NaCl+CH
COONa====NaCl+CH![]() COOH;反应②:2NaCl+H
COOH;反应②:2NaCl+H![]() SO
SO![]() (浓)====2HCl↑+Na
(浓)====2HCl↑+Na![]() SO
SO![]() 等)
等)
(3)3Fe+4H![]() O(g)
O(g)![]() Fe
Fe![]() O
O![]() +4H
+4H![]() (每空2分)
(每空2分)
21.
(1)E: CH![]() =CHCOOH:G:CH
=CHCOOH:G:CH![]() =CHCOOCH
=CHCOOCH![]() ;R’基:—CH
;R’基:—CH![]() (各1分 共3分)
(各1分 共3分)
(2)HCOOCH![]() CH=CH
CH=CH![]() ;CH
;CH![]() COOCH=CH
COOCH=CH![]() 。
。
(3)X:加成反应;Y:消去反应;Z:加聚反应。
(4)①HC=CH+CO+H![]()
![]()
![]() H
H![]() C=CHCOOH
C=CHCOOH
②CH![]() CH
CH![]() COOH+CH
COOH+CH![]() OH
OH![]()
![]() CH
CH![]() CH
CH![]() COOCH
COOCH![]() +H
+H![]() O
O
22.(8分)
(1)因黑、白两种物质,且算得黑色生成物(C)与白色生成物(MgO)的物质量比为1∶3。故氧气过量,通过浓硫酸后的气体为CO![]() 和O
和O![]() 混合物。
混合物。
2Mg+O![]() =2MgO
2Mg+CO
=2MgO
2Mg+CO![]() =2MgO+C
=2MgO+C
0.5x x y 0.5y
40(x+y)+12×0.5y=26.4 x+y=3×0.5y
得x=0.2mol y=0.4mol
过量的n(O![]() )=0.1(mol) 生成的n(CO
)=0.1(mol) 生成的n(CO![]() )=0.2(mol)
(3分)
)=0.2(mol)
(3分)
生成的n(H![]() O)=3.6÷18=0.2(mol)。
O)=3.6÷18=0.2(mol)。
0.1molA的质量m(A)=0.2×44+3.6-0.2×32=6(g)
M(A)=6÷0.1=60
设A的分子式为C![]() H
H![]() O
O![]() ,2×12+4×1+z×16,z=2,A的分子式为C
,2×12+4×1+z×16,z=2,A的分子式为C![]() H
H![]() O
O![]() (3分)
(3分)
(2)CH![]() COOH
HCOOCH
COOH
HCOOCH![]() HCOCH
HCOCH![]() OH等(2分)
OH等(2分)