高三化学上学期第四次月考试卷
化 学 试 卷
本试卷分选择题和非选择题两部分,共108分。考试用时90分钟。命题:黄乃胜
可能用到的原子量:H—1 C—12 O—16 S—32 Cl—35.5
Na—23 K—39 Fe—56 Cu—64 Ba—137
第一部分选择题(共48分)
(本题包括12小题,每小题4分,共48分,每小题只有一个选项符合题意。)
1.14C是一种放射性同位素,在高层大气中由宇宙射线产生的中子或核爆炸产生的中子轰击14N可使它转变为14C,14N+![]() 14C+
14C+![]() ,下列说法正确的是
,下列说法正确的是
A.14C和14N互为同位素 B.14C和C60是同素异形体
C.14CO2的摩尔质量为46 D.地球上活着的生物体内,由于新陈代射作用也存在14C
2.下列说法不正确的是
A.在化学反应进行的过程中放出或吸收的热量称为反应热
B.对于吸热反应,反应物所具有的总能量总是低于生成物所具有的总能量
C.在101Kpa,1 mol物质完全燃烧生成稳定氧化物时,所放出的热量叫做该物质的燃烧热
D.在稀溶液中,1mol酸跟1mol碱发生中和反应所放出的热量叫做中和热
3.阿伏加德罗常数约为6.02×1023mol—1。下列叙述中正确的是
A.将含有NO2和N2O4分子共约 6.02×1023个的混合气,温度降至标准状况,其体积约为22.4L
B.7.8g Na2O2与足量水充分反应转移电子数约为6.02×1022个
C.0.05molC5H12分子中所含共价键数约为6.02×1023
D.标准状况下,1mol SiO2晶体中含有共价键数约为2×6.02×1023
4.将SO2通入CuSO4和NaCl的浓溶液中,溶液颜色变浅,析出白色沉淀,取该沉淀分析,知其中含Cl:35.7%,Cu:64.3%,SO2在上述反应中作用是
A.酸 B.漂白剂 C.还原剂 D.氧化剂
5.下列离子方程式表示正确的是
A.铜片加入稀硝酸中:Cu+NO3—+4H+ Cu2++NO↑+2H2O
B.过量SO2通入次氯酸钙溶液中:
Ca2++2ClO—+SO2+H2O CaSO3↓+2HClO
C.等体积、等物质的量浓度的NaHCO3和Ba(OH)2两溶液混合:
|
D.铁作电极电解饱和食盐水:2Cl—+2H2O
2OH—+H2↑+Cl2↑
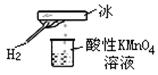
6. 如图所示的实验,发现烧杯中酸性KMnO4溶液褪色。若将烧杯中的溶液换成有少量KSCN和FeCl2溶液,溶液显红色。判断下列说法中正确的是
|
B.该条件下H2被冷却为液态氢,液氢的水溶液具有还原性
C.该条件下H2燃烧生成了只具有氧化性的物质
D.该条件下H2燃烧的产物中可能含有一定量的H2O2
7.以下说法正确的是( )
A.原子间必须通过电子得失或形成共用电子对而形成化学键,而与原子核无关。
B.非金属元素的原子间只形成共价键,金属元素的原子与非金属元素的原子间只形成离子键。
C.原子晶体的原子间只存在共价键,而形成分子晶体的原子间均存在范德瓦耳斯力。
D.原子是化学变化中的最小微粒,意即化学变化不产生新元素,核反应产生了新元素不为化学变化。
8.下列有关实验操作的说法中,不正确的是
A.振荡试管中的液体时,应用手指拿住试管,用手腕甩动
B.在做乙烯的制备实验时要加少量的碎瓷片,以防止溶液暴沸
C.因苯酚具有弱酸性,如果皮肤上不慎沾有苯酚,应立即用大量的NaOH稀溶液冲洗
D.中学阶段在使用试纸时,必须先用蒸馏水湿润,然后再将待测液滴到试纸上,看变化的结果,但是pH试纸除外,在使用时不能先用蒸馏水湿润。
9.相等物质的量的KClO3分别发生下述反应:①有MnO2催化剂存在时,受热分解得到氧气;②若不使用催化剂,加热到470℃左右,得到KClO4(高氯酸钾)和KCl。下列关于①和②的说法不正确的是
A.都属于氧化还原反应 B.发生还原反应的元素相同
C.发生氧化反应的元素不同 D.生成KCl的物质的量相同
10.下列各组离子,在指定的条件下能大量共存的是
A.滴加甲基橙试剂呈红色的溶液:Fe2+、NH4+、Cl—、NO3—
B.pH为11的溶液:S2—、SO32—、S2O32—、Na+
C.水电离出来的c(OH—)=10—13mol/L的溶液:K+、HCO3—、Br—、Ba2+
D.所含溶质为NaCl的溶液:K+、SiO32—、NO3—、Al3+
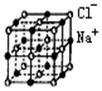
|
A.与K+距离相等且最近的O2—共有8个
B.与K+距离相等且最近的O2—构成的多面体是4面体
C.与K+距离相等且最近的K+有8个
D.右图一个KO2晶胞中摊得的K+和O2—粒子数均为4个
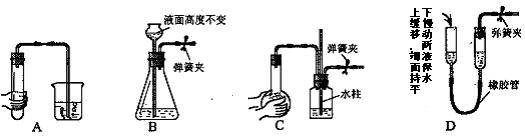 12下列各图所示装置,肯定不符合气密性要求的是
12下列各图所示装置,肯定不符合气密性要求的是
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 |
| 答案 |
 第二部分非选择题(共60分)
第二部分非选择题(共60分)
13(12分)右图是某学校实验室从化学试剂商店买回的硫酸试剂 标签上的部分内容。某次学生实验需要0.5mol/LH2SO4溶液480ml,若由你来配制所需溶液,请根据实验室已有的仪器和药品情况回答下列问题:
①实验中除了量筒、烧杯外还需要的其它仪器有: ;
②计算所需浓硫酸的体积是 mL;若该硫酸与等体积的水混合时,所得溶液中溶质的质量分数 49%(填写“<”、“=”或“>”);
③配制过程中需先在烧杯中将浓硫酸进行稀释。稀释时操作方法是:
14。(15分)固体A的化学式为NH5,它的所有原子的最外层都符合相应的稀有气体原子的最外层电子结构。该物质适当加热就分解成两种气体。试回答下列问题:
(1)固体A属于 晶体,它的电子式 。
(2)A溶于水后,溶液呈 性(酸、碱或中性),其原因是
(用化学方程式表示)
(3)A与铜或铜的某些化合物在一定条件下可合成CuH,CuH是一种难溶于物,它能与盐酸反应,放出气体。请写出这个反应的化学方程式:
_______________________________________________________________
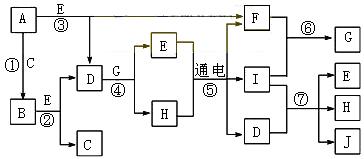
15.(9分)A~J是中学化学中常见的几种物质,它们之间的转化关系如下图关系。已知常温下A为固体单质,B为淡黄色粉末,C、F、I为气态单质,E为常温下为液体,且E可由C、F化合生成,J可作禽流感、SARS等病毒的杀菌消毒剂。
|
(1)写出E的电子式:
(2)写出反应⑦的离子方程式:
(3)向AlCl3溶液中加入少量固体B,写出反应的化学方程式
16(12分)工业和交通运输业的迅速发展,城市人口的高度集中,机动车数量的日益增多,人类向大气中大量排放烟尘和有害气体等,对大气造成了严重的污染。某中等城市近期一次的“空气质量日报”显示,该市的空气已受到一定程度的污染。一研究性学习小组对该市的空气污染情况进行了下列研究。
⑴小组一同学初步分析得出,该市空气污染的主要原因有:
A、使用石油液化气 B、燃烧含硫煤 C、粉尘污染
另一同学认为还有一个不可排除的原因是:D:
研究性学习小组就造成该市空气污染的最主要原因调查了该市100名市民和100位环保部门人士。调查结果如下图所示:
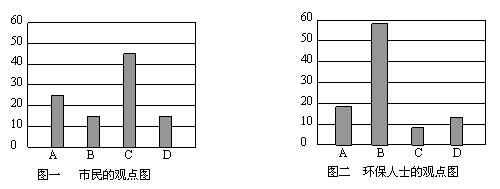 空气污染原因调查人数分布图
空气污染原因调查人数分布图
从市民和环保人士的不同观点上分析,你认为造成该市空气污染的主要有害成分是
(用化学式表示)
⑵空气污染形成酸雨。研究性学习小组对某城市的雨水进行了采样和分析,刚采集时测得PH为4.82,放在烧杯中经2小时后,再次测得PH为4.68,较长一段时间后发现PH不再变化,对此,你的合理解释是
⑶研究性学习小组取相当于标准状况下的空气1.000L(含氮气、氧气、二氧化碳、二氧化硫等),缓慢通过足量溴水,在所得溶液中加入过量的氯化钡溶液,产生白色沉淀,将沉淀洗涤,干燥,称得其质量为0.233g,进行这一实验的目的是 ,通过计算得到的结论是:空气中某有害气体的体积分数为 ;
⑷该小组提出下列措施以减少空气污染主要有害成分排放量,你认为合理的是 (填序号)
①用天然气代替煤炭作民用燃料 ②改进燃烧技术,提高煤的燃烧效率
③工厂生产时将燃煤锅炉的烟囱造得更高 ④燃煤中加入适量生灰石后使用
17.(12分)为测定(NH4)2SO4和NH4HSO4固体混合物的组成,现称取该样品四份,分别加入相同浓度的NaOH溶液各40.00mL,加热到120℃左右,使氨气全部逸出[(NH4)2SO4和NH4HSO4分解温度高于200℃],测得有关实验数据如下(标准状况):
| 实验序号 | 样品的质量(g) | NaOH溶液的体积(ml) | 氨气的体积(L) |
| Ⅰ | 7.4 | 40.00 | 1.68 |
| Ⅱ | 14.8 | 40.00 | 3.36 |
| Ⅲ | 22.2 | 40.00 | 1.12 |
| Ⅳ | 37.0 | 40.00 | 0.00 |
(1)实验过程中发生的有关反应的离子方程式为
(2)由Ⅰ组数据直接推测:标准状况下3.7g样品进行同样实验时,生成氨气的体积为 L;
(3)试计算该混合物中的(NH4)2SO4和NH4HSO4物质的量之比 ;
(4)欲计算该NaOH溶液的物质的量浓度应选择第 组数据,由此求得NaOH溶液的物质的量浓度为 。(2—3小问只填结果,不必写出计算过程,4小问要求写出计算过程)
参考答案
第一部分选择题(共48分)
1.D 2.D 3.B 4.C 5.C 6.D
7.D 8C 9D 10.B 11.D 12D
第二部分非选择题(共60分)
13。 ①500mL容量瓶、玻璃棒、胶头滴管 (3分)
②13.6mL; (3分) > (3分)
③在250mL烧杯中先加入适量蒸馏水,再将量取的浓硫酸沿烧杯内壁慢慢倒入烧杯中,并用玻璃棒不断搅拌 (3分)
![]() H
H
14.(1)离子 (3分) [H:N:H]+[:H]— (3分)
H
(2)碱(3分) NH4H+H2O NH3·H2O+H2↑
(3分)
(3)CuH+HCl CuCl+H2↑(3分)![]()
15.(1):O:H (3分)
H
(2)Cl2+2OH— Cl—+ClO—+H2O(3分)
(3)4AlCl3+6Na2O2+6H2O 4Al(OH)3
↓+12NaCl+3O2↑(3分)
16 (12分)⑴机动车尾气污染; SO2 (每空2分)
⑵雨水中的H2SO3逐渐被空气中的氧气氧化成H2SO4
⑶测定空气中二氧化硫的体积分数
空气中二氧化硫的体积分数为2.24%
⑷①④
17.(1)H++OH—=H2O(1分) NH4++OH— NH3↑+H2O(1分)
(2)3.7g为Ⅰ中样品质量7.4g的![]() ,故得到氨气体积亦为1.68升的
,故得到氨气体积亦为1.68升的![]() 即0.84L(2分)
即0.84L(2分)
(3)按Ⅰ组数据计算,设n[(NH4)2SO4]和n (NH4HSO4)分别为x、y,依题意有
![]() 解得:
解得:![]()
故:n [(NH4)2SO4] : n (NH4HSO4)=0.0125:0.05=1:4 (2分)
(4)应选NaOH已完全反应的第Ⅲ组(2分),据(3)的数据,22.2g样品中共含:
n(H+)=n(NH4HSO4)=0.05×![]() ;据H++OH—=H2O 知消耗NaOH
;据H++OH—=H2O 知消耗NaOH
0.15mol。据NH4++OH— NH3↑+H2O知
生成1.12L NH3消耗NaOH![]() ,
,
故NaOH溶液的物质的量浓度为:
![]() (4分)
(4分)