高三化学上学期第四次调查测试
化学试卷
命题人: 程永东 审定人: 陈浩 成绩:
可能用到的相对原子质量:H-1 C-12 N-14 O-16 Na-23 Mg-24 Al-27 S-32 Cl-35.5 K-39 Ca-40 Fe-56 Cu-64 Ba-137
第I卷(选择题,共64分)
一、选择题(本题包括8个小题,每小题4分,共32分。每题只有一个选项符合题意。)
1.据报道,科学家已成功合成了少量O4,有关O4的说法正确的是
A.O4与O3、O2是同素异形体 B.O4比O2稳定
C.等质量的O4与O3含原子个数比为4:3 D.O4的摩尔质量是64g
2.亚硝酸盐中毒,又名乌嘴病、紫绀病、肠源性青紫病。亚硝酸盐可将正常的血红蛋白氧化成高铁血红蛋白,失去携氧能力,使组织出现缺氧现象。美蓝是亚硝酸盐中毒的有效解毒剂。下列说法不正确的是
A.在中毒过程中血红蛋白被氧化 B.中毒时亚硝酸盐发生氧化反应
C.药品美蓝应具有还原性 D.解毒时高铁血红蛋白被还原
3.下列反应中,氧化产物是有色单质的是
A.2NO+O2=2NO2 B.CuCl2+Zn=Cu+ZnCl2
C.2KI+Br2=2KBr+I2 D.NaH+H2O =NaOH+H2↑
4.下列物质发生变化时,所克服的粒子间相互作用属于同种类型的是
A.液溴和苯分别受热变为气体 B.干冰和氯化铵分别受热变为气体
C.二氧化硅和铁分别受热熔化 D.食盐和葡萄糖分别溶解在水中
5.教材是学习的重要材料,但不能迷信教材。下列是中学化学教材中摘录的部分表述内容,根据你所学的化学知识判断,其中不够科学严密的是
A.第一册教材P101:元素性质的周期性变化是元素原子的核外电子排布的周期性变化的必然结果。
B.第一册教材P17:离子方程式不仅可以表示一定物质间的某个反应,而且可以表示所有同一类型的离子反应。
C.第三册教材P20:除了加入电解质可使某些胶体聚沉外,将两种带相反电荷的胶体混合,也能发生聚沉。
D.第二册教材P34:不同的化学反应,具有不同的反应速率,这说明,参加反应的物质的性质是决定化学反应速率的重要因素。
6.利用相关数据作出的推理或判断不正确的是
A.用键能大小的数据,可判断分子的稳定性
B.用原子半径的数据,可推断元素的主要化合价
C.用沸点数据,可推测能否将一些液体混合物用分馏的方法分离开来
D.用溶解度数据,可判断煮沸Mg(HCO3)2溶液所得产物是Mg(OH)2还是MgCO3
7.下列叙述不正确的是
A.硝酸银溶液通常保存在棕色试剂瓶中,是因为硝酸银见光易分解
B.将Cl2和SO2分别通入到品红溶液中,均能使品红溶液退色
C.反应AgCl + NaBr![]() AgBr
+ NaCl能在水溶液中进行,是因为AgBr比AgCl更难溶于水
AgBr
+ NaCl能在水溶液中进行,是因为AgBr比AgCl更难溶于水
D.常温下浓硫酸可贮存在铁制或铝制容器中,说明常温下铁和铝与浓硫酸不反应
8.18.4mol/L硫酸和2mol/L的硫酸,在实验室中敞口放置,它们的质量和放置天数的关系如右图。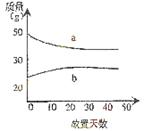 分析a、b曲线变化的原因是
分析a、b曲线变化的原因是
A.a升华、b冷凝 B.a挥发、b吸水
C.a蒸发、b潮解 D.a冷凝、b 吸水
二、选择题(本题包括8小题,每小题4分,共32分。每小题有一个或两个选项符合题意。)
9.下列物质中不会因见光而分解的是
A.NaHCO3 B.HNO3 C.AgI D.HClO
10.设NA代表阿佛加德罗常数,下列说法中正确的是
①常温常压下,17g甲基(—14CH3)所含的中子数为9NA
②常温常压22.4L NO气体的分子数小于NA
③64g的铜发生氧化还原反应,一定失去2NA个电子
④7.8 g Na202中含有的阴离子数目约为6.02×1022
⑤标况时,22.4L二氯甲烷所含有的分子数为4NA
⑥1 mol金刚石中含有c—c键的数目约为6.02×1023
A.①②⑥ B.②④⑤ C.②④ D.⑤⑥
11.叠氮酸(HN3)与醋酸酸性相似,下列叙述中错误的是
A.HN3水溶液中微粒浓度大小顺序为:c(HN3)>c(H+)>c(N3—)>c(OH—)
B.HN3与NH3作用生成的叠氮酸铵是共价化合物
C.NaN3水溶液中离子浓度大小顺序为:c(Na+)>c(N3—)>c(OH—)>c(H+)
D.N3—与CO2含相等电子数
12.下列反应的离子方程式书写不正确的是
A.次氯酸钙溶液中通人少量S02气体:
Ca2++2ClO一+S02+H20=CaS03↓+2HclO
B.醋酸和碳酸氢钠溶液混合:
CH3COOH+HCO3-=CO2↑+H2O+CH3COO-
C.氯化亚铁溶液中通入氯气:2Fe2++Cl2=2Fe3++2Cl-
D.实验室制Fe(OH)3胶体:Fe3++30H一=Fe(OH)3(胶体)
13. a mol FeS与b mol FeO投入到V L、C mol•L-1的硝酸溶液中充分反应,产生NO气体,所得澄清溶液的成分可看作是Fe(NO3)3、H2SO4的混合液,则反应中未被还原的硝酸可能为
A.(a+b)×63g B.(a+b)×189g
C.(a+b)mol D.(CV-![]() )mol
)mol
14.用pH大小表示溶液的酸碱性相对强弱有许多不足之处。因此,荷兰科学家Henk Van Lubeck引入了酸度(AG)的概念,即把电解质溶液中的酸度定义为c(H+)与c(OH一)比值的对数,用公式表示为AG=lg [c(H+)/c(OH一)] 。常温下,在AG=10的溶液中能大量共存的离子是
A.Ca2+、K+、Cl- S2O32-、 B.NH4+、Fe2+、 I一、NO3-
C.Na+ 、K+、ClO-、S2- D.Na+、Cl-、SO42-、K+
15.一定温度下,在恒容密闭容器中发生如下反应:2A(g) + B(g)![]() 3C(g),若反应开始时充入2molA和2molB,达平衡后A的体积分数为a%。其它条件不变时,若按下列四种配比作为起始物质,平衡后A的体积分数大于a%的是
3C(g),若反应开始时充入2molA和2molB,达平衡后A的体积分数为a%。其它条件不变时,若按下列四种配比作为起始物质,平衡后A的体积分数大于a%的是
A.2mol C B.2molA、1molB和1molHe(不参加反应)
C.1molB和1molC D.2molA、3molB和3molC
16.类推是在化学学习和研究中常用的思维方法,但类推出的结论最终要经过实践的检验才能决定其正确与否,下列几种类推结论中不正确的是
A.钠、镁都是活泼金属,由金属钠和镁引起火灾都不能用干冰灭火器灭火
B.NaHC03溶液能与NaAl02反应生成白色沉淀,NaHS03溶液也能与NaAl02反应生成白色沉淀
C.NH4C1、NH4I结构相似,将两种固体分别加热,都分解生成HX和NH3
D.原电池中通常是活泼金属做负极,不活泼金属做正极,用铜和铝与浓硝酸构成原电池时,铝是负极
第Ⅱ卷(非选择题,共86分)
三、实验题(本题包括2小题,共8+12=20分)
17.(8分)(1)实验室常见到如图所示的仪器,该仪器为两头密封的玻璃管,中间带有一根玻璃短柄.当玻璃管内装有碘片时,用此仪器进行碘的升华实验,具有装置简单、操作方便、现象明显、可反复使用等优点.
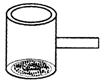
①用此仪器不能反复进行的实验是
A.NH4Cl受热分解的实验
B.KMnO4受热分解的实验
C.白磷和红磷在一定温度下相互转变的实验
D.无水CuSO4与胆矾的互变实验
②试再举一个能用此仪器进行反复实验的例子
|
|
|
|
|
![]()
![]() ①
①
|
|
![]()
![]()
|
|
|
|
|
![]()
|
|
|
|
|
|
|
|
|
|
|
结论:CuSO4是锌与稀硫酸反应的催化剂
18.(12分)工业上测量SO2、N2、O2混合气体中SO2含量的装置如图;反应管装有碘的淀粉溶液。SO2和I2发生反应方程式为(N2、O2不与I2反应):
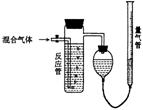
(1)混合气体进入反应管后,量气管内增加的水的体积等于 的体积(填写气体的分子式)。
(2)反应管内溶液蓝色消失卮,没有及时停止通气,则测得的SO2含量 (选填:偏高,偏低,不受影响)。
(3)反应管内的碘的淀粉溶液也可以用 代替(填写物质名称)。
(4若碘溶液体积为VamL.,浓度为Cmol·L-1,N2与O2的体积为VbmL(已折算为标准状况下的体积)。用C、Va、Vb表示SO2的体积百分含量为: 。
(5)将上述装置改为简易实验装置,除导管外,还需选用的仪器为. (选下列仪器的编号)。
a.烧杯 b.试管 c.广口瓶 d.容量瓶 e.量筒 f.单孔塞 g.双孔塞
四.填空题(本题包括2小题,共9+12+12=33分)
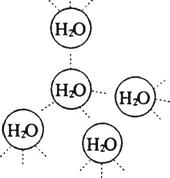
19.(9分)水是我们熟悉的物质。每个水分子都能被其他4个水分子包围形成如右图所示的四面体单元,由无数个这样的四面体再通过氢键可相互连接成一个庞大的分子晶体——冰。
(1)氢键的形成使冰的密度比水 ,氢键有方向性和饱和性,故平均每个水分子最多形成 个氢键。
(2)实验测得冰中氢键的作用能为18.8 kJ/mol,而冰的熔化热为5.0 kJ/mol,说明
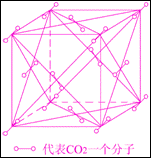 (3)干冰的外观和冰相像,可由二氧化碳气体压缩成液态后再急剧膨胀而制得。右图为干冰晶体结构示意图。通过分析,可知每个CO2分子周围与之相邻等距的CO2分子共
个。一定温度下,已测得干冰晶胞(即图示)的边长a=5.72×10-8cm,则该温度下干冰的密度为 g/cm3。
(3)干冰的外观和冰相像,可由二氧化碳气体压缩成液态后再急剧膨胀而制得。右图为干冰晶体结构示意图。通过分析,可知每个CO2分子周围与之相邻等距的CO2分子共
个。一定温度下,已测得干冰晶胞(即图示)的边长a=5.72×10-8cm,则该温度下干冰的密度为 g/cm3。
20.(12分)亚硝酸钠易溶于水,有碱味,有氧化性,也有还原性。NaNO2大量用于染料工业和有机合成工业中,也可用作水泥施工的抗冻剂。然而由于NaNO2有毒性,将含该物质的废水直接排放会引起水体严重污染,所以这种废水必须处理后才能排放。处理方法之一如下:
__NaNO2 + ___KI + __ _____ ![]() ___NO +__ I2 +__ K2SO4 +
__Na2SO4 +__ _____
___NO +__ I2 +__ K2SO4 +
__Na2SO4 +__ _____
(1) 根据提示,写出上述反应的离子方程式
(2)在上述反应中,若要生成50.8 g I2,则电子转移了_______________个。
(3)用上述反应来处理NaNO2并不是最佳方法,其原因是________________________________________。从环保角度来讲,要处理NaNO2,所用的物质的_________(填“氧化性”或“还原性”)应该比KI更____(填“强”或“弱”)。
(4)亚硝酸钠可以与酸反应生成亚硝酸,亚硝酸是不稳定的弱酸,它只存在于冷的稀溶液中,易发生如下分解反应:3HNO2=2NO↑+HNO3+H2O
请用两种简便的化学方法来鉴别亚硝酸钠和氯化钠。
方法一:__________________________________________________________。
方法二:__________________________________________________________。
21.(12分)⑴化学工业在国民经济中占有极其重要的地位,江苏省是国内最早的硫酸生产基地之一。
①硫酸生产中,根据化学平衡原理来确定的条件或措施有 (填写序号)。
A.矿石加入沸腾炉之前先粉碎 B.使用V2O5作催化剂
C.接触室中不使用很高的温度 D.净化后炉气中要有过量的空气
E.接触氧化在常压下进行 F.吸收塔中用98.3%的浓硫酸吸收SO3
②若实验室在537℃、1.01×105Pa和催化剂存在条件下,向某密闭容器中充入1 mol SO2和0.5 mol O2,此时体积为100 L。在温度压强不变条件下反应达到平衡,SO2体积分数为0.06。若保持温度压强不变,充入1 mol SO3,则平衡时SO3的体积分数为 .
⑵室温下为液态的金属是 (填汉字名称)。电解它的一价金属的硝酸盐溶液时,阴极得到的产物是该金属的单质。当阴极消耗2 mol该盐的阳离子时,阳极可得1 mol的气体产物,则此气体的产物是 (填分子式)。由此可推断得知该盐的化学式是 ,其阴极上所发生的还原反应方程式是: 。
五.填空题(本题包括2小题,共10+11=21分)
22、(10分)麻醉剂的发现和使用,是人类医疗史上了不起的一项成就,它可使患者在接受治疗时感觉不到疼痛。
(1)笑气是人类最早应用于医疗的麻醉剂之一,它可由NH4NO3在微热条件下分解产生,产物除N2O外还有一种,此反应的化学方程式为 。有关理论认为N2O与CO2分子具有相似的结构(包括电子式),则其空间构型是 型,N2O为 分子(极性或非极性)
(2)另一种麻醉剂为乙醚(C2H5-O-C2H5),乙醚和正丁醇(C4H9OH)互为同分异构体,但两者之间沸点差异较大,其中沸点高的是(填名称)_______________,沸点高的原因是___________________________________________。
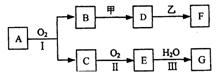 23.(11分)物质的转化关系如下图所示(有的反应可能在水溶液中进行)。其中A为化合物,甲可由两种单质直接化合得到,乙为金属单质,G为酸,乙在C的浓溶液中发生钝化。
23.(11分)物质的转化关系如下图所示(有的反应可能在水溶液中进行)。其中A为化合物,甲可由两种单质直接化合得到,乙为金属单质,G为酸,乙在C的浓溶液中发生钝化。
(1)若A为黄色固体,C能使品红试液褪色,D的水溶液中加入HNO3酸化的AgNO3溶液有白色沉淀生成。则 ①工业上反应I在 中进行,反应Ⅲ在 (均填设备名称)中进行。
②由两种单质直接化合得到甲的反应条件是 或 。
③反应I的化学方程式是 。
(2) 若甲为淡黄色固体,D、F的溶液均呈碱性,用两根玻璃棒分别蘸取A、G的浓溶液并使它们接近,有大量白烟生成。则
①甲的电子式是 。
②D的溶液与乙反应的离子方程式是 。 ③若1.7gA与O2反应生成气态的B和C时放出22.67kJ热量,写出该反应的热化学方程式:
六.计算题(本题包括2小题,共4+8=12分)
24.(4分)一块铜片投入一浓HNO3的试管中,充分反应后铜片有剩余,若将反应产生的气体用隔绝空气的方法收集,可得67.2mL(不计水蒸气)测得此气体对H2的相对密度为28,若将此气体与33.6mLO2混合后通入水中,经过足够长的时间后,水刚好充满整个容器,(气体体积均在标况下测得)
求(1)此实验中铜片减轻了 克 (2)被还原的HNO3的质量为 克
25.(8分)有一瓶(约100mL)的硫酸和硝酸的混合液,取出10.00mL该溶液,加入足量的BaCl2溶液。充分反应后过滤、洗涤、烘干,可得4.66g沉淀。滤液和2.00mol·L-1NaOH溶液反应,共用去35.00mL碱液时恰好中和,
求:(1)混合液中H2SO4、HNO3的物质的量浓度各是多少?
(2)另取10.00mL原混合酸溶液,加入1.60g铜粉,在标准状况下可收集到多少毫升气体?
化学答案与评分标准
1A 2B 3C 4A 5C 6B 7D 8B
9A 10C 11B 12AD 13BD 14D 15AB 16CD
17.(1)B ,NO2与N2O4 的互变 (2)1 . 4(2+2+4=8分)
18.SO2+I2+2H2O=H2SO4+2HI
(1)N2、O2的体积
(2)偏低
(3)酸性高锰酸钾溶液或溴水
(4)VSO2%=22.4CVa/(22.4CVa+Vb)×100%(其它合理答案也给分)
(5)bceg或beg或ceg(2分X6=12分)
19(共9分)
(1)小(1分)2(2分)(2)液态水中仍然存在大量氢键(2分)
(3) 12 1.56(2+2=4分)
20.(12分)
(1) 2NO2 -+ 2I -+ 4H+ =2NO↑ +I2 +2H2O(2分)
(2) 2.408×1023 (或0.4NA) (2分)
(3)反应生成了NO ,该物质会造成大气污染 ,(2分)
还原性 ,(1分)强 (1分)
(4)方法一:取适量样品于两支试管中,分别加入稀盐酸,有气体产生,气体在瓶口变为红棕色的为NaNO2,无明显现象的为NaCl(2分)
方法二:取适量样品于两支试管中,分别加入稀盐酸和碘化钾淀粉溶液,若溶液变蓝,证明该物质的是NaNO2;若无明显现象,该物质则是NaCl(其他合理答案也可)(2分)
21.(12分,每空2分)
⑴ ①CD ② 0.91 ⑵汞 O2 Hg2(NO3)2 Hg22++2e-=2Hg
22、(10分,每空2分)
(1)NH4NO3 ==== N2O↑ + 2H2O 直线型 非极性
(2)正丁醇 正丁醇分子间有氢键
23 (11分)(1)①沸腾炉 吸收塔(每空1分,共2分)
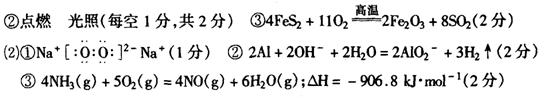
24. 0.192g和0.252g(4分,每空2分)
25. (1)C(H2SO4)=2mol·L-1 (2分) C(HNO3)=3mol·L-1 (2分)
(3)373mL(4分)