高三化学下学期三校联考试题
时间120分钟 满分 150分
第Ⅰ卷 (选择题共72分)
可能用到的原子量:H :1 O:16 S:32 Cu:64 Na:23 C:12 N: 14 Ca:40
K:39 Li:7 Rb:85 Cs:133 Mg:24 Al:27,Cr:52 Fe:56 Cl:35.5
一.选择题:本题包括8小题,每小题4分,共32分每小题只有一个正确选项
1.Rm+与Xn-具有相同的电子层结构,则微粒半径
A 前者大于后者 B 前者小于后者
C 前者等于后者 D 大小比较不能确定
2.下列试剂可以贮存在普通玻璃试剂瓶中的是
A.氢氟酸 B.浓盐酸 C.溴 水 D.碘化银固体
3.“纳米材料”是当代材料科学的前沿,其研究成果广泛应用于催化剂,军事科学及高新技术中。“纳米材料”是直径为几纳米至几十纳米的材料(1纳米为10-9m),若将纳米碳分子分散到水中,所形成的分散系具有的性质是
①能全部透过半透膜 ②能全部透过滤纸 ③形成黑色浊液
④形成无色透明溶液 ⑤具有丁达尔效应
A.① ④ B.②⑤ C.只有③ D.只有④
4.用石墨电极电解下列物质的水溶液,两极都有气体生成且电解过程中溶液PH增大的是
A.KI B.H2SO4 C.NaOH D.Na2SO4
5.下列有关金属腐蚀的说法正确的是
A.金属腐蚀指不纯金属接触到的电解质溶液进行化学反应而损耗的过程
B.电化腐蚀指在外加电流的作用下不纯金属发生化学反应而损耗的过程
C.钢铁腐蚀最普遍的是吸氧腐蚀,负极吸收氧气最终转化为铁锈
D.金属的电化腐蚀和化学腐蚀本质相同,但电化腐蚀伴有电流产生
6.下列说法正确的是( )
A、阳离子只有氧化性,阴离子只有还原性
B、阴极发生还原反应,正极亦发生还原反应
C、Cl2与碱溶液的反应,实质是HClO与OH-的反应
D、从氯水中分离出HClO,可加入CaCO3蒸馏
7.电解普通水(H2O)和重水(D2O)的混合物,通电一段时间后两极共生成气体18.5g,体积为33.6L(标况),在生成的气体中,重氢(D)和普通氢(H)的原子数比为( )
A、1:2 B、2:3 C、1:3 D、2:5
8.下列变化中证明硫酸是强酸的是( )
A、和铜反应 B、和锌反应放出H2
C、与NaCl反应制HCl D、与Ca3(PO4)2反应制H3PO4
二.选择题:本题包括10小题,每小题4分,共40分每小题有一个或二个选项正确。多选、错选不给分,漏选每题仅给2分
9.在一定温度下,向饱和烧碱溶液中放入一定量的Na2O2,完合反应恢复到原温度,
下列说法正确的是( )
(A)溶液中[Na+]增大,有O2放出。
(B)溶液PH值不变,有H2放出。
(C)溶液中Na+数目减少,有O2放出。
(D)溶液中PH值不变,有O2放出。
10.某溶液中的Cl-、Br-、I-的物质的量之比为2:3:4,要使溶液中Cl-、Br-、I-物质的量之比为4:3:2则通入Cl2的物质的量是原溶液中I-的量的( )
A、![]() B、
B、![]() C、
C、![]() D、
D、![]()
11.比较下列物质的稳定性,正确的是( )
(A)Na2O>Na2O2 (B)Na2CO3>NaHCO3>H2CO3
(C)Na2SO4·10H2O>Na2CO3·10H2O (D)NaClO>NaCl>NaF
12.下列离子反应方程式书写正确的是
A.向Ba(OH)2溶液滴加NaHSO4溶液至沉淀恰好完全:
|
B.用Pt 电极电解MgCl2溶液 2Cl—+2H2O=======Cl2↑+H2↑+2OH—
C.往漂白粉溶液中通入SO2 Ca2++2ClO—+SO2+H2O=CaSO3↓+2HClO
D.苯酚钠溶液与氯化铝溶液反应 3C6H5O—+Al3++3H2O=3C6H5OH+Al(OH)3↓
13.将KCl和KBr混合物13.4g溶于水配成500mL溶液,通入过量Cl2,反应后将溶液蒸干得固体11.175g,则原所配溶液中K+、Cl-、Br-的物质的量浓度之比为:
A、3:2:1 B、1:2:3 C、1:3:2 D、3:1:1
14.250C PH=a的NaOH溶液和PH=b和NaOH溶液等体积混合后的PH值为( )
A、![]() B、
B、![]() C、
C、![]() D、
D、![]()
![]() 15.已知
15.已知
同温下,往相同体积的密闭容器甲、乙中分别充入2molSO2、1molO2和1molSO3、1molSO2、0.5mol当它们分别达到平衡时放出的热量为Q1和Q2KJ,则下列比较正确的是
A.Q2= 1/2 Q1=98.5 B.Q2=1/2 Q1<98.5 C.Q2<1/2 Q1<98.5 D.1/2 Q1< Q2 <98.5
![]() 16.铅蓄电池反应如下:
16.铅蓄电池反应如下:![]()
对铅蓄电池工作情况,下列叙述错误的是
A.放电时Pb极为负极
B.充电时蓄电池上标有“+”号电极连接电源正极
C.放电时正极反应为PbO2+ SO42— +4H++2e ==PbSO4+2H2O
D.充电时蓄电池上标有“—”号的电极发生氧化反应
17.使18g焦炭发生不完全燃烧,所得气体中CO占![]() 体积,CO2占
体积,CO2占![]() 体积,已知
体积,已知
C(S)+ ![]() O2(g)=CO(g)
△H =
-Q1KJ/mol 。 CO(g)+
O2(g)=CO(g)
△H =
-Q1KJ/mol 。 CO(g)+ ![]() O2(g)=CO2(g) △H = -Q2KJ/mol 与这些焦炭完全燃烧相比较,损失的热量是( )
O2(g)=CO2(g) △H = -Q2KJ/mol 与这些焦炭完全燃烧相比较,损失的热量是( )
A.![]() Q1KJ B.
Q1KJ B.![]() Q2KJ C.
Q2KJ C.![]() (Q1+Q2)KJ D.
(Q1+Q2)KJ D.![]() Q2KJ
Q2KJ
18.下列各组离子中,能在水溶液中大量共存,且溶液显酸性的是
①Na+、H+、SO42—、HCO3- ②K+、Al3+、H2PO4- 、HCO3-
③Na+、H+、Cl—、C6H5O— ④H+、Fe2+、NO3- 、Cl—
⑤Na+、Al3+、NO3- 、AlO2- ⑥Cu2+、Mg2+、SO42— 、NO3-
A.②③⑤ B.①⑥ C.①④⑤ D.只有⑥
第二卷 (非选择题共78分)
三.本题包括 2小题共 14分
19.(6分)经测定H2O2为二元极弱酸,其酸性比碳酸弱且有漂白性。它在碱性溶液中极
不稳定,易分解生成H2O和O2。若向Na2O2中通入干燥的CO2的气体,Na2O2与CO2并
不反应,它与潮湿的CO2反应放出气体后的液体仍可使品红试液颜色有所减退。
(1)写出H2O2在其水溶液中的电离方程式: 。
(2)用化学方程式表示Na2O2和潮湿的CO2气体反应的过程:
① ② 。
20.(8分)根据CuSO4晶体结晶水含量的测定,填写下列空白(1)此实验操作顺序如下:
①称量坩埚、晶体 ②加热冷却 ③称量 ④________⑤_________⑥计算 ⑦误差分析
(2)用托盘天平(指针向上的)称量时若指针偏向左边,则表示_____________A左盘重,样品轻 B 左盘轻砝码重 C右盘重砝码轻 D右盘轻,样品重
(3)在进行④⑤步操作中,有时要重复进行,这是由于__________________。
(4)实验用品除托盘天平、研钵、玻棒、三脚架、泥三角、瓷坩埚、酒精灯、火柴外,
还缺少的两种仪器是__________________。
四.本题包括 2小题共 24分
21.(8分)设计一原电池,实现总离子反应为:![]() 的化学反应。说出
的化学反应。说出
正负极材料,电解质溶液并写出电极离子反应方程式,画出装置图。
22.(16分)纯碱中常含有少量的NaCl杂质,利用下图的仪器装置可用来测定纯碱Na2CO3
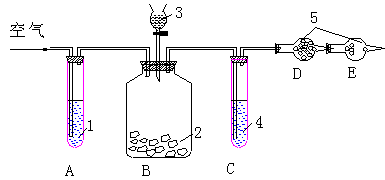 |
的百分含量:供选用的试剂有:纯碱样品、碱石灰、浓盐酸、浓H2SO4、NaOH溶液,稀硫酸,自来水、无水CaCl2、饱和NaHCO3溶液。
实验步骤:a按图连接好装置并检查气密性;b准确称量盛有干燥剂的干燥管D的质
量(m1g);c准确称取纯碱样品质量(n1g)并放入广口瓶内;d从分液漏斗中缓缓滴试剂
3至不再产生气体为止;e缓缓鼓入空气数分钟,然后再称量D的总质量(设为m2g),
根据上述实验,回答下列问题:
(1)试剂1、3、4、5分别为1________3_________4__________5________
(2)进行操作e时,要缓缓鼓入空气数分钟,鼓入空气的作用是____ _____。
(3)如果撤去A装置,直接向B中缓缓鼓入空气,则会导致实验结果________
(填 “偏大”、“偏小”或“不变”)。
(4)进行d、e操作时,均要求“缓缓”进行,理由是_______ _________.
。
(5)装置C和E的作用分别是C E 。
(6)根据此实验,计算纯碱中Na2CO3百分含量的数学表达式为: 。
五.本题包括 2 小题共18 分
23.(共10分)A、B是两种含氧酸的酸式盐溶液,焰色反应均显黄色,D、E均为无色气体,H为不溶于酸的白色沉淀。
回答以下问题:
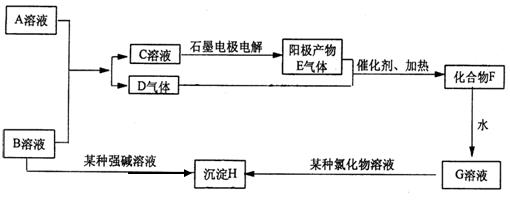 1)化学式:A_______________
B.____________
1)化学式:A_______________
B.____________
2)C溶液电解时,阳极电极反应方程式_______ ________
3)B溶液与某强碱反应恰好使沉淀后溶液显中性时离子反应方程式
___________________________________________________________
4) A与B溶液混合时发生反应的离子反应方程式
___________________________________________________________
回答以下问题:
1)化学式:A_______________ B.____________
2)C溶液电解时,阳极电极反应方程式_______ ________
3)B溶液与某强碱反应恰好使沉淀后溶液显中性时离子反应方程式
___________________________________________________________
4) A与B溶液混合时发生反应的离子反应方程式
___________________________________________________________
24.(共8分)含有苯环的化合物A有下列一系列变化关系,其中D能使FeCl3显紫色,
E、F、G能发生银镜反应:且知,A在苯环上一溴代物只有二种
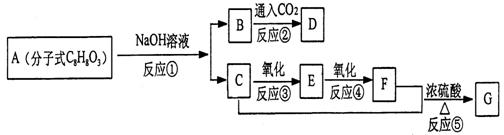
1)A的结构简式________________________
2)反应①—⑤中可看成取代反应的有_______________________
3)写出下列反应方程式
B→D:
C+F→H:
六.本题包括 2 小题共22 分
25.(6分)六价铬对人体有害,含铬废水要经化学处理后才能排放,方法是用绿矾
(FeSO4·7H2O)把废水中的六价铬还原为三价铬离子,再加入过量石灰水,使铬离子转变 为
Cr(OH)3沉淀。其主要反应化学方程式为:
H2Cr2O7+6FeSO4+6H2SO4=3Fe2(SO4)3+Cr2(SO4)3+7H2O,现用上述处理1×104L含
铬(+6价)78mg/L的废水,试回答:
(1)处理后,沉淀中除Cr(OH)3外还有_______(用化学式表示)
(2)需用绿矾多少克?
26. (16分)Na2CO3与稀盐酸反应在逐滴加入时可分两步进行:
Na2CO3+HCl=NaHCO3+NaCl NaHCO3+HCl=NaCl+H2O+CO2↑
已知在100mLNaOH与Na2CO3的混合液中Na+浓度为4.4mol·L-1,加入120mL 2.0mol·L-1
的稀盐酸,测得溶液中CO32-和HCO3-的物质的量之比为2:1,计算:
(1)原混合液中NaOH和Na2CO3的物质的量浓度。
(2)若用甲基橙作指示剂,在滴定时尚需再加多少毫升盐酸,才能使甲基橙变色?
(3)若反应完全时,溶液中H2CO3的浓度为0.04mol·L-1且溶液体积假定不变,可得CO2
气体多少升?(标况)(精确到0.1L,设溶液可近似加和)
珠海一中 深圳宝安中学 深圳实验学校三校联考
高三化学答案
第一卷 (选择题共72分)
一、选择题:本题包括8小题,每小题4分
1B 2B 3B 4C 5D 6B 7C 8D
二、选择题:本题包括10小题,每小题4分
9CD 10C 11BC 12D 13A 14C 15C 16D 17D 18D
第二卷 (非选择题共78分)
三、本题包括 2小题共 14分
![]()
![]()
![]() 19. (6分)(1)H2O2 H++HO2–
19. (6分)(1)H2O2 H++HO2–
|
![]() 2H2O2 2H2O+O2
2H2O2 2H2O+O2
20.(8分)(1)加热冷却,称量 (2)D
(3)两次称量误差超过0.1g (4)坩埚钳和干燥器
四、本题包括 2小题共 24分
21(8分)正极为C,负极为Fe,电解质溶液为![]() 溶液。
溶液。
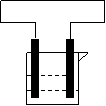 |
正极(C ):Fe3++e-==Fe2+
负极 ( Fe):Fe2+ -2e-==Fe
22、(16分)(1)1NaOH溶液; 3稀硫酸;4浓硫酸;5碱石灰
(2)将反应器中的CO2全部吹出。
(3)偏大。
(4)速度太快,碱石灰不能完全吸收CO2,使测定结果偏小。
(5)干燥CO2;防止空气中CO2、H2O进入D管。
(6)![]()
五、本题包括 2 小题共18 分
23.(共10分)1)A: NaHSO3 B: NaHSO4
2) 4OH—–4e === 2H2O + O2 ↑
3)SO42- + 2H+ + Ba2+ + 2 OH— == BaSO4↓ +2 H2O
4)HSO3 + H+ == SO2↑ + H2O
24.(共8分)
![]() 1)
1) ![]()
2) ① ⑤
3)
![]()
![]()
![]()
六、本题包括 2 小题共22 分
25(1)Fe(OH)3、CaSO4 (2分 )
解:( 2 )由H2Cr2O7+6FeSO4+6H2SO4=3Fe2(SO4)3+Cr2(SO4)3+7H2O可知:
2Cr ﹏ H2Cr2O7 ﹏ 6FeSO4.7H2O
|
m(FeSO4.7H2O)=
= 12.5kg (4分 )
答(略)
26、解:设原混合液中NaOH和Na2CO3的物质的量分别为x和y则:
NaOH + HCl == NaCl + H2O
X x
Na2CO3 + HCl == NaHCO3 + NaCl
y/3 y/3 y/3
|
|
x+y/3=2.0 mol·L-1×0.12L y=0.12mol (2分 )
|
|
(1)CNaOH= =2.0mol·L-1 CNa2CO3= =1.2mol·L-1
(4分 )
(2)4.4 mol·L-1×0.1L=2 mol·L-1V(盐酸)+0.120L×2 mol·L-1
V(盐酸)= 100mL (4分 )
(3) V(CO2)=(0.12mol-0.04 mol·L-1×0.32L)×22.4L/mol
=2.4L (4分 )
答(略)