高三化学上册第四次月考试卷
时量:90min 满分:110分
可能用到的相对原子质量:I~127,Mg~24,Si~28,O~16,Na~23,Ca~40,K~39
一、选择题(本题包括16个小题,每小题3分,共48分。每小题只有一个选项符合题意)
1.2007年3月22日是第十五届“世界水日”。我国纪念“世界水日”和开展“中国水周”活动的宣传主题为“水利发展与和谐社会”。下列有关活动不符合这一主题的是
A.大力提倡全民节约用水,加强城市生活污水处理,坚持达标排放
B.大力推广使用纯净水代替自来水作生活用水,以保障用水安全
C.加快产业结构调整,建立水资源节约型、环保型的国民经济体系
D.加强工业用水净化系统工程的改造,提高水的重复利用率
2.对于氨盐,下列叙述不正确的是 ( )
A.均易溶于水 B.均可与苛性碱反应
C.均为含离子键的共价化合物 D.受热分解有的发生氧化还原反应
3.2002年由德、法、美及波兰等多国科学家组成的科研小组合成了非常罕见的![]() Fe原子,有关
Fe原子,有关![]() Fe的说法正确的是
Fe的说法正确的是
A.它是一种新元素
B.![]() Fe与
Fe与![]() Fe互为同素异形体
Fe互为同素异形体
C.它是一种新原子
D.这种铁原子发生衰变放出两个质子后变成![]() Fe
Fe
4.据统计,世界上的古建筑在20世纪所遭受的腐蚀比过去几百年甚至几千年所遭受的腐蚀还要严重,其中最可能的原因是
A.管理部门维修不及时,引起古建筑的腐蚀
B.化石燃料大量使用,形成酸雨,加速了古建筑的腐蚀
C.参观的人数急剧增多,加速了古建筑的磨损
D.温室效应加剧,加速了古建筑的风化
5. 下列反应中,通入的气体既作氧化剂又作还原剂的是 ( )
A.SO2通入氨水中 B.CO2通入过氧化钠中
C.SO2通入双氧水中 D.Cl2通入石灰水中
6.阿伏加德罗常数约为6.02×1023 mol-1。下列叙述中正确的是( )
A.1mol氖气含有的原子数为2NA
B.1 mol金刚石中含有C-C键的数目约为6.02×1023
C.7.8 g Na2O2中含有的阴离子数目约为6.02×1022
D.标准状况下,1 L甲醇完全燃烧后生成的CO2分子个数约为(1/22.4)×6.02×1022
7.一定条件下, A(g)+3B(g)![]() 2C(g)达到平衡的标志是( )
2C(g)达到平衡的标志是( )
A.A的生成速率为B的消耗速率的3倍 B.单位时间内生成nmolA同时生成3nmolB
C.C的生成速率为A的消耗速率的2倍 D.单位时间内生成1molA同时生成2molC
8.对于某些离子的检验及结论一定正确的是( )
A.加入稀盐酸,产生无色并能使澄清石灰水变浑浊的气体,一定有CO32-或SO32-
B.加入BaCl2溶液有白色沉淀产生,再加盐酸,沉淀不消失,一定有SO42-
C.某气体能使湿润红色石蕊试纸变蓝,该气体一定显碱性
D.加入碳酸钠溶液产生白色沉淀,再加盐酸白色沉淀消失,一定有Ba2+
9.下列化学反应能说明碳与硅的非金属性强弱的事实是( )
①CO2+H2O+Na2SiO3=Na2CO3+H2SiO3; ②CaCO3+SiO2(高温)=CaSiO3+CO2;
③SiO2+2C(高温)=Si+2CO; ④Si+C(高温)=SiC。
A.①③ B.①②
C.①④ D.②③④
10.已建立化学平衡的可逆反应,改变条件使化学平衡向正反应方向移动,下列叙述中正确的是( )
A.生成物的产量一定增大 B.生成物的百分含量一定增大
C.反应物的浓度一定降低 D.反应物的转化率一定增大
 11.某学生积极思考产生喷泉的其他办法,并设计了如图所示装置,在锥形瓶中分别加入足量的下列物质,反应后可产生喷泉的是
11.某学生积极思考产生喷泉的其他办法,并设计了如图所示装置,在锥形瓶中分别加入足量的下列物质,反应后可产生喷泉的是
A.锌片与稀硫酸
B.NH4Cl溶液与Ba(OH)2溶液
C.CaCO3与稀硫酸
D.铁片与浓硝酸
12.同温同压下,将NO2、NO、O2按一定的体积比充满一容器,再倒置于盛有水的水槽中,片刻液体充满了容器。则反应前NO2、NO、O2的体积比是
A.1︰1︰1 B.4︰3︰1
C.4︰24︰17 D.4︰16︰7
13.下列反应适用于实验室制备重氨(ND3)的是
A.重氢(D2)与氮气合成法
B.重水(D2O)和氮化镁反应
C.NH4Cl和消石灰Ca(OD)2共热
D.通氨气于重水进行氢交换
14.将等物质的量的X、Y气体充人一个密闭容器中,在一定条件下发生如下反应并达成平衡:X(g)+Y(g) ![]() 2Z(g);△H<0。当改变某个条件并维持新条件直至达到新平衡,下表中关于新平衡与原平衡比较,正确的是
( )
2Z(g);△H<0。当改变某个条件并维持新条件直至达到新平衡,下表中关于新平衡与原平衡比较,正确的是
( )
| 改变的条件 | 新平衡与原平衡比较 | |
| A | 升高温度 | X的体积分数变大 |
| B | 增大压强 | Z的浓度不变 |
| C | 充入一定量Y | Y的转化率增大 |
| D | 充入一定量Z | X的体积分数变大 |
15. 体积相等的甲、乙两个容器中分别都充满有等物质的量的NH3和O2,并在相同的条件下发生反应:4 NH3(g)+5O2(g) ![]() 4NO(g)+6H2O(g)
达到平衡。在这个过程中,甲容器保持体积不变,乙容器保持压强不变。若甲容器中NH3的转化率为a%,则乙容器中的NH3的转化率( )
4NO(g)+6H2O(g)
达到平衡。在这个过程中,甲容器保持体积不变,乙容器保持压强不变。若甲容器中NH3的转化率为a%,则乙容器中的NH3的转化率( )
A.等于a% B.大于a%
C.小于a% D.无法判断
16.某密闭密闭容器中进行如下反应:X(g)+2Y(g) ![]() 2Z(g),若要使平衡时反应物总物质的量与生成物的物质的量相等,且用X、Y作反应物,则X、Y的初始物质的量之比的范围应满足:
2Z(g),若要使平衡时反应物总物质的量与生成物的物质的量相等,且用X、Y作反应物,则X、Y的初始物质的量之比的范围应满足:
A.1<X/Y<3; B.1/4<X/Y<2/3
C.3< X/Y <4; D.1/4< X/Y <3/2
答卷

![]() 一、选择题(本题包括16个小题,每小题3分,共48分。每小题只有一个选项符合题意)
一、选择题(本题包括16个小题,每小题3分,共48分。每小题只有一个选项符合题意)
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 |
二、非选择题(共62分)
17.(10分)⑴ NaNO2大量用于染料工业和有机合成工业中,然而由于NaNO2有毒性,将含该物质的废水直接排放会引起水体严重污染,所以这种废水必须处理后才能排放。处理方法之一如下:
___NaNO2+___KI+___ ______—___NO+___I2+___K2SO4+___Na2SO4+___ ______
①请完成该化学方程式并配平。
②在上述反应中,若要生成25.4克I2,则电子转移了 个。
③ 上述反应中,氧化产物是________。
A.NO B.I2 C.K2SO4 D.Na2SO4
⑵某一反应体系有反应物和生成物共五种物质: O2、H2CrO4、Cr(OH)3、H2O、H2O2;已知该反应中H2O2只发生如下过程:H2O2→ O2 。则H2O是 (填“反应物”或“生成物”),理由是 。
18.(9分)已知A、B、C、D、E为中学常见的五种物质,均含元素Y,有的还可能含有元素X、Z,元素X、Y、Z的原子序数依次递增。①元素Y在A、B、C、D、E中所呈化合价依次递增,其中只有B为单质。②常温下将气体D通入水中发生反应,生成C和E;③工业上以A、空气和水为原料,通过催化氧化法制取E。请回答以下问题:
⑴B分子中含有化学键为 (写名称);
A的分子式为 ;
A分子的空间构型是 。
⑵写出②中涉及反应的化学方程式 。
⑶)由B反应生成1molA放出的热量为46.2kJ,写出该反应的热化学方程式
。
⑷工业上,若输送Cl2的管道漏气,用A进行检验时可观察到大量白烟,同时有B生成,写出有关反应的化学方程式 。
19.(10分)⑴在容积为2L的密闭容器中,加入0.5mol N2和1.5molH2,在一定条件下发生反应合成氨,若测得5s时容器中生成了0.04mol NH3,20s后反应达平衡,平衡时NH3的体积分数为20%。则:
前5s用N2浓度的改变表示的平均反应速率为 ;平衡时H2的体积分数为 ;平衡时,N2、H2的转化率之比为 。
⑵一定条件下,将合成氨反应放在一带活塞的密闭容器中进行,达平衡后,四次改变条件(达到四个新的平衡状态Ⅰ、Ⅱ、Ⅲ、Ⅳ,每次均只改变一个条件),对正逆反应的速率的影响如下图。则改变的四个条件依次为:
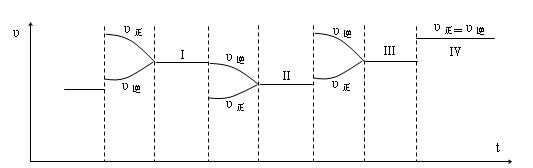
Ⅰ、 Ⅱ、 Ⅲ、 Ⅳ、
20.(8分)下列A ~ I九种物质之间的转化关系如图所示;其中部分生成物或反应条件已略去。已知A为固态单质,常温下C、E、F都是无色气体。
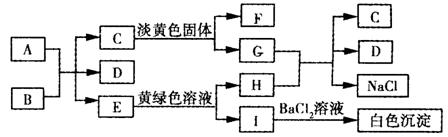
请填空:
⑴C的固体属于 晶体,F的化学式(分子式)是 。
⑵A与B反应的化学方程式是 。
⑶G与H反应的离子方程式是 ;
E转变为H和I的离子方程式是 。
21.(16分)当前,一次性筷子、一次性饭盒的安全已受到社会的关注。专家介绍说,正规的一次性筷子所用的原料都是质地较好的木材,不用特殊加工。但是很多小作坊为了降低成本,使用劣质木材,为使筷子看上去白一些,他们常用硫磺进行熏蒸漂白,结果造成二氧化硫严重超标,同时硫磺中含铅、汞等重金属,也会对人体造成铅中毒或汞中毒。
⑴铅的元素符号是 ,它在周期表中的位置是 。
⑵防止或减小毒筷“中毒”最简单的方法是用凉水清洗筷子表面,减少二氧化硫的含量。
①为研究SO2的溶解性质,某学生做如下实验:如下图,
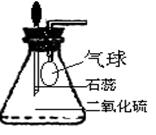 |
锥形瓶中收集的是SO2,瓶塞系着瘪气球,气球与大气相通。向瓶中滴加紫色石蕊试液,实验现象: 。
②为比较SO2 和CO2溶解性的大小,某学生采取同样的装置和操作,
能说明SO2在水中的溶解度大于CO2在水中溶解度的实验现象是:
。
 ③某学生用试管取出上述①实验后的瓶中溶液适量,滴入少量品红溶液,充分振荡,实验现象为: ,接着向溶液加入足量氯水,实验现象为:
,再滴加BaCl2溶液,实验现象为:
。
③某学生用试管取出上述①实验后的瓶中溶液适量,滴入少量品红溶液,充分振荡,实验现象为: ,接着向溶液加入足量氯水,实验现象为:
,再滴加BaCl2溶液,实验现象为:
。
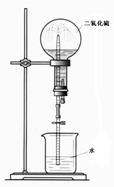
④有人利用SO2易溶于水的性质设计成如图所示的装置进行喷泉实验,但实验
效果并不理想,请对该设计进行适当改进,以利于完成效果明显的喷泉实验。
A、可将水改为 溶液;
B、也可对装置进行改进(请提出两种改进方案)
方案一:
方案二:
⑶制一次性筷子有“抛光”程序:加入滑石粉和木签一起搅拌,起到干燥打磨,使筷子变得光滑,以免毛疵划人的口腔。已知滑石粉是一种含水的具有层状结构的硅酸盐矿物。其质量组成为MgO 31.88%,SiO2 63.37%,H2O 4.75%,其化学式为: 。
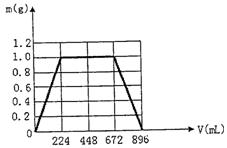
22.(9分)将KOH和Ca(OH)2混合物1.86g全部溶于一定量水中形成稀溶液,再缓缓通入足量的CO2气体。当生成沉淀的质量刚好最大时,消耗CO2的体积为224mL(标准状况,忽略CO2溶于水情况,以下情况相同。)
(1)原混合物中Ca(OH)2的质量为 g;
(2)沉淀恰好溶解时,消耗CO2的体积为 mL;
(3)写出溶液中生成沉淀的质量m(g)与通入CO2的体积V(mL)之间的函数表达式;
(4)在图示座标系上,画出生成沉淀的质量m(g)与通入CO2的体积V(mL)的关系曲线。
|
参考答案
17.(1) ①2, 2, 2, H2SO4-2, 1, 1, 1, 2, H2O (2分)
②1.204×1023(或0.2NA) (2分)
③B(2分)
⑵生成物(2分);由H2O2→O2氧原子数不变,由H2CrO4→Cr(OH)3氧原子数减少,由氧原子守恒可知,H2O应为生成物。(2分)
18.(1)非极性共价键(1分) NH3 (1分) 三角锥形(1分)
(2)3NO2 + H2O == 2HNO3 + NO(2分)
(3)N2 (g) +3H2 (g) ==2NH3 (g);△H = -92.4KJ•mol-1 (2分)
(4)8NH3 + 3Cl2 == 6NH4Cl + N2(2分)
19.(1)0.002mol·L—1·s—1(2分);60%(2分);1︰1(2分)
(2)加压(1分) 减小反应物浓度(1分) 升温(1分) 加催化剂(1分)
20.(1)分子(1分)
O2(1分)
(2)C+H2SO4(浓)![]() 2SO2↑+CO2↑+2H2O(2分)
2SO2↑+CO2↑+2H2O(2分)
(3)CO32-+2H+=CO2↑+H2O(2分)
SO2+Cl2+2H2O=4H++SO42-+2Cl-(2分)
21、(16分)
(1)Pb(1分) 第六周期第ⅣA族(1分)
(2)①紫色石蕊试液变红(1分)、气球鼓胀起来(1分)。
② SO2溶解时气球鼓胀的程度大于CO2溶解时气球的鼓胀程度(1分)。
③品红溶液的红色褪去(1分),溶液显浅紫色(1分)。先变红后褪色(1分)。生成白色沉淀(1分)。
④A、NaOH等强碱 (1分)
B、方案一:增大胶头滴管的容量(2分)
方案二:适当缩短烧杯与烧瓶间距离(即缩短导管的长度)(2分)
方案三:减小导管的直径等
(2)Mg3(Si4O10)(OH)2或3Mg O·4SiO2·H2O(2分)
22.(9分,第(3)小题3分,其余每小题2分)
(1) 0.74g
(2) 896mL
(3)①0≤V<224 m=V/224
②224≤V≤672 m=1
③672≤V≤896 m=1-(V-672)/224
(4)