高三化学上册第四次月考试卷
老师寄语:态度决定一切,细节决定成败。
一、选择题(本题包括16小题,每小题3分,共48分。每小题只有一个选项符合题意)
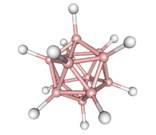 1.中子俘获治疗癌症(缩写为NCT)是一种新的化疗方法,化疗时用到的药物BSH,合成时必须经过中间体Na2B12H12,它可由B2H6 和NaBH4以二甘二甲醚为溶剂,在180℃时合成的。已知B12H122-结构如右图。
1.中子俘获治疗癌症(缩写为NCT)是一种新的化疗方法,化疗时用到的药物BSH,合成时必须经过中间体Na2B12H12,它可由B2H6 和NaBH4以二甘二甲醚为溶剂,在180℃时合成的。已知B12H122-结构如右图。
有关B12H122-的说法不正确的是
A.该粒子中硼原子构成20个正三角形
B.一个B12H122-中含有30个硼硼键
![]() C.Na2B12H12属共价化合物
C.Na2B12H12属共价化合物
D.合成Na2B12H12反应可表示为:5B2H6+2NaBH4 Na2B12H12+13H2
2.最新研究表明生命起源于火山爆发,是因为火山爆发产生的气体中含有1%的羰基硫(COS),已知羰基硫分子中所有原子均满足最外层8电子稳定结构,结合周期表知识,有关说法正确的是txjy
A.羰基硫的电子式为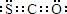
B.羰基硫属于非极性分子
C.羰基硫沸点比CO2低
D.羰基硫分子中三个原子不可能处于同一直线
2005年10月12日我国成功发射了第二艘载人航天飞船—— “神州六号”,实现了双人多天太空旅行。这标志着中国人的太空时代又前进了一大步。txjy
3.火箭升空时,由于与大气层的剧烈摩擦,产生高温。为了防止火箭温度过高,在火箭表面涂上一种特殊的涂料,关于该涂料的性质描述中最有可能的是txjy
A.在高温下不熔化 B.在高温下可分解气化
C.在常温下就分解气化 D.该涂料不可能分解
4.发射“神六”时用肼(N2H4)作为火箭发动机的燃料,NO2为氧化剂,反应生成N2和水蒸气。已知:N2(g) + 2O2(g) = 2NO2(g); △H = + 67.7kJ/mol
N2H4(g) + O2(g) = N2(g) + 2H2O(g); △H = – 534kJ/mol
下列关于肼和NO2反应的热化学方程式中,正确的是txjy
A.2N2H4(g) + 2NO2(g) = 3N2(g) + 4H2O(l);△H = – 1135.7kJ/mol
B.2N2H4(g) + 2NO2(g) = 3N2(g) + 4H2O(g);△H = – 1000.3kJ/mol
C.N2H4(g) + NO2(g) = 3/2N2(g) + 2H2O(l);△H = – 1135.7kJ/mol
D.2N2H4(g) + 2NO2(g) = 3N2(g) + 4H2O(g);△H = – 1135.7kJ/mol
5.据世界卫生组织统计,全球约有8000万妇女使用避孕环,常用避孕环都是含金属铜的。据认为,金属铜的避孕机理之一是:铜与子宫分泌物中的盐酸以及子宫内的空气反应:Cu+HCl+O2=CuCl+HO2,HO2(超氧酸)不仅是一种弱酸而且也是一种自由基,具有极高的活性,能杀死精子。下列说法或表示正确的是
A.氧化产物是HO2 B.HO2在碱中能稳定存在
C.氧化剂是O2 D.1 mol Cu参加反应有2 mol电子发生转移
6.下列对实验仪器名称的标注或实验操作,正确的是
7.比较合成氨工业与接触法制硫酸中SO2催化氧化的生产过程,下列说法错误的是
A.都使用了合适的催化剂
B.都选择了较高的温度
C.并非全都采用了高压的生产条件
D.都采用了使其中一种原料过量以提高另一种原料利用率的方法
8.在FeCl3、CuCl2、FeCl2的混合溶液中,Fe3+、Cu2+、Fe2+的物质的量浓度之比为:4∶2∶1,现加入适量的铁粉,使溶液中的三种离子的物质的量浓度之比为:1∶3∶9,则投入的铁粉与原溶液中Cu2+的物质的量之比为
A.5∶4 B.4∶5 C.3∶5 D.5∶6
9.下列离子方程式正确的是
A.氢氧化铁溶于氢碘酸中:Fe(OH)3 + 3H+ = Fe3+ + 3H2O
B.明矾溶液中加入氢氧化钡溶液,使其产生沉淀的物质的量达最大值:
Al3+ + 2SO42- + 2Ba2+ + 4OH- = 2BaSO4↓+ AlO2- + 2H2O
C.Mg(HCO3)2溶液中加入过量石灰水:
Mg2+ + 2HCO3- + Ca2+ + 2OH- = CaCO 3↓ + 2H2O + MgCO3↓
D.向100 mL 0.1 mol/L的FeBr2溶液中通入0.012 mol Cl2:
10Fe2+ + 14Br- + 12Cl2 = 10Fe3+ + 7Br2 + 24Cl-
10.用NA表示阿伏加德罗常数的值,下列说法中正确的是
A.4 g重水(D2O)中所含质子数为0.2 NA
B.4.48 L N2与CO的混合物所含分子数为0.2 NA
C.6.2 g白磷与红磷的混合物中所含磷原子数为0.2 NA
D.12.5 mL 16 mol·L-1浓硫酸与足量铜反应,转移电子数为0.2 NA
11.2005年9月始,“禽流感”在全球部分地区爆发,引起了人们继“非典型性肺炎”之后的世界范围内的恐慌。做好环境消毒是预防“禽流感”的重要措施,常用的消毒剂是ClO2或Cl2等的稀溶液,其中ClO2溶液的消毒效果较好。已知ClO2常温下呈气态,其分子构型与水分子的分子构型相似,在自然环境中ClO2最终变为Cl-。下列有关说法中正确的是
A.ClO2的分子结构呈V型,属非极性分子
B.ClO2中氯元素显+4价,具有很强的氧化性,其消毒效率(以单位体积得电子的数目表示)是Cl2的5倍
C.ClO2、Cl2的稀溶液用于环境消毒,具有广谱高效的特点,对人畜无任何危害
D.常用Na2SO3在H2SO4的酸性条件下,还原NaClO3来制ClO2,这一反应的化学方程式可表示为Na2SO3 + 2NaClO3 + H2SO4 = 2Na2SO4 + 2ClO2↑+ H2O
12. A、B、C、D均是短周期元素,当A、B两元素的原子分别得到两个电子形成稳定结构时A放出的能量大于B放出的能量;当C、D两元素的原子分别失去一个电子形成稳定结构时,D吸收的能量大于C吸收的能量。若A、B、C、D四种元素间分别形成化合物时属于离子化合物可能性最大的是( )
A.C2A B.C2B C.D2A D.D2B
13. 5 mL Ag+浓度为0.1 mol·L-1的某溶液,加入等物质的量的某种碱金属盐,待卤化物完全沉淀后,经过滤、干燥,称得质量为0.013 g,则此沉淀是
A.LiF B.LiCl C.AgF D.AgCl
14.某无色溶液中滴入酚酞试液显红色,该溶液中可以大量共存的离子组是
A.Mg2+、Al3+、HCO3-、SO32- B.K+、Ca2+、MnO4-、Cl-
C.Ba2+、Na+、AlO2-、NO3- D.NH4+、Fe3+、SO42-、SCN-
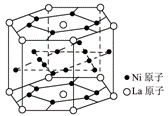 15..氢气是重要而洁净的能源,要利用氢气作能源,必须安全有效地储存氢气。有报道称某种合金材料有较大的储氢容量,其晶体结构的最小单元如右图所示。则这种合金的化学式为
15..氢气是重要而洁净的能源,要利用氢气作能源,必须安全有效地储存氢气。有报道称某种合金材料有较大的储氢容量,其晶体结构的最小单元如右图所示。则这种合金的化学式为
A.LaNi6 B.LaNi3
C.LaNi4 D.LaNi5
16.温度为T℃,压强为1.01×106Pa条件下,某密闭容器下列反应达到化学平衡A(g)+ B(g)![]() 3C(?),测得此时c(A)=0.022 mol·L-1;压缩容器使压强增大到2.02×106Pa,第二次达到平衡时,测得c(A)=0.05 mol·L-1;若继续压缩容器,使压强增大到4.04×107Pa,第三次达到平衡时,测得c(A)=0.75 mol·L-1;则下列关于C物质状态的推测正确的是( )
3C(?),测得此时c(A)=0.022 mol·L-1;压缩容器使压强增大到2.02×106Pa,第二次达到平衡时,测得c(A)=0.05 mol·L-1;若继续压缩容器,使压强增大到4.04×107Pa,第三次达到平衡时,测得c(A)=0.75 mol·L-1;则下列关于C物质状态的推测正确的是( )
A.C为非气态 B.C为气态
C.第二次达到平衡时C为气态 D.第三次达到平衡时C为非气态
二、(本题包括5小题,共46分)
17(2分)(Ⅰ)下列实验操作或对实验事实的叙述正确的是___ ________(填序号)。①用碱式滴定管量取20.00 mL 0.10mol/L KMnO4溶液;②用托盘天平称取10.50 g干燥的NaCl固体;③各放一张质量相同的滤纸于天平的两托盘上,将NaOH固体放在左盘纸上称量;④将未经湿润的pH试纸浸到某溶液中,过一会取出与标准比色卡比较,测得该溶液的pH;⑤焰色反应操作是:将铂丝放在稀盐酸中洗涤,然后蘸取待检物置于酒精灯或煤气灯的火焰上灼烧,观察火焰的颜色;⑥中和滴定中,锥形瓶用蒸馏水洗净后可直接往其中注入一定量的待测溶液;⑦用瓷坩埚高温熔融Fe(CrO2)2和Na2CO3的固体混合物;⑧配制Al2(SO4)3溶液时,加入少量的稀硫酸。
18.(12分)在省实验调演活动中,某校几个研究性学习小组的师生对金属镁在空气中燃烧的产物进行探究。
①第一小组同学根据所学知识认为镁在空气中燃烧的产物就是氧化镁。请你用化学方程式表示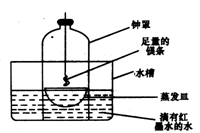 第一小组同学的观点:
;
第一小组同学的观点:
;
②第二小组同学认为,空气中存在大量的氮气,镁也可能和氮气反应。他们设计了如下装置进行实验:
镁条燃烧完后取出蒸发皿观察,发现蒸发皿中除有白色固体外还有少量的淡黄色固体。能支持第二小组同学的观点的实验现象除生成淡黄色固体外还有 ,理由是 ;
③第三小组同学对实验中生成的淡黄色固体产生了兴趣,他们向蒸发皿中的固体滴加少量水,现有刺激性气味的气体产生,淡黄色固体转变成白色。请写出上述过程中发生的化学反应方程 式: ,生成淡黄色固体的化学方程式是 ;
④第四小组同学在探究上述实验的基础上又通过查阅资料得知,Al4C3能象淡黄色固体一样,遇水也能剧烈反应。请你写出Al4C3和水反应的化学方程式 。



![]()
![]()
![]()
|
|
|
化学试题答卷
老师寄语:工整、规范、整洁的答卷非常重要,希望同学们养成良好的答题习惯!
17.
18. ① ;
② ;
③ , ;
④ 。
19.(10分)以下是周期表中短周期元素的有关数据x,x表示元素原子获得电子的能力。
| 0.98 | 1.57 | 2.04 | a 2.55 | b | c 3.44 | d 3.98 | ||||||||
| e 0.93 | 1.48 | f 1.61 | 1.90 | 2.19 | g 2.58 | h 3.16 |
(1)x越大,表示该元素原子越 (填“难”或“易”)形成阴离子。
(2)一般来讲,两元素的x值差(△x)大于1.7时,形成离子键;小于1.7时,形成共价键,则f、c组成的化合物属 化合物。
(3)能否用电解f、h化合物的水溶液制取f, (填“能”或“否”),用电解化学方程式表示为 。
(4)a~h中两种元素组成的化合物或单质,在某隔热的密闭容器中反应示意图如下。
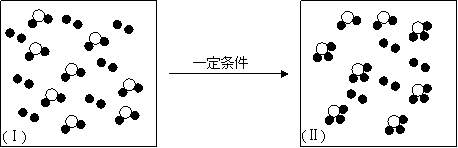 |
I表示反应前的分子状况,Ⅱ表示容器温度不再升高的分子状态,●和○分别表示不同的原子。
该反应的化学方程式为(不必注明反应条件) 。
20. (10分)1919年,Langmuir提出,原子数相同、电子数相同的分子,互称为等电子体。等电子体的结构相似、物理性质相近,称为等电子原理。后来,该原理被推广应用于一些具有特殊功能的晶体的发展和人工合成等诸多领域。如:X是一种新型无机材料,它与碳化硅(SiC)结构相似、物理性质相近,符合等电子原理。X有如下的转化关系:
其中,C是一种能使湿润的红色石蕊试纸变蓝的无色气体,D为白色沉淀,E溶液的焰色反应中火焰呈黄色。回答下列问题:
|
|
 | ||||||||
|
| |||||||
| ||||||||
|
![]()
![]()
![]()
![]()
|
|
|
|
|
|
|
|
 |  | ||||
(1)写出X的化学式:_______,X属于_____晶体(填“分子”或“原子”或“离子”)。
(2)写出X与A溶液反应的离子方程式:______;写出K与J反应的化学方程式:____。
![]()
|
21.(12分)SO42-和 S2O82-(过二硫酸根离子)结构中,硫原子均位于由氧原子组成的四面体的中心,且所有原子的最外层电子均满足8电子结构。已知S2O82-中两个硫原子间存在过氧键,S2O82-有强氧化性,它能分步水解产生过氧化氢。
(1)画出SO42-的立体结构图,分别用实心圆点“●”和空心圆点“○”描出氧原子和硫原子的位置。
(2)写出过二硫酸的结构简式,确定氧、硫元素的化合价。
(3)请描述S2O82-有强氧化性的原因。
(4)写出H2S2O8在D218O中水解的两步反应方程式。
三.计算(14分)
22.(8分)一定温度下,碳与水蒸气在容积不变的密闭容器中发生反应并建立化学平衡:
C(s)+H2O(g)![]() CO(g)+H2(g);△H>0
CO(g)+H2(g);△H>0
⑴平衡混合气体的平均相对分子质量M1的取值范围为 <M1<
⑵将平衡混合气体升高温度,混合气体平均相对分子质量 (填“增大、减小或不变”,下同),密度将 ;
⑶若使用等物质的量CO和H2从逆反应方向在相同条件下建立平衡,则混合气体的平均相对分子质量M2的取值范围 <M2< ;若使用不同物质的量的CO和H2从逆反应方向在相同条件下建立平衡,则平衡混合气体的平均相对分子质量M3的取值范围 <M3<
⑷若起始投料:1molC(s)和1molH2O(g)。在相同条件下反应达到平衡,混合气体平均相对分子质量为M,下列哪组投料在相同条件下建立平衡后混合气体的平均相对分子质量不可能为M的是 。
A、C(s): 2mol,H2O(g):1mol
B、CO(g):1mol,H2(g):1mol
C、C(s):0.5mol,H2O(g):0.4mol,CO(g):0.6mol,H2(g):0.6mol
D、C(s):0.9mol,H2O(g):0.9mol,CO(g):0.1mol
⑸若在一定温度下,在一个容积可变的密闭容器中同时投入C(s)、H2O(g)、CO(g)、H2(g) ,达到平衡时混合气体的平均相对分子质量M0。若给平衡体系加压,则混合气体的平均相对分子质量M的变化情况为(请填写条件和结论)
.
23. (6分)氯化钙是用途广泛的化学试剂,可作干燥剂、冷冻剂、防冻剂等。为了测定某氯化钙样品中钙的含量,进行如下实验:
①准确称取氯化钙样品0.2312g,放入烧杯中,加入适量6mol/L的盐酸和适量蒸馏水使样品完全溶解,再滴加35mL0.25mol/L (NH4)2C2O4溶液,水浴加热,逐渐生成CaC2O4沉淀。经检验,Ca2+已沉淀完全。
②过滤并洗涤沉淀。
③加入足量的10% H2SO4和适量的蒸馏水,沉淀完全溶解,溶液呈酸性,加热至75℃,趁热加入0.05mol/L KMnO4溶液16mL,恰好完全反应。
通过计算求该氯化钙样品中钙的质量分数(精确到0.01%)。
己知: 2KMnO4 + 5H2C2O4 + 3H2SO4==2MnSO4 + K2SO4 +10CO2↑ +8H2O
化 学 试 题 答案
1.解题思路:在B12中每个三角形真正含有占有的的B原子数为3/5,所以构成了20个正三角形;
每个B原子形成5/2根键,共30根键;Na2B12H12属离子化合物,C不正确。
参考答案:C
2.A 3B 4D 5C 6C 7.D 合成氨工业采用的是适当的高温、高压和催化剂,而SO2的催化氧化采用的是适当的高温、常压和催化剂,且通入过量的O2以提高SO2的转化率。经对比应选D。
8.D 9D 10.C 4g D2O中所含的质子数为4g/20g·mol-1×10=4mol;B中状态未定;随着反应的进行,Cu与稀H2SO4不反应;n(P)=6.2g/31g·mol-1=0.2mol。
11D
12.A(根据题意可判断A、B的最外层都有6个电子,再由A+2e-→A2-放出能量大,B+2e-→B2-放出能量小,可得出A原子的电子层数比B原子的电子层数少,A的原子半径比B的原子半径小。同样可得出,C原子电子层数比D原子的电子层数多,原子半径C比D原子大。所以,C跟A更容易形成化合物C2A)
13.A AgF溶于水,可以排除;0.0005molAgCl的质量为0.07175g;0.0005mol LiF的质量为0.013g;0.0005molLiCl的质量为0.02125g。若能从守恒角度考虑:Li来自于某碱金属的盐、Cl必来自于Ag+的溶液,而Ag+与Cl-不共存,可排除B。
14.C 由无色可排除B、D,MnO4-、Fe3+为有色离子;由“滴入酚酞显红色”可知溶液为碱性,HCO3-、SO32-与Al3+双水解,即使不能想到这一点,Al3+与OH-,HCO3-与OH-亦不能共存。15.D 16.C
17(2分)⑥⑧(2分,漏1个扣1分,错选不得分________
18.原创题,根据教材内容,镁在空气中燃烧与O2和CO2反应,其产物是氧化镁。那么对镁与空气中的氮气的反应,比较陌生。本题通过实验探究的形式出现,怎样才能确定氮气与镁发生了化学反应呢?第一根据生成固体的颜色与氧化镁的颜色不同,第二根据容器内水的液面的变化来确定。同时推测氮气与镁反应的产物和产物与水反应的化学方程式。本题注重考查学生根据实验现象和所学知识进行推理的能力,并学会举一反三,触类旁通。
①2Mg+O2![]() 2MgO,2Mg+CO2
2MgO,2Mg+CO2![]() 2MgO+C
2MgO+C
②钟罩中的水面上升大大超过钟罩容积的1/5空气中O2的体积分数约为1/5
CO2的体积分数很小,只有和N2反应钟罩中的水面上升才能大大超过钟罩容积的1/5
③Mg3N2+6H2O==3Mg(OH)2↓+2NH3↑
3Mg+N2![]() Mg3N2
Mg3N2
④Al4C3+12H2O==4Al(OH)3↓+3CH4↑
19.(1)易(2分)
(2)离子(2分)
(3)否(1分);2AlCl3
+ 6H2O![]() 2Al(OH)3↓+3H2↑+3Cl2↑ (3分)
2Al(OH)3↓+3H2↑+3Cl2↑ (3分)
(4)2SO2 + O2 ![]() 2SO3 (2分)
2SO3 (2分)
20.解析 :本题特征现象有:C是一种能使湿润的红色石蕊试纸变蓝的无色气体,D为白色沉淀,E的焰色呈黄色;反应条件“电解”、“加热”等。隐性信息有:SiC电子数为14+6=20。根据典型现象知,C是NH3,E中含Na+;由X+A的溶液→B+NH3知,X可能含N,结合新信息等电子体知,X含20个电子,另一种原子含有13个电子,即X为AlN。“电解”在中学化学反应中出现较少,电解时发生分解反应的更少,如电解氯化钠、氯化镁、氧化铝等熔融物。D可能是氢氧化铝,F为氧化铝。G与氨气反应,说明G为氧气,H为铝,则I为NO,J为H2O,K为NO2,L为HNO3。B与适量L反应生成氢氧化铝和E,且E中含钠离子,所以B为偏铝酸钠,A为氢氧化钠。因为SiC与AlN符合等电子体原理,性质相似,由于碳化硅属于原子晶体,氮化铝也属于原子晶体。AlN+NaOH→NaAlO2+NH3↑,根据钠、氧原子数比知,一定有除NaOH外的含氧物质参加反应,溶液中只能是水参与了反应。(3)中根据原子守恒推知新物质为Al4SiC4。
答案:(1)AlN 原子
(2)AlN+NaOH+H2O====NaAlO2+NH3↑ 3NO2+H2O====2HNO3+NO
(3)Al4SiC4
评注:本题推出C是关键。由“电解”锁定F范围。C连续与G的反应,联想NH3(N2)→NO→NO2。理解新信息“等电子体原理”是推出X和确定其晶体类型的瓶颈。
![]() 21.(12分)
21.(12分)
(1) (2分) 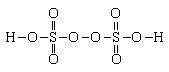
(2) (2分) 氧元素的化合价有-1、-2,硫元素的化合价为+6(2分)
(3)S2O82-中两个硫原子间存在过氧键,此过氧键中氧元素的化合价为-1价(2分)
(4)H2S2O8+D218O= HSO318OD+HSO5D(2分) HSO5D+D218O=HSO318OD+D2O2(2分)
三.计算(14分)
22(8分)⑴15<M1<18;⑵减小 ,增大 ⑶15<M2<18,2<M3<28(每线1分)
⑷D(1分)⑸若M0<12,则M0变小,若M0=12,则M0不变,若M0>12,则M0变大。
23.解: n(KMnO4)= 0.05mol/L×0.016L=0·0008mol
2KMnO4 ~ 5H2C2O4 ~ 5CaC2O4
2 5
0·0008m0l n(CaC2O4)
n(CaC2O4)=0.002mol
Ca元素的质量=0.002molX40g/mol=0.0800g
样品中Ca元素的质量分数为0.08g÷0.2312g×100%=34.60%