高三化学上册适应性测试试题卷
一、选择题(只有一个正确答案,每小题2分,共44分。)
1.在日常生活中,雪碧、可口可乐等饮品都是塑料容器盛装,而盛啤酒的容器却是玻璃制品,很少见到用塑料瓶盛装啤酒,这是由于塑料
A.造价太高同时形成白色垃圾而引起环境污染
B.太软,饮用和运输时都很不方便
C.相对玻璃透气性强,啤酒易被氧化而变质
D.属有机物,能与啤酒互溶而不与雪碧、可口可乐等饮品互溶
2.下列各组比较项目包含的数据关系中,前者比后者大的是
A.氨水与氯水中微粒种数 B.NH4+离子与 P4分子中的键角
C.C2H2与 C6H6分子中碳碳键键长 D.同温同压下同体积的氦气和氢气所含原子数
3.已知KMnO4与双氧水反应的化学方程式为:2KMnO4+5H2O2+3H2SO4=2MnSO4+5O2↑+K2SO4 +8H2O,则5molO2参加反应则转移电子
A.5mol B.20mol C.15mol D.10mol
4.某同学在做苯酚的性质实验时,将少量溴水滴入苯酚溶液中,结果没有发现沉淀现象,他思考了一下,又继续在反应中滴入足量的氢氧化钠溶液,此时他发现
A.溶液中仍无沉淀 B.溶液中产生白色沉淀 C.先产生沉淀后沉淀溶解 D.溶液呈橙色
5.下列每组物质发生状态变化所克服的粒子间的相互作用属于同类型的是( )
A.食盐和蔗糖熔化 B.钠和硫熔化 C.碘和干冰升华 D.二氧化硅和氧化钠熔化
![]() 6.高铁电池是一种新型可充电电池,与普通高能电池相比,该电池能长时间保持稳定的放电电压。高铁电池的总反应为:
6.高铁电池是一种新型可充电电池,与普通高能电池相比,该电池能长时间保持稳定的放电电压。高铁电池的总反应为:
下列叙述不正确的是:
A.放电时负极反应为:Zn—2e- +2OH-= Zn(OH)2;
B.充电时阳极反应为:Fe(OH)3 —3e- + 5OH- = FeO42- + 4H2O;
C.放电时每转移3 mol电子,正极有1mol K2FeO4被氧化;
D.放电时正极附近溶液的碱性增强。
7. 已知A、B、C、D、E是核电荷数依次增大的五种短周期元素,原子半径按D、E、B、C、A的顺序依次减小,B和E同主族,下列推断不正确的是
A.A、B、E一定在不同周期 B.D为第二周期
C.A、D可能在同一主族 D.C、D的单质可能化合为离子化合物
8.不能用胶体的知识解释的现象是( )
A、牛油与氢氧化钠溶液共煮,向反应后所得的液体中加入食盐,会有固体析出
B、一支钢笔使用两种不同牌号的蓝墨水,容易出现堵塞
C、向氯化铁溶液中加入NaOH溶液,会出现红褐色沉淀
D、在河水与海水的交界处,易形成三角洲
9.0.1mol/LKHSO4和0.1mol/LNa2S溶液等体积混合后,溶液能使pH试纸变蓝,则离子浓度关系正确的是
A.c(SO42-)>c(HS-)>c(OH-)>(H+) B.c(Na+)>c(K+)>c(H+)>c(OH-)
C.c(Na+)=2c(S2-)+c(H2S)+c(HS-)+2(SO42-)
D.c(Na+)+c(K+)+c(H+)=c(SO42-)+c(S2-)+c(HS-)+c(OH-)
10.设NA为阿佛加德罗常数,下列说法正确的是
A.1.8g重水(D2O)中含NA个中子
B.78克Na2O2与过量的CO2充分反应,转移电子数为NA
C.使22.4LHCl气体溶于水,溶液中H+数约为NA
D.1mol羟基与1molNH4+所含电子数均为10NA
11.某单质能和浓硝酸反应,若参加反应的单质与硝酸的物质的量之比为1:4,则组成该单质的元素在产物中的化合价可能是
A.+1 B.+2 C.+3 D.+5
12.下列叙述正确的是( )
A.直径介于1nm~100nm之间的微粒称为胶体 B.电泳现象可证明胶体属电解质溶液
C.利用丁达尔效应可以区别溶液与胶体 D.胶体粒子很小,可以透过半透膜
13、在一定温度下,向饱和的烧碱溶液中加入一定量的Na2O2,充分反应后恢复到原来温度,下列说法中正确的是
A.溶液的pH不变,有H2放出 B.溶液中Na+ 数目减小,有O2放出
C.溶液的pH增大,有O2放出 D.溶液中c(Na+ )增大,有O2放出
14.在20℃时,NaCl的溶解度是36克.在20℃时,把20克NaCI投人到50克水中充 分溶解后,下列有关说法中,不正确的是
 A.制成了70克饱和溶液 B.制成了68克饱和溶液
A.制成了70克饱和溶液 B.制成了68克饱和溶液
C.有18克NaCl发生溶解 D.还剩余2克固体NaCl(未溶解)
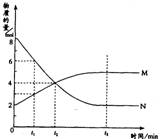
15.在一定温度下,容器内某一反应中M、N的物质的量随反应时间变化的曲线如图,下列表述中正确的是
A.反应的化学方程式为:2M![]() N
N
B.t1时,N的浓度是M浓度的2倍
C.t2时,正逆反应速率相等,达到平衡
 D.t3时,正反应速率大于逆反应速率
D.t3时,正反应速率大于逆反应速率
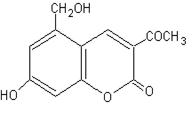
16.(齐二药假药事件),主角是亮菌甲素,化学名称:3-乙酰基-5-羟甲基-7-羟基香豆素,其结构式为右图,下列说法错误的是
A.其分子式为:C12H10O5
B.1mol亮菌甲素最多可与3molNaOH反应
C.1mol亮菌甲素最多可与6molH2发生加成反应
D.既能发生水解反应,又能发生酯化反应
17.2006年,甘肃多地发生铅中毒事件。据了解,儿童铅中毒可伴有腹痛、便秘、贫血、多动、易冲动等,尤其表现在儿童记忆力下降,注意力不集中,思维判断能力差。有列有关铅说法正确的是
A.固态铅是原子晶体 B.铅的化合价有+2、+4
C.PbO2比PbO稳定 D.铅是人体所需元素之一,无毒
18.锌锰干电池在放电时,电池总反应方程式可以表示为:
Zn+2MnO2+2NH4+ Zn2++Mn2O3+2 NH3+H2O
在此电池放电时,正极(碳棒)上发生反应的物质是
 A.Zn B.碳棒
C.MnO2和NH4+ D.Zn2+和NH4+
A.Zn B.碳棒
C.MnO2和NH4+ D.Zn2+和NH4+
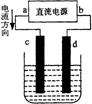
19.右图是电解CuCl2溶液的装置,其中c、d为石墨电极。则下列有关的判断正确的是
A.a为负极、b为正极 B.a为阳极、b为阴极
C.电解过程中,d电极质量增加 D.电解过程中,氯离子浓度不变
20.关于晶体的下列说法正确的是
A.在晶体中只要有阴离子就一定有阳离子 B.在晶体中只要有阳离子就一定有阴离子
C.原子晶体的熔点一定比金属晶体的高 D.稀有气体原子序数越大,沸点越高
21.G、Q、X、Y、Z均为含氯化合物,我们不知它们的化学式,但知道它们在一定条件下具有如下转化关系(未配平):
(1)G→Q +
NaCl (2)Q + H2O ![]() X + H2 (3)Y + NaOH → G + Q + H2O
X + H2 (3)Y + NaOH → G + Q + H2O
(4)Z+NaOH→Q + X + H2O 此五种化合物中氯的化合价由低到高的顺序为:( )
A、Q G Z Y X B、G Y Q Z X C、G Y Z Q X D、Z X G Y Q
22.在含有S2—离子,且滴加酚酞显红色的溶液中,能大量共存的离子组是
A.NH4+、Ba2+、C1—、AlO2—
B.SO42—、NO3—、Fe2+、A13+
C.C1—、SO32—、Na+、K+
D.Na+、K+、C1O—、Cl—
二、填空题
23.Ⅰ、在中学化学实验中可用于分离或提纯的方法很多,如蒸馏、结晶、过滤、盐析、渗析、分液、溶解等,下列各组混合物的分离或提纯应选用什么方法最合适,若需多步操作,请按顺序填写。
①除去AgI胶体中混有的I—离子__ _ _;②除去苯中含有的少量苯酚
③分离CuSO4·5H2O和BaSO4的混合物 。
Ⅱ、根据实验测定硫酸铜晶体中结晶水含量的实验,填写以下空白。
已知:所得实验数据如下:
①加热前质量:W1(容器)=5.4g;W2(容器十晶体)=7.9g;
②两次加热后的平均质量:W3(容器十无水硫酸铜)=6.8g。
(1)请写出结晶水含量——质量分数的计算式(用Wl、W2、W3表示):______这一结果是偏高还是偏低?____ ___。
(2)从下列分析中选出造成实验误差的原因可能是(填写字母)________。
A.加热前称量时容器未完全干燥
B.最后两次加热后质量相差较大(>0.1g)
C.加热后容器未放入干燥器中冷却 D.加热过程中晶体有少量溅失
24.现有八种物质:①干冰;②金刚石;③晶体硫;④晶体硅;⑤过氧化钠;⑥二氧化硅晶体;⑦溴化铵;⑧氖,请用编号填写下列空白。
(1)通过非极性键形成原子晶体的是_______。
(2)固态时属于分子晶体的是_______。
(3)属于分子晶体,且分子为直线型的是_______。
(4)由单原子分子构成的分子晶体的是_______。
(5)含有非极性键的离子化合物的是_______。
25.现有中学常见的三种单质甲、乙、丙,它们在一定条件下能发生如下变化,其中次要生成物已略去。
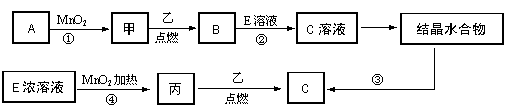
(1)已知:甲是无色气体,乙元素的+2价离子与Ne原子具有相同的电子层结构,丙在常温下呈黄绿色。写出④的离子方程式为 ;
(2)若反应①可在常温下进行,则A的名称是___________。若反应①需在加热条件下进行,则反应的化学方程式为 ;
(3)从C溶液中得到C需经过两步操作:先从C溶液中得到晶体,再将得到的晶体转化为C。从C溶液中得到晶体的过程被称为______________,将得到的晶体转化为C的实验条件是
26. 2,5—联苯二甲酸(PTA)是一个重要的高分子合成单体。PTA的合成对于高强度、高模量纤维的制备及高分子液晶的理论研究具有十分重要的意义。下面是用A(C8H10)合成PTA的主要路线。
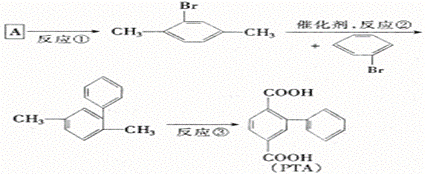
(1)上述反应中属于取代反应的是 。
(2)反应③所加试剂为 ,反应类型为 。
(3)A的结构简式为 ,名称 。
(4)符合A组成的同分异构体共有 种.
27.CO、CH4均为常见的可燃性气体。
(1) 等体积的CO和CH4在相同条件下分别完全燃烧,转移的电子数之比是____________。
(2) 已知在101 kPa时,CO的燃烧热为283 kJ/mol。相同条件下,若2 molCH4完全燃烧生成液态水,所放出的热量为1 mol CO完全燃烧放出热量的6.30倍,CH4完全燃烧反应的热化学方程式是____________________________________________________。
三、计算题
28.将![]() 和
和![]() 在适宜条件下按下式进行反应
在适宜条件下按下式进行反应![]()
![]()
![]() ,当在某一温度下达到化学平衡状态,试解答:
,当在某一温度下达到化学平衡状态,试解答:
(1)若测得平衡混合气体对空气的相对密度为0.6时,求![]() 的转化率.
的转化率.
(2)若测得平衡混合气体对空气的相对密度为0.47时,求![]() 在平衡混合气体中体积分数.
在平衡混合气体中体积分数.
29.某烃0.2mol与0.6mol氧气混合后,在一密闭容器中充分燃烧。所得产物通过浓硫酸时,浓硫酸增重10.8g,再通过灼热氧化铜粉末,固体质量减轻3.2g,最后通过足量的过氧化钠粉末时,固体质量又增加了11.2g。试通过计算确定该烃的分子式。
二、填空题
23.Ⅰ、①__ _ _;② ③ 。
Ⅱ、(1)_
_ ____
___。
(2)_____
___。
24.(1) ___ _ ___。 (2) __ _____。
(3) ___
___。 (4) __
_____。
(5) ____
___。
25.(1) ;
(2)___________。 ;
(3)______________,
26. (1) 。
(2) , 。
(3) , 。
(4) 种.
27. (1) ____________。(2) ____________________________________________________。
三、计算题
28.
29.
高三化学上册适应性测试试题卷答案
一、选择题:1.D2.B3.D4.A5.C6.C7.B8.C9.A10.A11.12.13.14.15.16.17.18.19.20.21.22.23.(1)![]() ;偏高;(2)A、D;
;偏高;(2)A、D;
解析:
(1)硫酸铜晶体结晶水含量的测定的原理是:![]() 需“四称”、“两热”,故需要的仪器有:A、B、D、F、G、H、I、K、L、M。
需“四称”、“两热”,故需要的仪器有:A、B、D、F、G、H、I、K、L、M。
(2)![]() ,实验值为:
,实验值为:![]() ,理论值为:
,理论值为:![]() ,偏高。Al加热前称量时容量不干燥,加热后水蒸发掉,被算成是晶体中结晶水,故结果偏高。B:本实验要求加热三次以上,直到最后两次称量的质量差小于0.1g才行,否则由于灼烧不充分,晶体中结晶水没有完全除去,测定结果偏低。C:加热后没有放在干燥器中冷却,结果冷却过程中又吸收空气中水分,质量变大,相当于脱水不完全,故结果偏低。D:加热过程中晶体溅失,质量变小,误当成是结晶水脱去,故结果偏高。
,偏高。Al加热前称量时容量不干燥,加热后水蒸发掉,被算成是晶体中结晶水,故结果偏高。B:本实验要求加热三次以上,直到最后两次称量的质量差小于0.1g才行,否则由于灼烧不充分,晶体中结晶水没有完全除去,测定结果偏低。C:加热后没有放在干燥器中冷却,结果冷却过程中又吸收空气中水分,质量变大,相当于脱水不完全,故结果偏低。D:加热过程中晶体溅失,质量变小,误当成是结晶水脱去,故结果偏高。
24.
答案:
(1)②④;(2)①③⑧;(3)①;(4)⑧;(5)⑤