高三上册第四次月考化学试题
解题所需数据:O:16 Cu:64 Na:23 H:1 C:12 总分150分
一、选择题(本大题共8小题,每题只有一个选项符合题意,每题4分计32分)
1.下列物质为纯净物的是
A、医用酒精 B、胆矾晶体 C、只由钠和氧组成的物质 D、纯净福尔马林
2、下列物质不属于“城市空气质量日报”报道的是:
A、二氧化硫 B、氮氧化物 C、二氧化碳 D、悬浮颗粒
3、水的状态除了气、液和固态外,还有玻璃态。它是由液态水急速冷却到165k时形成的,玻璃态的水无固定形态,不存在晶体结构,且密度与普通液态水的密度相同,有关玻璃态水的叙述正确的是:
A、水由液态变成玻璃态,体积缩小 B、水由液态变为玻璃态,体积膨胀
C、玻璃态是水的一种特殊状态 D、玻璃态水是分子晶体
4、某温度下,甲、乙两个烧杯中各盛有100 g相同浓度的KCl溶液,现将甲烧杯中的溶液蒸发掉35gH2O,析出晶体5g;乙烧杯中的溶液蒸发掉45gH2O,析出晶体10g。则原溶液的质量分数为
A、10% B、15% C、20% D、25%
5、化学反应2X+3Y![]() 2Z开始X的浓度为2mol/L,Y的浓度4mol/L,4min后X的浓度为1mol/L,则Y的速率为
2Z开始X的浓度为2mol/L,Y的浓度4mol/L,4min后X的浓度为1mol/L,则Y的速率为
A、0.75mol/(L·min) B、0.5 mol/(L·min)
C、0.25 mol/(L·min) D、0.375 mol/(L·min)
6、已知X元素的某种同位素的氯化物XCln为离子晶体,晶体中X元素的微粒核内中子数为m ,核外电子数为y,则该同位素的符号是
A、![]() B、
B、![]() C、
C、![]() D、
D、![]()
7、对某物质进行试验:①能与碱反应生成盐和水;②该物质的水溶液能与铁反应生成氢气;③该物质的水溶液中阳离子只有H+。据你学过的酸的概念,下列判断正确的是
A、①②③均能说明该物质是酸 B、①②③均不能说明该物质是酸
C、只有③能说明该物质是酸 D、②③能说明该物质是酸
8、某铁的氧化物,在一定条件下用100ml 7mol/L 的盐酸恰好完全溶解,当向所得溶液中通入0.56L(标准状况)的氯气时,刚好使溶液中Fe2+完全转化成Fe3+。则该氧化物的化学式表示为
A、FeO B、Fe3O4 C、Fe4O5 D、Fe5O7
二、选择题(本大题共10小题,每题有一到二个选项符合题意,每题4分,计40分)
9、不溶于水的氧化亚铜可溶于含硫酸铁的硫酸溶液中,这时生成的硫酸亚铁可用酸性高锰酸钾溶液滴定,从而测定氧化亚铜的量:
Cu2O+Fe2(SO4)3+H2SO4——FeSO4+CuSO4+H2O
FeSO4+KMnO4+H2SO4——Fe2(SO4)3+MnSO4+K2SO4+H2O
由上述反应知;0.1mol/L的KMnO4溶液1mL相当于氧化亚铜的量是
A、360mg B、3.6g C、0.3g D、2.5×10-4mol
10、下列关于氧化物的叙述中正确的是
A、酸酐一定是氧化物 B、非金属氧化物一定是酸性氧化物
C、碱性氧化物一定是金属氧化物 D、金属氧化物一定是碱性氧化物
11、下列各组物质仅利用物理性质不可区别的是
A、水和澄清肥皂水 B、酒精和汽油
C、食盐和氯化钡 D、苯和四氯化碳
12、X、Y、Z三种元素的原子核外最外层电子数分别为1、4、6,则由这三种元素形成的化合物不可能是
A、XYZ2 B、X2YZ3 C、X2YZ2 D、X6Y7Z2
13、设NA代表阿伏加德罗常数,下列说法中正确的是
A、2L 1mol/L(NH4)2SO4溶液中含2NA个NH4+
B、SiO2晶体中,与每1molSi原子结合形成共价键的O原子数为4NA
C、78gNa2O2中含有阴阳离子总数为3 NA
D、常温常压下,1mol氖气中含有NA个氖原子
14、pH=3的某酸与pH=11的Ba(OH)2等体积混合,则pH混
A、pH混≤7 B、pH混>7 C、pH混=7 D、pH混≥7
15、将0.2![]() 的CH3COONa溶液与0.1mol·L—1的HCl溶液等体积混合后,溶液中下列微粒的物质的量浓度的关系中,正确的是
的CH3COONa溶液与0.1mol·L—1的HCl溶液等体积混合后,溶液中下列微粒的物质的量浓度的关系中,正确的是
A、[CH3COO-] = [Cl-] = [H+] > [CH3COOH]
B、[CH3COO-] = [[Cl-] > [CH3COO-] > [H+]
C、[CH3COO-] > [Cl-] > [H+] > [ CH3COOH]
D、[CH3COO-] > [Cl-] > [ CH3COOH] > [H+]
16、下列离子方程式正确的是
A、碳酸氢镁溶液和过量的NaOH溶液反应:
Mg2++2OH-=Mg(OH)2↓
B、二氧化硫气体通入过量的Ca(ClO)2溶液中:
SO2+H2O+Ca2++2ClO-=CaSO3↓+2HClO
C、Ba(OH)2溶液中滴入NaHSO4至pH等于7:
Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O
![]() D、KHS的水解:HS-+H2O
H2S+OH-
D、KHS的水解:HS-+H2O
H2S+OH-
17、为证明盐的水解释吸热的,四位同学分别设计了如下方案,其中正确的是
A、甲同学:在醋酸钠溶液中滴加2滴酚酞试剂,加热后红色加深,说明盐类水解是吸热的。
B、乙同学:在盐酸中加入氨水,混合液温度上升,说明盐类水解是吸热的。
C、丙同学:将硝酸铵晶体溶于水,水温降低,说明盐类水解是吸热的。
D、丁同学:在氨水中加入氯化铵固体,溶液的pH变小,说明盐类水解是吸热的
18、周期表中有些元素有“对角线相似”现象(即周期表中处于对角线位置的两元素性质相似),发Li、Mg;Be、Al;B、Si等两两性质相似。现用熔融LiCl电解的方法可得锂和氧气。若用已潮解的LiCl加热蒸干并强热至熔融,再用惰性电极电解,结果得到金属锂和一种无色无味的气体。据此,下列说法正确的是
A、无色气体为电解生成的锂与水反应放出的H2
B、电解前LiCl在加热时已发生水解
C、电解时产生的无色气体是O2
D、无色气体是阳极放出的Cl2与水作用生成的O2
三、填空题(60分)
19、(4分)下列有关化学实验的操作或说法中,正确的是(填字母序号) 。
A、过滤、蒸发操作过程中都需要用玻璃棒不断搅拌液体。
B、将pH试纸置于表面皿上,用玻璃棒蘸取溶液点在pH试纸的中部,在30s内与对应的标准比色卡比较,即可测出该溶液的pH。
C、中和滴定实验中,锥形瓶内有少量蒸馏水会造成测定结果偏低。
D、在进行硫酸铜晶体里结晶水含量的测定实验中,称量操作至少要进行4次。
E、制备硫酸亚铁晶体时,向稀硫酸中加入废铁屑至有少量气泡发生时,过滤,然后加热蒸干滤液即可得硫酸亚铁晶体。
F、向2mLl0%NaOH溶液中滴入2%CuS04溶液的4—6滴,振荡后加入乙醛溶液0.5 mL,加热至沸腾,则有红色沉淀出现。
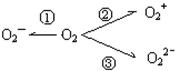 20、(10分,每空2分)(1)据报道,意大利科学家使用普通氧分子和带正电的氧离子作用,制成了新型的氧分子O4 ,它的结构很复杂,可能具有与S4相似的长方形结构,下列有关O4的说法不正确的是
20、(10分,每空2分)(1)据报道,意大利科学家使用普通氧分子和带正电的氧离子作用,制成了新型的氧分子O4 ,它的结构很复杂,可能具有与S4相似的长方形结构,下列有关O4的说法不正确的是
A、O4与O3、O2都是氧的同素异形体
B、O4分子内存在极性键
C、合成O4的反应可看作核聚变反应,即不属于化学变化
D、O4的能量比普通氧分子高,将来可用作更强力的火箭推进的氧化剂
(2)制备O2—、O22—、O2+的化合物是可能的,它们通常是在氧分子进行下列反应时生成的(如上图)。在这些反应中, 相当于氧分子的氧化, 相当于氧分子的还原。(填序号)
(3)各写出一种含有O2—、O22—的物质的化学式: 、
21、(10分,每小题各2分)实验室用稀硝酸与Cu反应来制备NO气体,如果采用(Ⅰ)装置,由于烧瓶内的空气不易排除,生成的NO很快被氧化成红棕色的NO2,不易观察到有无色的NO生成。即使可用排水法收集到无色的NO,也无说服力,学生会认为NO是由NO2与H2O反应生成的。有人设计了(Ⅱ)装置,用来做该实验可以达到满意的效果。
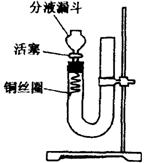
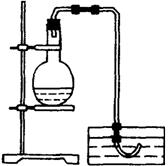
(Ⅰ) (Ⅱ)
(1)将有关操作补充完全:
①将活塞打开,从U型管的长管口注入稀硝酸,一直注到 为止。
②关闭活塞,用酒精灯在 加热,当 时,立即撤去酒精灯。
(2)回答下列问题:)
①反应在什么情况下可以自动停止?可在何处观察到无色的NO气体?
②如果再将活塞慢慢打开,可立即观察到哪些明显现象?
③如果要获得NO与NO2形成鲜明对照的实验效果,应该继续进行怎样的操作?
22、(10分,每空2分) ⑴室温下取0.2mol·L-1HCl溶液与0.2mol·L-1 MOH溶液等体积混合(忽略混合后溶液体积的变化),测得混合溶液的pH=6,试回答以下问题:
① 混合溶液中水电离出的c(H+)__________0.2mol·L-1 HCl溶液中电离出的c(H+);(填“>”、“<”、或“=”)
② 求出混合溶液中下列算式的精确计算结果(填具体数字):
c(Cl-) - c(M+) = ______________ mol·L-1
c(H+) - c(MOH) = _______________ mol·L-1
⑵ 室温下如果取0.2mol·L-1 MOH溶液与0.1 mol·L-1 HCl溶液等体积混合,测得混合溶液的pH<7,则说明MOH的电离程度________MCl的水解程度。(填“>”、“<”、或“=”),混合液中各离子浓度由大到小的顺序为______________
23、(6分,每空2分)氙有一种化合物XeO3,但极不稳定,易转化为其单质而具有强氧化性,将适量XeO3投入60mL0.1mol/L的Mn(NO3)2的水溶液中恰好完全反应,放出唯一气体氙单质,在标准状况下体积为112mL,则
⑴反应后的溶液中,锰在化合物中的化合价为__________
⑵该反应除有气体生成外,还有一明显的实验现象为___________________
⑶若将所得溶液稀释至180mL,溶液的PH为____________(设生成的酸均为强酸)
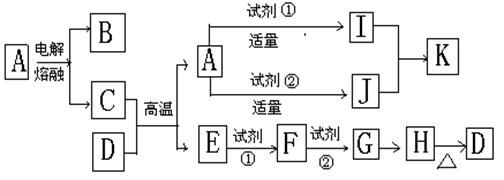 24、(10分)下列各物质转化关系图中A是一种高熔点固体,D是一种红棕色物质,H是一种红褐色物质。
24、(10分)下列各物质转化关系图中A是一种高熔点固体,D是一种红棕色物质,H是一种红褐色物质。
根据上述一系列变化关系回答下列问题:
(1)填写下列物质的化学式:(每空各1分)
A________ D________ 试剂①________
试剂②________
(2)写出下列反应的离子方程式:(每空2分)
a、I溶液和J溶液混和生成K _____
______________________
b、F和试剂②反应______________________________
_____
(3)写出G露置在空气中转化为H的化学方程式(2分)______ ______________
25、(10分)烯烃通过臭氧化并经锌和水处理得到醛或酮,例如:
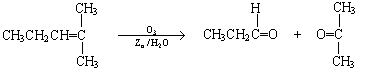 |
一种链状单烯烃A通过臭氧化并经锌和水处理得到B和C。化合物B含碳69.8%,含氢11.6%,B无银镜反应。D在浓硫酸存在下加热,可得到能使溴水褪色且只有一种结构的物质E。其转化关系如下;
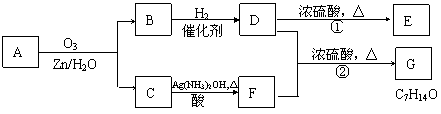 |
请回答下列问题:
(1) (每空2分)B的相对分子质量是______________。
(2) (每空2分)写出结构简式:A__________________、E_______________________。
(3) (每空1分)写出反应①、②的反应类型:①____________、②_______________。
(4) (2分)写出反应②的化学方程式:___________________________________。
四、计算题(18分)
26、(本题8分,每空2分)有机物A与乙酸无论以何种比例混合,只要质量一定,完全燃烧后产生的水的质量也一定,试回答:
⑴若A与乙酸相对分子质量相等,且既能发生银镜反应又能发生酯化反应,则A的结构简式为_____________。
⑵若A由四种元素形成的两种官能团组成,相对分子质量与乙酸相等,且分子中氢原子都不与碳原子相连,则A的结构简式为_____________。
⑶若A分子中C、H元素质量分数之和为86.67%,其余为O,且A的相对分子质量小于200,则A的分子式为___________。如果A分子每个碳原子都达到饱和,且能与金属钠反应产生氢气,则A的结构简式为________________________。
27、(10分)已知:Pb的化合价只有+2、+4,且+4价的Pb具有强氧化性,能氧化浓HCl生成Cl2;PbO2不稳定,随温度升高按下列顺序逐步分解:PbO2→Pb2O3→Pb3O4→PbO。现将a mol PbO2加热分解,收集产生的O2;向加热后所得固体中加入足量的浓盐酸,收集产生的Cl2。加热反应后所得固体中,Pb2+占Pb元素的物质的量分数为x;两步反应中收集的O2和Cl2的物质的量之和为y mol。
试回答下列问题:
⑴(2分)试写出Pb2O3与浓盐酸反应的化学方程式 。
⑵(4分)通过计算确定y与a、x的函数关系式。
⑶(每空2分)若两步反应中O2和Cl2的物质的量之比为5∶3,则剩余固体中含有的物质为 ;其物质的量之比为 。
高三考月考化学参考答案
一、选择题(本大题共8小题,每题只有一个选项符合题意,每题4分计32分)
1、B 2、C、3、C、4、D 5、D、6、D、 7、C 8、D
二、选择题(本大题共10小题,每题有一到二个选项符合题意,每题4分计40分)
9、CD 10、C、11、 C、12、A 13、 C D 14、A 15、D、16、CD 17、A 18、 C
三、
20、答案:(1)B、C
(2)② ;①、③
(3)K O2、 Na2 O2
21、(1)①单孔塞下沿且液面上不再留有气泡
②U型管的短管一侧,铜丝网有气泡产生
(2)①当产生的NO气体将稀HNO3排入长管内使钢丝网与稀HNO3脱离后反应会立即停止;在U型短管内可观察到无色的NO气体。
②U型管的长管中的稀HNO3又回落到短管内,分液漏斗中有红棕色气体出现。
③再将分液漏斗的活塞关闭,使稀HNO3与Cu继续反应产生无色的NO气体。
22、⑴ ① > ② 9.9×10-7 1.0×10-8
⑵ < c(Cl-) > c(M+) > c(H+) > c(OH-)
23、(1)+7 (2)溶液显紫色(3)1
24、(1)A Al2O3 DFe2O3试剂①HCl试剂②NaOH
(4分)(2)写出下列反应的离子方程式:
a、I溶液和J溶液混和生成K Al3++3AlO2-+6H2O=4Al(OH)3
b、F和试剂②反应 Fe 2+ +2OH-=Fe(OH)2
(2分)(3)写出G露置在空气中转化为H的化学方程式:4Fe(OH)2+O2+2H2O=4Fe(OH)3
25、(1)86
(2)A:(CH3CH2)2C=CHCH3 E:CH3CH=CHCH2CH3
(3)①消去反应 ②酯化(取代)反应
(4)CH3COOH+CH3CH2CH(OH)CH2CH3![]() CH3COOCH(CH2CH3)2+H2O
CH3COOCH(CH2CH3)2+H2O
![]() 26、⑴HO-CH2CHO ⑵ CO(NH2)2 ⑶ C8H8O -OH
26、⑴HO-CH2CHO ⑵ CO(NH2)2 ⑶ C8H8O -OH
27.(10分)⑴Pb2O3+6HCl(浓)=2PbCl2+Cl2↑+3H2O(2分)
⑵根据题意:分解所得混合物中n(Pb2+)= ax mol、n(Pb4+)= a (1-x) mol
根据电子守恒:n(O2)= ax/2 mol、n(Cl2)=a (1-x) mol (2分)
y=n(O2)+n(Cl2)=ax/2 mol+a (1-x) mol=a (1-x/2) mol(2分)
⑶ Pb3O4、PbO 3:4(4分)
注:答题中出现的其它合理答案均给分。