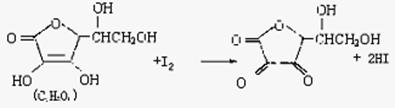高三上学期月考化学试卷
第Ⅰ卷 (选择题 ,共70分)
本卷可能用到的相对原子质量:
H—1,C—12,N—14,O—16,Si-28,S—32,Fe—56
一.选择题(本题共10小题,每题3分,共30分。每小题只有一个选项符合题意)
1.下列各原子或离子的电子排布式错误的是
A.Si 1s22s22p2 B.O2- 1s22s22p6
C.Na+ 1s22s22p6 D.Al 1s22s22p63s23p1
2.根据下表中列出的数据,判断下列热化学方程式书写不正确的是
| 化 学 键 | H-H | Cl-Cl | H-Cl |
| 生成1mol化学键时放出的能量 | 436kJ·mol-1 | 243kJ·mol-1 | 431kJ·mol-1 |
A.![]()
B.![]()
C.![]()
D.![]()
3.用NA表示阿伏加德罗常数的值,下列说法正确的是
A.60.0g二氧化硅晶体中,含有“Si—O”键的数目为NA
B.34g过氧化氢分子中极性共价键的数目为NA
C.标准状况下,22.4L甲烷和氨气的混合气体所含有的电子总数约为10NA
D.1molT2气体分子(超重氢分子)中所含的中子总数为2NA
4.分类方法在化学学科的发展中起到了非常重要的作用。下列分类标准合理的是
①根据酸分子中含有的H原子个数将酸分为一元酸、二元酸等
②根据反应中是否有电子的转移将化学反应分为氧化还原反应和非氧化还原反应
③根据分散系是否具有丁达尔现象将分散系分为溶液、胶体和浊液
④根据反应中的热效应将化学化学反应分为放热反应和吸热反应
A.①③ B.②④ C.①②④ D.②③④
5.下列表述正确的是
①人造刚玉熔点很高,可用作高级耐火材料,主要成分是二氧化硅
②提前建成的三峡大坝使用了大量水泥,水泥是硅酸盐材料
③化学家采用玛瑙研钵摩擦固体反应物进行无溶剂合成,玛瑙的主要成分是硅酸盐
④太阳能电池可采用硅材料制作,其应用有利于环保、节能
⑤游客佩戴由添加氧化亚铜的二氧化硅玻璃制作的变色眼镜来保护眼睛
A.①②③ B.③④⑤ C.②④ D.③⑤
6.X、Y、Z均为短周期元素。已知X元素的原子核内无中子,Y元素的原子核外最外层电
子数是其次外层电子数的2倍,Z元素是地壳中含量最丰富的元素。有下列含该三种元素
的化学式:①X2Y2Z2 ②X2YZ3 ③X2YZ2 ④X2Y2Z4 ⑤X3YZ4 ⑥XYZ3,其中可能存在对应物质的是
A.①②④⑤ B.①②③④ C.②③④ D.②⑤⑥
7.Na2Sx在碱性溶液中可被NaClO氧化为Na2SO4,而NaClO被还原为NaCl,若反应中Na2Sx
与NaClO的物质的量之比为1∶16,则x值是
A.2 B.3 C.4 D.5
 8.可用于鉴别以下三种化合物的一组试剂是:
8.可用于鉴别以下三种化合物的一组试剂是:
①银氨溶液 ②溴的四氯化碳溶液 ③氯化铁溶液 ④氢氧化钠溶液
A.②与③ B.③与④ C.①与④ D.①与②
9.下列有关实验操作的说法中,不正确的是
A.振荡试管中的液体时,应用手指拿住试管,用手腕甩动
B.在做乙烯的制备实验时要加入少量的碎瓷片,以防止溶液暴沸
C.因苯酚具有弱酸性,如果皮肤上不慎沾有苯酚,应立即用大量的NaOH稀溶液冲洗
D.中学阶段在使用试纸时,必须先用蒸馏水湿润,然后再将待测液滴到试纸上,看变化的结果,但是PH试纸除外,在使用它时不能先用蒸馏水湿润
10.常温下,在一定体积pH =12的Ba(OH)2溶液中,逐滴加入一定物质的量浓度的NaHSO4溶液,当溶液中的Ba2+恰好完全沉淀时,溶液pH =11。若反应后溶液的体积等于Ba(OH)2溶液和NaHSO4溶液体积之和,则Ba(OH)2溶液和NaHSO4溶液体积之比是:
A.1:9 B.1:1 C.1:2 D.1:4
二.选择题(本题共10小题,每小题4分,共40分。每小题有一个或两个选项符合题意)
11.下列有关物质性质的描述正确的是
A.SO2气体通入溴水中使溴水褪色,不属于氧化还原反应
B.麦芽糖与新制的Cu(OH)2浊液加热产生砖红色沉淀,而蔗糖不能
C.BrCl与Br2、Cl2的化学性质相似,则BrCl+H2O=HBr+HClO
D.在Al(OH)3胶体中加入Ba(OH)2溶液至过量,先有沉淀后沉淀溶解
12.由短周期元素构成的某离子化合物中,一个阳离子和一个阴离子核外电子数之和为20。下列说法中正确的是
A.晶体中阳离子和阴离子个数不一定相等
B.晶体中一定有离子键可能含有共价键
C.所含元素一定不在同一周期也不在第一周期
D.晶体中阳离子半径一定大于阴离子半径
13.下列各组离子一定能大量共存的是:
A.含有大量Al3+的溶液中:NH4+、Na+、Cl-、HCO3-
B.在强碱溶液中:Na+、K+、AlO2-、CO32-
C.在c(H+)=10-13mol·L-1的溶液中:NH4+、Mg2+、SO42-、NO3-
D.在pH=1的溶液中:K+、Fe2+、Cl-、NO3-
14.下列反应的离子方程式错误的是:
A.向碳酸氢钙溶液中加入过量氢氧化钠
Ca2++2HCO3-+2OH-==CaCO3↓+2H2O+CO32-
B.等体积等物质的量浓度的氢氧化钡溶液与碳酸氢铵溶液混合
Ba2++2OH-+NH4++HCO3-==BaCO3↓+NH3·H2O+H2O
C.在溴化亚铁溶液中通入过量的氯气:Cl2+2Fe2++2Br-==2Fe2++2Cl-+Br2
D.过量CO2通入氢氧化钠溶液中:CO2+2OH-==CO32-+H2O
15.从下列事实所列出的相应结论正确的是
|
| 实 验 事 实 | 结 论 |
| A | Cl2的水溶液可以导电 | Cl2是电解质 |
| B | SO2通入硝酸钡溶液出现白色沉淀 | BaSO3不溶于强酸 |
| C | NaHCO3溶液与NaAlO2溶液混合产生白色沉淀 | 酸性:HCO3->Al(OH)3 |
| D | 常温下白磷可自燃而氮气须在放电时才与氧气反应 | 非金属性:P>N |
16.在pH为4~5的环境中,Cu2+、Fe2+不生成沉淀,而Fe3+几乎完全沉淀。工业上制
CuCl2是将浓盐酸用蒸汽加热到80℃左右,再慢慢加入粗氧化铜(含杂质FeO),充分搅拌
使之溶解。欲除去溶液中的杂质离子,下述方法正确的是
A.加入纯Cu将Fe2+还原
B.向溶液中加入(NH4)2S使Fe2+沉淀
C.直接加水加热使杂质离子水解除去
D.在溶液中通入Cl2,再加入CuO粉末调节pH为4~5
17.将氢气、甲烷、乙醇等物质在氧气中燃烧时的化学能直接转化为电能的装置叫燃料电
池。燃料电池的基本组成为电极、电解质、燃料和氧化剂。此种电池能量利用率可高达80%
(一般柴油发电机只有40%左右),产物污染也少。下列有关燃料电池的说法错误的是
A.上述燃料电池的负极反应材料是氢气、甲烷、乙醇等物质
B.氢氧燃料电池常用于航天飞行器,原因之一是该电池的产物为水,经过处理之后可
供宇航员使用
C.乙醇燃料电池的电解质常用KOH,该电池的负极反应为
C2H5OH-12e-=2CO2↑+3H2O
D.甲烷燃料电池的正极反应为O2+2H2O+4e-=4OH-
18.下列叙述正确的是
A.0.01mol/LCH3COOH与pH=12的NaOH溶液混合,若有c(CH3COO-)>c(Na+),则混合液
一定呈碱性
B.常温下,将等体积0.01mol/LHCl与pH=12的氨水混合,则混合液的pH=7
C.0.1mol/L的某二元弱酸盐Na2A溶液中,c(Na+)=2c(H2A)+2c(HA‑)+2c(A2-)
D.将5 mL 0.02mol/L的H2SO4与5 mL 0.02mol/LNaOH溶液充分混合,若混合后溶液
的体积为10mL,则混合液的pH=2
19.近年来珠海建设了多个主题广场,为市民提供了夏夜纳凉的好去处,夜色中常看到小
朋友手持被称为“魔棒”的荧光棒玩耍,“魔棒”发光原理是利用过氧化氢氧化草酸二酯
产生能量,该能量被传递给荧光物质后便发出荧光,草酸二酯(CPPO)结构简式为
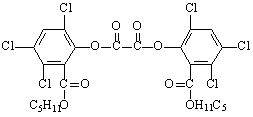
下列有关说法正确的是
A.草酸二酯属于芳香族化合物 B.草酸二酯属于高分子化合物
C.1mol草酸二酯与氢氧化钠稀溶液反应(苯环上卤素不水解),最多消耗4molNaOH
D.1mol草酸二酯与氢气完全反应,需要氢气10mol
20.在一密闭容器中有如下反应:aX(g)+bY(g) ![]() nW(g);ΔH=Q
nW(g);ΔH=Q
某化学兴趣小组的同学根据此反应在不同条件下的实验数据,作出了如下曲线图:
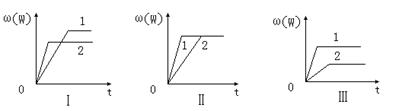
其中,ω(W)表示W在反应混合物中的百分含量,t表示反应时间。其它条件不变时,下
列分析可能正确的是
A.图Ⅰ可能是不同压强对反应的影响,且P2>P1,a+b<n
B.图Ⅱ可能是在同温同压下催化剂对反应的影响,且1使用的催化剂效果好
C.图Ⅱ可能是不同压强对反应的影响,且P1>P2,n<a+b
D.图Ⅲ可能是不同温度对反应的影响,且T1>T2,Q<0
第Ⅱ卷 (非选择题,共80分)
三.本题包括3小题,共28分
21.(6分) 某学生为了将含有少量杂质(铜粉)的氯化铁提纯,拟定以下实验步骤:a.把样品加水溶解,b.过滤 c.把滤液加热蒸干,得到FeCl3固体,试回答:
(1) 以上设计 科学的(填是或不是),理由是
。
(2) 请你设计和完善提纯FeCl3的方案:.
①把样品加水溶解,② ,③过滤,④ ,
⑤ ,⑥把滤液加热蒸发结晶,得FeCl3固体。
22.(10分)某化学兴趣小组按照下列方案进行“由含铁废铝制备硫酸铝晶体”的实验:
步骤1:取一定量含铁废铝,加足量的NaOH溶液,反应完全后过滤。
步骤2:边搅拌边向滤液中滴加稀硫酸至溶液的pH=8~9,静置、过滤、洗涤。
步骤3:将步骤2中得到的固体溶于足量的稀硫酸。
步骤4:将得到的溶液蒸发浓缩、冷却、结晶、过滤、干燥。
请回答以下问题:
⑴上述实验中的过滤操作需要玻璃棒、______________、______________等玻璃仪器。
⑵步骤1过滤的目的是__________________________________________。
⑶当步骤2中的溶液pH=8~9时,检验沉淀是否完全的方法是______________。
⑷步骤2中溶液的pH控制较难操作,可改用________________ ____。
|
(1)下列说法中正确的是( )
A.上述反应为取代反应 B.滴定时可用淀粉溶液作指示剂
C.滴定时可用甲基橙作指示剂 D.锥形瓶不能用待测橙汁润洗
(2)上述实验前要配制7.50×10-3mol/L的标准碘溶液100mL。除玻璃棒外,还需要
的玻璃仪器有 等(填编号)
A.容量瓶 B.烧杯 C.锥形瓶 D.烧瓶
(3)标准碘液放入 (填仪器名称),滴定时,眼睛注视 ,直到滴定终点。滴定至终点的现象是 。
(4)滴定过程中能否剧烈摇动锥形瓶 (填“能”或“不能”),为什么
。
(5)若经数据处理,滴定中消耗的标准碘溶液的体积是15.00mL,锥形瓶中注入的待
测橙汁是20.00mL,则此橙汁中维生素C的含量是 mg/L,该橙汁 (填“是”
或“不是”)纯天然的新鲜橙汁。
四.本题包括3小题,共31分
24.(8分) 化学中用类比的方法可预测许多物质的性质。
如根据H2+Cl2![]() 2HCl 推测:H2+Br2
2HCl 推测:H2+Br2![]() 2HBr。但类同是相对的,如根据2Na2O2+2CO2
2HBr。但类同是相对的,如根据2Na2O2+2CO2![]() 2Na2CO3+O2 类推:2Na2O2+2SO2
2Na2CO3+O2 类推:2Na2O2+2SO2![]() 2Na2SO3+O2是错误的,应该为:Na2O2+SO2
2Na2SO3+O2是错误的,应该为:Na2O2+SO2![]() Na2SO4。
Na2SO4。
⑴下列各组类比中正确的是 。
A.NH4Cl![]() NH3↑+HCl 推测:NH4I
NH3↑+HCl 推测:NH4I![]() NH3↑+HI↑
NH3↑+HI↑
B.由CO2+Ca(ClO)2+H2O![]() CaCO3↓+2HClO
CaCO3↓+2HClO
推测:SO2+Ca(ClO)2+H2O![]() CaSO3↓+2HClO
CaSO3↓+2HClO
C.由2CO2+Ca(ClO)2+2H2O![]() Ca(HCO)2+2HClO
Ca(HCO)2+2HClO
推测:CO2+NaClO+H2O![]() NaHCO3+HClO
NaHCO3+HClO
D.由Na2SO3+2HCl![]() 2NaCl+H2O+SO2↑
2NaCl+H2O+SO2↑
推测:Na2SO3+2HNO3![]() 2NaNO3+H2O+SO2↑
2NaNO3+H2O+SO2↑
⑵根据2Na
+ 2H2O![]() 2NaOH
+ H2↑的反应推断Na与液NH3反应的方程式为:
2NaOH
+ H2↑的反应推断Na与液NH3反应的方程式为:
________________________________________________________________。
⑶由氢氧化铁与盐酸反应生成氯化铁和水,应用有关化学知识,推断写出氢氧化铁与氢碘酸反应的化学方程式_________________________________________________________。
⑷从2F2+2H2O![]() 4HF+O2反应预测2F2+4NaOH
4HF+O2反应预测2F2+4NaOH![]() 4NaF+2H2O+O2,然而经实验,物质的量相等的氟气和氢氧化钠正好完全反应,生成氟化钠、水和放出一种气体,请根据实验结果写出化学反应方程式____________________________________________________。
4NaF+2H2O+O2,然而经实验,物质的量相等的氟气和氢氧化钠正好完全反应,生成氟化钠、水和放出一种气体,请根据实验结果写出化学反应方程式____________________________________________________。
25.(11分)某化学兴趣小组,专门研究了氧族元素及其某些化合物的部分性质。所查资料如下:
(1)碲(Te)为固体,H2Te为气体,Te和H2不能直接化合生成H2Te
(2)等物质的量氧气、硫、硒、碲与H2反应的焓变情况如图所示:
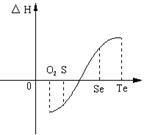
请回答下列问题:
(1)H2与硫化合的反应 热量(填“放出”或“吸收”)。
(2)根据题目所给信息,请解释为什么Te和H2不能直接化合
。
(3)H2S的水溶液显弱酸性,写出其电离方程式 ;在一定温度下,它的第一级电离常数可用 Ka表示,Ka 值越大,表示_________________,Ka值大小与温度的关系是:温度升高,Ka 值__________(填“一定增大”、“一定减小”、或“可能增大也可能减小”)。
(4)在容积均为1 L(容器体积不可变)的甲、乙两个容器中,分别加入2 mol SO2、
1 mol O2 和4 mol SO2、2 mol O2,在相同温度、催化剂下使其反应。最终达到平衡后,两容器中SO2转化率分别为α甲、α乙,甲容器中平衡常数表达式为 ,此时α甲 α乙(填“大于”、“小于”或“等于”)。
26.(12分)A~J是中学化学中常见的几种物质,它们之间的转化关系如下图所示。已知常温下A为固体单质,B为淡黄色粉末,C、F、I为气态单质,E在常温下为液体,且E可由C、F化合生成,J可作禽流感、SARS等病毒的杀菌消毒剂。
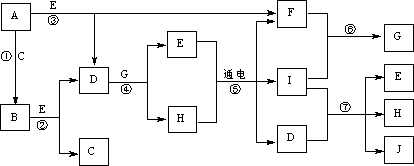
(1)写出E的电子式:_____________________。
(2)写出反应⑦的离子方程式: 。
(3)向AlCl3溶液中加入少量固体B,写出反应的化学方程式:___________________。
(4)以Pt为电极电解滴加有少量酚酞的H饱和溶液,则阳极的电极反应式为:
__________________。________极(填“阴”或“阳”)附近溶液由无色变为红色,其原因
是:__________________________________________________________________。
五.本题包括2小题,共21分
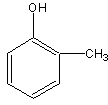
27.(7分)某有机化合物A含碳77.8%,氢为7.40%,其余为氧,A的相对分子质量为甲
烷的6.75倍。
(1)该有机物的分子式为
(2)据此确定该有机物含苯环的所有可能的结构简式。
28.(14分)已知: CH3-CH=CH2 + HBr → CH3-CHBr-CH3
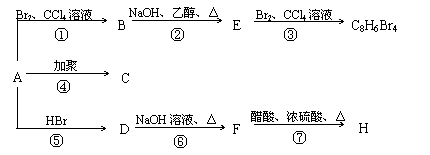 1mol某烃A充分燃烧后可以得到8 mol CO2和4 mol H2O。该烃A 在不同条件下能发生下图所示的一系列变化。
1mol某烃A充分燃烧后可以得到8 mol CO2和4 mol H2O。该烃A 在不同条件下能发生下图所示的一系列变化。
(1)A的化学式: A的结构简式:
(2)上述反应中,①是 反应,⑦是 反应。(填反应类型)
(3)写出C、D、E、H物质的结构简式:
C , D ,
E , H 。
(4)写出D → F反应的化学方程式
高三月考化学试题答案
一.选择题(本题共10小题,每题3分,共30分。每小题只有一个选项符合题意)
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| 答案 | A | B | C | B | C | B | D | A | C | D |
二.选择题(本题共10小题,每小题4分,共40分。每小题有一个或两个选项符合题意)
| 题号 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 |
| 答案 | BD | AB | B | CD | C | D | C | CD | A | AB |
三.本题包括3小题,共28分
21.(6分)
(1)①不是(1分);②加水后,Cu与FeCl3反应,(或Cu+2FeCl3====2FeCl2+CuCl2);滤液蒸干过程中,FeCl3易水解,得不到纯FeCl3固体。(2分)
(2 ).加过量铁粉、通入足量Cl2、加入少量盐酸。(3分)
22.(10分)
(1)烧杯 漏斗 (各1分)
(2)除去铁等不溶于碱的杂质(2分)
(3)取上层清夜,逐滴加入稀硫酸,若变浑浊则说明沉淀不完全,若不变浑浊则说明沉淀完全(3分)
(4)通入足量的CO2气体(3分)
23.(12分)(1)B D(2分) (2)A B (2分)
(3)酸式滴定管;锥形瓶;溶液呈蓝色(3分)
(4)不能;维生素C易被空气氧化(2分)
(5)990(2分);不是(1分)
四.本题包括3小题,共31分
24.(8分) (1)C; (2)2Na+2NH3==2NaNH2+H2↑;
(3)2Fe(OH)3+6HI==2FeI2+I2+6H2O; (4)2F2+2NaOH==2NaF+OF2+H2O。
25.(11分)
(1)放出(1分);
(2)由图可知:H2和Te的反应是一个吸热反应,即△H>0,所以该反应不能发生(2分)。
![]() (3)
(2分,只写第一步电离也得分);电离程度越大(或酸性越强)(1分);一定增大(1分)。
(3)
(2分,只写第一步电离也得分);电离程度越大(或酸性越强)(1分);一定增大(1分)。
(4)K = α甲2/(1-α甲)3(2分);小于(2分)
26.(12分)(1) ![]() (2分)
(2分)
(2)Cl2+2OH-![]() Cl-+C1O-+H2O(2分)
Cl-+C1O-+H2O(2分)
(3)4AlCl3+6Na2O2+6H2O![]() 4Al(OH)3↓+12NaCl+3O2↑(2分)
4Al(OH)3↓+12NaCl+3O2↑(2分)
(4)2C1--2e-![]() Cl2(2分) 阴(2分) 在阴极H+不断放电,破坏了水的电离平
Cl2(2分) 阴(2分) 在阴极H+不断放电,破坏了水的电离平
衡,促使水继续电离,导致溶液中c(OH-)>c(H+),所以阴极附近溶液变红(2分)
五.本题包括2小题,共21分
27.(7分)(1)A的分子式C7H8O (2分)
(2)A的可能结构简式是:(每个1分)
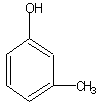
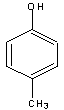
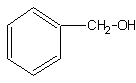
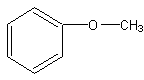
28.(14分)
(1)C8H8、 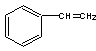 (每空1分)
(每空1分)
(2)加成, 酯化(或取代);(每空1分)

![]() (3)
(3)
C: D:
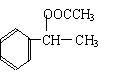 | |||
E: H:
(每空2分)
(4)(2分)