高三化学选择题专项训练(四)
一选择题(本题包括8小题,每小题4分,共32分。每小题只有一个选项符合题意)
1.“神六”飞船在重返大气层时,由于同空气的剧烈磨擦,船体的表面温度将上升到2000℃~3000℃,因此飞船表面必须有良好的防高温措施。下列有关飞船的防高温措施中不可取的是
A.使用陶瓷类的贴面覆盖船体,以防止高温侵入舱内
B.使用在一定条件下能熔化或气化的表面覆盖材料
C.使用在一定条件下能与大气层中的氧气发生剧烈燃烧的表面覆盖材料
D.使用在一定条件下能发生分解反应的表面覆盖材料
2.10月13日有关媒体报道天津巨能化学有限公司生产的巨能钙含有双氧水,经农业部产品质量监督检验测试中心检测,部分送检品种不同程度地含双氧水。双氧水属于危险化学品及有毒有害物质,以前也曾作为漂白剂、杀菌剂、防腐剂广泛用于食品中。下列有关H2O2的叙述中正确的是
A.H2O2是二元弱酸,将H2O2溶液滴入含有酚酞的NaOH溶液中,红色消失,一定是因为发生了酸碱中和反应
B.H2O2分子中含有非极性键,因此H2O2是非极性分子
C.H2O2的自然分解过程非常缓慢,一般不易察觉,但正因为如此,一般药用的双氧水在贮存期间也会逐渐失效
D.人体中含有过氧化氢酶,过氧化氢酶可以使H2O2分解,因此人体即使吸收多量的H2O2也没有关系,可以被过氧化氢酶分解为无毒物质
3.下列说法正确的是
①非金属氧化物一定不是碱性氧化物 ②焰色反应是化学变化 ③醛类既有还原性又有氧化性但无酸性 ④镁铝铁铜属于有色金属或轻金属 ⑤硝酸钾是纯净物,又属于复合肥料 ⑥稀有气体元素不活泼的原因是因为它们原子的最外层都达到了八电子稳定结构 ⑦CuS、Fe(OH)3、FeCl3、SiH4都不能直接用化合反应制得 ⑧石炭酸是含氧酸,可与甲醇一定条件下发生酯化反应
A、全正确 B、除④⑥⑧ C、①②④⑥⑦正确 D、①③⑤正确
4.下列物质按不同类别分组,所得组合最不合理的是
(1)糖类(2)塑料(3)石油(4)蛋白质(5)合成纤维(6)棉花(7)陶瓷(8)玻璃(9)天然气(10)水泥(11)合成橡胶(12)煤(13)油脂(14)羊毛
A、(1)(4)(13) B、(2)(5)(11) C、(7)(8)(11)(14) D、(3)(9)(12)
5. 下列各组离子在指定溶液中,能大量共存的是
①无色溶液中:K+,Cl—,Na+,HPO42—,PO43—,SO42—
②PH=11的溶液中:CO32—,Na+,AlO2—,NO3—,S2—,SO32—,ClO—
③水电离出的H+浓度C(H+)=10—12mol·L—1的溶液中:Cl—,HCO3—,NO3—,NH4+,S2O32—
④加入铝能放出H2的溶液中:Mg2+,NH4+,Cl—,K+,SO42—,NO3—
⑤酸性溶液中:Fe2+,Al3+,NO3—,I—,Cl—,S2—
A.①②④ B.①②③ C.①② D.①
6.下列物质存放方法正确的是
A.药品柜的同一层不可存放浓硝酸和浓氨水 B.少量的钠保存在无水乙醇中
C.少量白磷保存在二硫化碳中 D.硅酸钠溶液保存在玻璃塞的试剂瓶中
7. 原子的核电荷数小于18的某元素X,其原子的电子层数为n,最外层电子数为2n+1, 原子核内质子数是2n2-1。下列有关X的说法中,不正确的是
A.X能形成化学式为X(OH)3的碱
B.X可能形成化学式为KXO3的含氧酸钾盐
C.X原子的最外层电子数和核电荷数肯定为奇数
D.X能与某些金属元素形成化合物
8. 下列有关说法正确的是
A.H2SO4的酸性比HClO的酸性强,所以S的非金属性比Cl强
B.Mg(OH)2是中强碱,Al(OH)3是两性氢氧化物,所以Al的金属性比Mg强
C.H2S加热到300℃时开始分解,H2O加热到1000℃开始分解,说明O的非金属性比强
D.Na和Mg与酸都能激烈反应放出氢气,因此无法比较它们的金属性强弱
二.选择题(本题包括12小题,每小题4分,每小题只有一个或两个选项符合题意。若正确答案只包括一个选项.)
9. 已知某弱酸的二种酸式盐NaH2XO4和Na2HXO4,其中NaH2XO4溶液呈酸性,Na2HXO4溶液呈碱性。现有30℃时,浓度均为0.1 mol·L-1的NaH2XO4溶液和Na2HXO4溶液,两溶液中均存在的关系是
A.c(H+)·c(OH-)>1×10-14
B.c(H+)+2c(H3XO4) +c(H2XO4-)=c(XO43-)+c(OH-)
C.c(H+)+c(H3XO4)=c(HXO42-)+2c(XO43-)+c(OH-)
D.c(Na+)+c(H+)=c(H2XO4-) +c(OH-)+2 c(HXO42-)+3c(XO43-)
10.阿伏加德罗常数约为6.02×1023 mol—1,下列说法正确的是
A.常温下,l mol氯气与熟石灰完全反应转移电子数为2×6.02×1023
B.44g二氧化碳中含有的共用电子对数目为2×6.02×1023
C.标准状况下,22.4L 甲醛所含的分子数约为6.02×1023
D.常温常压下,20g重水(D2O)所含的中子数为8×6.02×1023
11.在pH=1的酸溶液和pH=13的氢氧化钠溶液中,分别加入过量的铝粉,若酸溶液放出的氢气多,其可能的原因是
A.两溶液体积相同,酸是多元强酸
B.两溶液体积相同,酸是弱酸
C.酸是强酸,且酸溶液的浓度是碱溶液浓度的3倍以上
D.酸是强酸,且酸溶液的体积是碱溶液体积的3倍以上
12.下列离子方程式书写正确的是
A.向Ba(OH)2溶液中逐滴加入NH4HSO4溶液至刚好沉淀完全:
Ba2+ + OH- + H+ + SO42- == BaSO4↓+ H2O
B.将过量的NaOH溶液滴入同浓度的少量Ca(HCO3)2溶液
Ca2+ + 2HCO3—+2OH—====CaCO3↓+ 2H2O + CO32—
C.醋酸钡溶液和硫酸反应:Ba2++SO42-== BaSO4↓
D.向酸性FeSO4溶液中加H2O2溶液:
2Fe2+ + 2H2O2 + 4H+ ==2Fe3+ + 4H2O
13.下列关于物质结构的说法中,正确的是
A.物理变化中可能有化学键被破坏 B.由原子直接构成的晶体一定是原子晶体
C.含有离子的晶体一定是离子晶体 D.含有阴、阳离子的物质中不一定存在离子键
14.一定条件下,可逆反应X(g)+3Y(g)![]() 2Z(g),若X、Y、Z起始浓度分别为c1、c2、c3(可以为0),平衡时X、Y、Z的浓度分别为0.1mol/L、0.3mol/L和0.08mol/L,则下列判断不合理的是
2Z(g),若X、Y、Z起始浓度分别为c1、c2、c3(可以为0),平衡时X、Y、Z的浓度分别为0.1mol/L、0.3mol/L和0.08mol/L,则下列判断不合理的是
A.c1 :c2=1 :3 B.平衡时,Y和Z的生成速率之比为3 :2
C.X、Y的转化率不相等 D.c1的取值范围为0<c1<0.14mol/L
15.、一种新型的燃料电池,它以多孔镍板为电极插入KOH溶液中,然后分别向两极通入乙烷和氧气。有关此电池的推断正确的是
A、负极反应为14 H2O+7O2+28e—=28 OH—
B、放电一段时间后,负极周围的pH升高
C、每消耗1mol C2H6,则电路上转移的电子为14mol
D、放电过程中KOH的物质的量浓度不变
16. 下列除去杂质的方法正确的是
A、除去CO2中的少量的HCl:通过足量的饱和碳酸氢钠溶液
B、除去N2中的少量的CO:通过足量的灼热的CuO粉末
C、除去KCl溶液中的少量CaCl2:加适量Na2CO3溶液,过滤
D、除去铜粉中混有的铁:加足量稀硝酸,过滤
 17.如图,Ⅰ是恒压密闭容器,Ⅱ是恒容密闭容器。
17.如图,Ⅰ是恒压密闭容器,Ⅱ是恒容密闭容器。
其它条件相同时,在Ⅰ、Ⅱ中分别加入2mol X和2mol
Y,起始时容器体积均为V L,发生如下反应并达到平衡(X、Y状态未知):2X(?)+Y(?)![]() aZ(g)。此时Ⅰ中X、Y、Z的物质的量之比为1:3:2,则下列说法一定正确的是
aZ(g)。此时Ⅰ中X、Y、Z的物质的量之比为1:3:2,则下列说法一定正确的是
A.若X、Y均为气态,则平衡时气体平均摩尔质量:Ⅰ>Ⅱ
B.若X、Y不均为气态,则平衡时气体平均摩尔质量:Ⅰ>Ⅱ
C.若X为固态,Y为气态,则Ⅰ、Ⅱ中从起始到平衡所需时间相同
D.平衡时Ⅰ容器的体积小于V L
18. 醋酸可以通过分子间氢键双聚。一定温度下,将一定质量的冰醋酸加水稀释过程
中,溶液的导电能力变化如右下图所示,有关说法正确的是
A、a、b、c三点溶液的pH:a>b>c
B、用湿润的pH试纸测量c处溶液的pH值,比实际pH值偏小
C、a、b、c三点溶液用1mol/L氢氧化钠溶液中和,消耗氢氧化钠溶液体积:a>b>c
D、若在“O”点醋酸双聚成八元环分子,则其结构为:
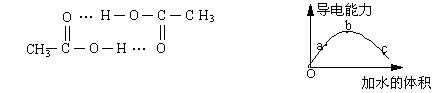
19.CuI是一种不溶于水的白色固体,它可以由反应:2Cu2++4I―==2CuI↓+I2而得到。现以
石墨为阴极,以Cu为阳极电解KI溶液,通电前向电解液中加入少量酚酞和淀粉溶液。电
解开始不久,阴极区溶液呈红色,而阳极区溶液呈蓝色。对阳极区溶液呈蓝色的正确解释是
A、2I―-2e-==I2 碘遇淀粉变蓝
B、Cu-2e-==Cu2+ Cu2+ 显蓝色
C、2Cu+4I--4e-==2CuI↓+I2 碘遇淀粉变蓝
D、4OH― –4e-==2H2O+O2 O2将I-氧化为I2,碘遇淀粉变蓝
1—5 C C D D D 6—10 A A C AD C 11—15 BD B AD CD C 16—20 B AC D C C