高三化学选择题专项训练(7)
一、选择题(本题包括8小题,每小题4分,共32分。每小题只有一个选项符合题意)
1、CsICl2是一种碱金属的多卤化物,这类物质在化学反应中既可表现氧化性又可表现还原性,有关该物质的说法正确的是
A. Cs显+3价,I 、Cl 均显-1
B.Cs显 +1价,Cl显+1价,I显-1价、
C. 在CsICl2溶液中通入SO2气体,有硫酸生成
D.在CsICl2溶液中通入Cl2 ,有单质碘生成
2、高铁电池是一种新型可充电电池,与普通高能电池相比,该电池能长时间保持稳定的放电电压。高铁电池的总反应为:
3Zn+2K2FeO4+8H2O===3Zn(OH)2+2Fe(OH)3+4KOH
下列叙述不正确的是
A.放电时负极反应为:3Zn —6e—+6OH— == 3Zn(OH)2
B.放电时正极反应为:2FeO42—+6e—+8H2O===2Fe(OH)3+10OH—
C.放电时每转移3mol电子,正极有1mol K2FeO4被氧化
D.放电时正极附近溶液的碱性增强
3、下列仪器①普通漏斗 ②容量瓶 ③蒸馏烧瓶 ④坩埚 ⑤分液漏斗 ⑥滴定管 ⑦燃烧匙 ⑧烧杯常用于物质分离的是( )
A. ①③④⑤ B. ②④⑥⑧ C. ①③⑤ D. ③⑤⑦
4、在实验室进行物质制备,下列从原样及试剂分别制取相应的最终产物的设计中,理论上正确、操作上可行、经济上合理的是( )
![]()
![]()
![]()
![]()
![]() A、C
CO
CO2
Na2CO3
A、C
CO
CO2
Na2CO3
B、Cu Cu(NO3)2溶液 Cu(OH)2
![]()
![]()
![]()
![]() C、Fe
Fe2O3
Fe2(SO4)3溶液
C、Fe
Fe2O3
Fe2(SO4)3溶液
D、CaO Ca(OH)2溶液 NaOH溶液
5、2004年诺贝尔化学奖授予以色列科学家阿龙·切哈诺沃、阿夫拉姆·赫什科和美国科学家欧文·罗斯,以表彰他们发现了泛素调节的蛋白质降解。蛋白质水解可得到多肽,多肽进一步水解,最终产物为氨基酸。今有一个多肽分子,其化学式为C55H70O19N10,将其完全水解后得到下列四种氨基酸:甘氨酸(C2H5O2N)、丙氨酸(C3H7O2N)、苯丙氨酸(C9H11O2N)和谷氨酸(C5H9O4N)。则一个该多肽分子完全水解后所得谷氨酸的分子数为
A 1个 B 2个 C 3个 D 4个
6、生物质能是绿色植物通过叶绿素将太阳能固化为化学能而贮存在生物质内部的能量。一直是人类赖以生存的重要能源,江苏是全国以试验性利用生物质能最多的省份。下列有关说法不正确的是
A.农村通过杂草和动物的粪便发酵制沼气,沼气的主要成分是甲烷
B.苏北五市推广使用乙醇汽油,乙醇可由富含淀粉的谷物发酵产生
C.用油料作物生产的生物柴油成分与从石油中提取的柴油成分相同
D.开发生物质能有利于环境保护和经济可持续发展
7、绿色化学己成为当前化学研究的热点和前沿,旨在从源头上消除污染,实现经济和社会可持续发展。而常温离子液体(ionic liquid)(也有称常温熔融盐)以其优异的理化特性最有可能使上述理想变为现实。1914年报道的第一种离子液体硝酸乙基铵〔(C2H5NH3)NO3〕离子液体其熔点为12℃。已知C2H5NH2结合质子的能力比NH3略强,下列有关硝酸乙基铵的说法正确的是
A.离子液体可以作为电池的电解质 B.硝酸乙基铵水溶液呈碱性
C.硝酸乙基铵水解的离子方程式或表示为:C2H5NH3++H2O=C2H5NH2+H3O+
D.相同温度下,相同物质的量浓度的硝酸乙基铵溶液和硝酸铵溶液前者的pH值小
8、下列实验方案设计正确的是
A、分解高锰酸钾制氧气后,残留在试管内壁上的黑色物质可用稀盐酸洗涤
B、失去标签的硝酸银溶液、稀盐酸、氢氧化钠溶液、氯化铝溶液可选用碳酸铵溶液作鉴别试剂
C、用铜丝代替铂丝做焰色反应
D、在裂化汽油中加入酸性高锰酸钾、振荡后若紫色褪去即可证明其中含甲苯等苯的同系物
二、选择题(本题包括12小题,每小题4分,共48分。每小题有一个或两个选项符合题意。
![]() 9、某温度下,反应2NO2 N2O4
;ΔH<0.在密闭容器中达到平衡.平衡是改变外界条件,使反应再次平衡.新平衡时,c(NO2)/C(N2O4)与原平衡相比变小了,则改变的条件可能有
9、某温度下,反应2NO2 N2O4
;ΔH<0.在密闭容器中达到平衡.平衡是改变外界条件,使反应再次平衡.新平衡时,c(NO2)/C(N2O4)与原平衡相比变小了,则改变的条件可能有
A.保持容器容积和温度不变,向容器中补充NO2
B.保持容器容积和温度不变,向容器中补充N2O4
C.保持容器温度和压强不变,向容器中补充N2
D.保持容器温度和压强不变,向容器中补充NO2
10、最新研究表明生命起源于火山爆发,是因为火山爆发产生的气体中含有1%的羰基硫(COS),已知羰基硫分子中所有原子均满足8电子结构,结合周期表知识,有关说法正确的是
A、羰基硫的属于非极性分子
B、羰基硫沸点比CO2低
C、羰基硫的电子式为:
D、羰基硫分子中三个原子不可能处于同一直线上
11、核磁共振谱是测定有机物分子结构最有用的工具之一。瑞士科学家维特里希等三人即是利用核磁共振技术测定生物大分子的三维结构而获得2002年诺贝尔化学奖。在有机物分子中,不同位置的氢原子在质子核磁共振谱(PMR)中给出的峰值(信号)也不同,根据峰(信号)可以确定有机物分子中氢原子的种类和数目。例如:乙醛的结构式为:
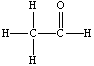 ,其PMR谱中有2个信号峰,其强度之比为3∶1。
,其PMR谱中有2个信号峰,其强度之比为3∶1。
下列有机物分子中,在质子核磁共振谱中只给出一种峰(信号)的是( )
A.CH3-CH3 B.CH3COOH C.CH3COOCH3 D.CH3COCH3
12、用石墨电极电解一定量的某电解质溶液,一定时间后,在阳极上得到标准状况下的某气体3.36L,阴极上得到某固体单质质量为2.7克,该电解质溶液可能为
A.Mg(NO3)2 B.Al(NO3)3 C.Cu(NO3)2 D.AgNO3
13、有一定质量的KNO3样品,在10℃下加蒸馏水使之充分溶解,残留固体的质量为250g。该实验在40℃下进行时,残留固体质量为120g,70℃时为20g。已知KNO3在不同温度下的溶解度:
| 温度 | 10℃ | 40℃ | 55℃ | 70℃ |
| 溶解度 | 20g | 65g | 100g | 140g |
下列对该样品的推断正确的是
A. 样品为纯净物
B.样品中混有不溶于水的杂质
C.样品中混有溶解度较大的杂质
D.当温度在55℃左右时KNO3完全溶解
14、某研究性学习小组为了探索镁粉与溴水反应的机理,做了如下四组实验:①将镁粉投入冷水中,未见任何现象;②将镁粉放入溴水中,观察到只是开始时产生极少量的气泡,但溴水的颜色逐渐褪色;③将镁粉放入液溴中.未观察到任何明显现象;④向含足量镁粉的液溴中滴加几滴水,观察到溴的红棕色很快褪去。则下列关于镁与溴水的反应机理的论述中正确的是
A、镁粉只能直接与溴水中的溴反应
B、水是镁粉与溴发生反应的催化剂
C、产生极少量的气泡是由于镁粉与水反应得到
D、镁粉与溴水中的酸发生反应,导致平衡移动使溴水褪色
15、NH3、H2S等是极性键构成的极性分子,CO2、BF3、CCl4等是极性键构成的非极性分子。根据上述事实,通过比较归纳可推出ABn型分子是非极性分子的经验规律是
A、分子中不含有H原子的分子是非极性分子
B、在ABn分子中A原子的所有价电子都参与成键的是非极性分子
C、ABn分子中每个共价键的键长都相等的分子是非极性分子
D、在ABn分子中A的原子量小于B的原子量时为非极性分子
16、将甲、乙两种金属的性质相比较,已知①甲跟H2O反应比乙与H2O反应剧烈;②甲单质能从乙的盐溶液中置换出单质乙;③甲的最高价氧化物的水化物碱性比乙的最高价氧化物的水化物碱性强;④与某金属反应时甲原子得电子数目比乙的多;⑤甲单质的熔、沸点比乙的低。能说明甲的金属性比乙强的是
A.①④ B.③⑤ C.①②③ D.①②③④⑤
17、室温下,下列混合溶液中,各离子浓度的关系正确的是
A.pH=12的氨水溶液与pH=2的盐酸溶液等体积混合
c(NH4+)>c(Cl-)>c(OH-)>c(H+)
B.浓度均为0.1mol·L-1的硫酸氢铵溶液与氢氧化钠溶液等体积混合
c(Na+)>c(SO42-)>c(NH4+)>c(H+)>c(OH-)
C.浓度均为0.1mol·L-1的小苏打溶液与烧碱溶液等体积混合
c(Na+)+c(H+)=2c(CO32-)+c(OH-)
D.浓度均为0.1mol·L-1的醋酸溶液与氢氧化钠溶液等体积混合
c(Na+)=c(CH3COO-)>c(OH-)=c(H+)
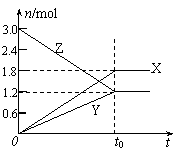 18、在一定温度下,将等量的气体分别通入起始体积相同的密闭容器Ⅰ和Ⅱ中,使其发生反应,t0时容器Ⅰ中达到化学平衡,X、Y、Z的物质的量的变化如图所示。则下列有关推断正确的是
18、在一定温度下,将等量的气体分别通入起始体积相同的密闭容器Ⅰ和Ⅱ中,使其发生反应,t0时容器Ⅰ中达到化学平衡,X、Y、Z的物质的量的变化如图所示。则下列有关推断正确的是

![]() A.该反应的化学方程式为:3X+2Y 2Z
A.该反应的化学方程式为:3X+2Y 2Z
B.若两容器中均达到平衡时,两容器的体积V(Ⅰ)<V(Ⅱ),则容器Ⅱ达到平衡所需时间大于t0
C.若两容器中均达到平衡时,两容器中Z的物质的量分数相同,则Y为固态或液态
 D.若达平衡后,对容器Ⅱ升高温度时其体积增大,说明Z发生的反应为吸热反应
D.若达平衡后,对容器Ⅱ升高温度时其体积增大,说明Z发生的反应为吸热反应
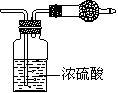
19、某无色气体可能由O2、CO2、HCl、NH3、NO、Br2中的一种或几种组成,通过图中洗气瓶后气体体积减少,通过干燥管后气体呈红棕色,则下列推断正确的是
A.干燥管内固体为碱石灰 B.原气体中一定有NO和O2
C.原气体中一定有NH3、NO、CO2 D.原气体中一定没有HCl、Br2
20、用已知浓度的NaOH测定未知浓度的盐酸溶液的物质的量浓度,进行酸碱中和滴定时,无论是酸往碱中滴还是碱往酸中滴,下列操作都会使测定结果偏高的是(锥形瓶中溶液用滴定管量取)
A.酸式滴定管未用标准盐酸润洗 B.碱式滴定管未用待测碱液润洗
C.滴定过程中不慎有液体溅出 D.滴定前仰视读数,滴定后读数正确