高三化学镁铝铁单元测试题
时间120分钟 满分150分
有关原子量:Na:23 Mg:24 Al:27 Si:28 Ca:40 Fe:56 Cu:64 O:16
一、选择题(本题包括10小题,每小题3分,共30分。每小题只有一个选项符合题意。)
1. 下列各组物质,前者是纯净物,后者是混和物的有
A.光卤石和芒硝 B.明矾和铝热剂
C.过磷酸钙和漂白粉 D.硫酸镁晶体和胆矾
![]()
![]() 2. 从海水中提取镁的工艺流程大体上为
2. 从海水中提取镁的工艺流程大体上为
3. 1 L水中溶有Mg(HCO3)2和CaCl2的浓度分别为b mol/L和2b mol/L,请在下列试剂中选用最合适的一种试剂把溶液中的Mg2+、Ca2+去掉
A.NaHCO3 B.Na2CO3 C.NaOH D.Ca(OH) 2
4. “混盐”是指一种金属离子与多种酸根离子构成的盐,如氯化硝酸钙[Ca(NO3)Cl]就是一种混盐。“复盐 ”是指含有多种简单阳离子和一种酸根阴离子的盐如KAl(SO4)2,下列各化合物中属于混盐的是
A.CaOCl2 B.(NH4)2Fe(SO4)2 C.BiONO3 D.K3[Fe(CN)6]
5. 向100 mL 0.25 mol·L-1的AlCl3溶液中加入金属钠完全反应,恰好生成只含NaCl和NaAlO2的澄清溶液,则加入金属钠的质量是
A.3.45 g B.2.3 g
C.1.15 g D.0.575 g
6.下列各组中的两种溶液,不用其它试剂就可以鉴别开的是
①H3PO4,Ba(OH)2 ②FeCl3,NaOH ③NaOH,AlCl3 ④NaAlO2,HCl ⑤AgNO3,氨水
A.全部 B. ②③④ C. ②③ D. ③④⑤
7. 在下列操作过程中只有适合离子方程式Al3++3AlO2-+6H2O = 4Al(OH)4↓的反应发生的是
A.向铝盐溶液中不断滴加NaOH溶液 B.向NaOH溶液中不断滴加铝盐溶液
C.向铝盐溶液中不断滴加小苏打溶液 D.向铝盐溶液中不断滴加NaAlO2溶液
![]()
 8.以下各组均有三种溶液,这三种溶液中所含溶质的物质的量均相等,将它们充分混合后不会产生沉淀的是
8.以下各组均有三种溶液,这三种溶液中所含溶质的物质的量均相等,将它们充分混合后不会产生沉淀的是
A.AlCl3,Ba(OH)2,HCl B.BaCl2,Na2CO3,NaCl
C.MgCl2,NaOH,HNO3 D.NaAlO2,NaOH,H2SO4
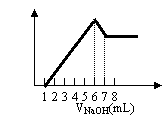
9.把镁铝合金用稀硫酸溶解,加入氢氧化钠溶液的体积
与生成沉淀的质量关系如右图,则合金中镁和铝的质量比
是
A.2∶3 B.8∶9 C.4∶3 D.4∶9
10.欲使CaCl2与盐酸的混合溶液中和至中性且得到CaCl2溶液,在不用指示剂的情况下,最好选用的物质是
A.氨水 B.碳酸钠 C. CaCO3 D.氧化钙
二、选择题(本题包括10小题,每小题4分,共40分。每题有一个或两个选项符合题意。)
![]()
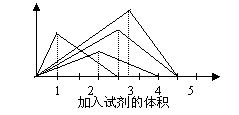 11.右图纵坐标表示沉淀的质量,横坐标表示所加试剂的体积,请选出有对应的曲线变化关系的实验项
11.右图纵坐标表示沉淀的质量,横坐标表示所加试剂的体积,请选出有对应的曲线变化关系的实验项
A.往Ba(OH)2溶液中逐滴加入磷酸溶液
B.往澄清石灰水中逐渐通入CO2气体
C.往AlCl3溶液中逐NaOH溶液
D.往NaAlO2溶液中逐滴加入盐酸溶液
12.在托盘天平两端的烧杯中加入同浓度同体积的足量盐酸,当向两个烧杯中分别加入0.1mol两种金属充分反应后,而在某一端要再放一个0.2克砝码,天平才能平衡,则这两种金属是
A.Mg和Al B.Al和Fe C.Fe和Cu D.Na和Mg
13.向20mL2mol/LAlCl3溶液中加入30mLNaOH溶液,充分反应后得到0.78g白色沉淀,则NaOH溶液的物质的量浓度为
A.1 mol/L B. 2mol/L C. 5mol/L D. 8mol/L
14.在溶液中可以大量共存,加过量稀硫酸后有沉淀产生,同时有气体放出的离子组是
A.HCO3--、Na+、Cl-、Ba2+ B. AlO2--、S2--、Na+、K+
C.SiO32-、CO32-、K+、Na+ D. Ba2+、Al3+、NO3-、Cl-
15. 在某稀溶液中含1 mol KNO3和4mol H2SO4,向其中加入1.5mol Cu粉,充分反应后产生的气体在标准状况下的体积为
A. 11.2L B. 22.4 L C. 33.6L D. 22.4L~33.6L 之间
16. 某稀硝酸能与5.4g铝恰好反应,当这份酸在与铁反应时,最多消耗铁的量为
A. 16.8g B. 0.3mol C. 11.2g D. 0.2mol
17. 向一定量的Fe、FeO、Fe2O3的混合物中,加入100mL 1mol/L的盐酸,恰好使混合物完全溶解,放出224mL(S、T、P)的气体。所得溶液中加入KSCN溶液无血红色出现,混合物中铁元素的质量分数为
A. 68.6% B. 77.8% C. 81.4% D. 无法计算
18. 在我国近年来报道的高温超导体中,铊(Tl)是组成成分之一。已知铊和铝是同族元素,关于铊的性质的推断可能错误的是
A.是银白色的软质金属
B. 能生成+3价的离子化合物
C.与硝酸作用能放出氢气并生成硝酸盐
D.铊的密度小于铝
19. 下列反应,最终有沉淀生成的是
A.向石灰水中通入过量的CO2
B.向NaCl饱和溶液中通入氨气及过量的CO2
C.向氯化钙溶液中通入过量的CO2
D.向硅酸钠溶液中通入过量的CO2
20.所谓合金,就是不同种金属(也包括一些非金属)在熔化状态下形成的一种熔合物,根据下列四种金属的熔沸点:
| Na | Cu | Al | Fe | |
| 熔点(0C) | 97.5 | 1083 | 660 | 1535 |
| 沸点(0C) | 883 | 2595 | 2200 | 3000 |
其中不能形成合金的是
A.Cu和Al B.Fe和Cu C.Fe和Na D.Al和Na
三、填空题(共3小题,28分)
21.(6分)有一包固体粉末可能含有Cu2+、Al3+、Mg2+、Cl- 、SO42-、CO32-中的若干种,现进行以下实验:①取少量固体,加入稀硝酸搅拌,固体全部溶解,没有气体放出,②向①溶液中加入Ba(NO3)2溶液,无沉淀生成,再滴入AgNO3溶液,有白色沉淀生成 。③再取少量固体加入适量蒸馏水,搅拌后,固体全部溶解,得到无色透明溶液。④向③的溶液中加入氨水,使溶液呈碱性,有沉淀生成,过滤。向过滤所得沉淀中加入过量的氢氧化钠溶液,沉淀部分溶解。这包固体粉末中一定不含有的离子是______________,肯定含有的离子是__________________,这包固体粉末的组成物质是___________________。
22.(10分)把含有Ca(HCO3)2和Mg(HCO3)2的硬水加热煮沸,生成沉淀为 ,如向这种硬水中加入石灰,使其硬度降低,其离子方程式为________________,____________;如若使用磺化煤,其反应式为___________,__________ ;
23.(12分)某铝合金中含有合金元素镁、铜、硅,为了测定该合金中铝的含量,设计如下实验方案,请回答有关问题:
(1)称取样品a g,称量时应该使用的仪器名称是_________。
(2)将样品溶于足量的稀盐酸,过滤,溶液中主要含有________,滤渣中含有_______。
(3)滤液中加入过量的NaOH溶液,过滤。所得滤渣的化学式为________。
(4)往步骤(3)的滤液中通入足量的CO2气体,过滤。反应的离子方程式为_____ 。
(5)步骤(4)过滤所得的滤渣用蒸馏水洗涤3次,烘干后高温灼烧至质量不再减轻为止,称得其质量为b g,则原样品中铝的质量分数为_________(用a、b表示)。
四、实验题(共3小题,36分)
24.(12分)无水氯化铝是白色晶体,易吸收水分,在178℃升华。装有无水氯化铝的试剂瓶久置潮湿的空气中会自动爆炸并产生大量白雾。氯化铝常作为有机合成和石油工业的催化剂,并用于处理润滑油等。工业上由金属铝和氯气作用或由无水氯化氢气流与熔融金属铝作用而制得。
某课外兴趣小组在实验室里通过下列装置制取少量纯净的无水氯化铝。
(1)A装置中发生的反应的化学方程式为:___________________________。
(2)在E处可收集到纯净的氯化铝,其原因是____________________。
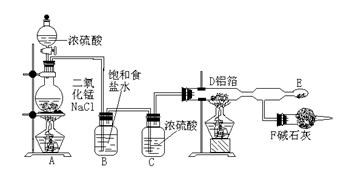 |
(3)从A装置导出的气体若不 经过 B 、C装置而直接进入 D管,将对实验产生的不良后果是:_______________________________________________________。
(4)F装置所起的作用是________________________________________ 。
(5)在D管内发生反应的化学方程式为:_______________________________。
(6)无水氯化铝在潮湿空气中会产生大量白雾,有关反应的化学方程式为:
________________________________________。
25.(12分)实验室临时需要用NaOH溶液和C02来制取纯Na2C03溶液。已知C02在通
入NaOH溶液过程中极易过量生成NaHC03,且无明显现象。实验室有下列试剂:①
未知浓度的NaOH;②37%的盐酸;③37%的硫酸;④14%的盐酸;⑤大理石
⑥K2C03固体;⑦Cu2(OH)2C03。
实验室有下列仪器:铁架台;启普发生器;量筒;烧杯;橡皮管;玻璃导管;分液漏斗。
| Na2C03 | NaHC03 | NaCl | Na2S04 | NaHS04 | NaOH |
| 15.9 | 8.4 | 35 | 35.5 | 20 | 40 |
(1)本实验选用的仪器,除启普发生器、橡皮管、玻璃导管外,还需要_________
(2)为保证制得的Na2C03溶液尽量纯,应选用的药品除①外,还需要 (填编号)。
(3)简要叙述直到制得纯Na2C03溶液的实验步骤(仪器安装可省略)。
① ;
② ;
③ 。
(4)根据给出的溶解度数据,若保证在配制过程中不析出晶体,所用NaOH溶液所含
NaOH的质量分数的最大值是 。
26.(12分)下图(左)是还原铁粉与水蒸气反应的实验装置,实验时,B中灰色
的铁粉变为黑色,且生成的黑色固体物质是一种可溶于稀盐酸的较复杂化合物。请
回答下列问题:
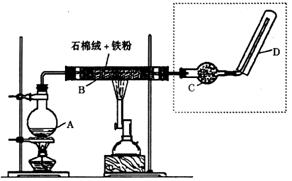
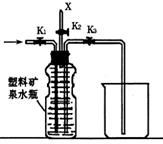
(1)B中发生反应的化学方程式为 。
(2)反应前A中投放碎瓷片的目的是 。
(3)某次实验后,取B中的固体物质少量,溶于足量稀盐酸,再滴加KSCN溶液。
溶液颜色无明显变化,试解释原因 。
(4)上图(左)中虚线部分,可以用右图所示装置代替,在X口点燃收集到的气
体即可检验H2的存在。实验开始时,打开K1、K2,关闭K3,使反应先进行一段时间
之后,必须进行 操作,方可关闭K2、打开K3,再收集气体。当收集到半
瓶气体时,停止加热,关闭K1,若要使H2顺利逸出而进行点燃实验,操作的方法
是 。
(5)替代装置未像原装置那样使用干燥管,同样顺利完成了实验,原因是 。
五、计算题(本题共2小题 16分)
27. (6分)将一定量的氧化铜加入到100.0ml2.5mol/L 的稀硫酸中,待其完全溶解后,再向蓝色溶液中加入19.6g铁粉,经搅拌、过滤、洗涤、干燥等操作,最后得到的固体质量为18.5g 。
①通过计算说明干燥后得到的固体是什么物质?
②求原氧化铜的质量
28.(10分)一块由Na、Al、Si组成的合金投入水中充分反应后得到一澄清透明溶液A,向其中逐滴加入1mol/L的盐酸,当加入100mL时尚无明显变化发生,但若继续滴入此盐酸,溶液中开始出现沉淀,共向该溶液A中滴入700mL该盐酸时得到了质量不再变化的沉淀(即如果再加入酸,沉淀质量不增加也不减少),过滤、洗涤并灼烧沉淀,最终称得质量为6g。求合金的总质量为多少克?
姓名___ , 班级___ , 分数___ ,
答 题 卡
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 |
21.(6分)一定不含有的离子是 ,
肯定含有的离子是 ,
可能是 。
22.(10分)为 ,
离子方程式为 , ;
反应式为 , ;
23.(12分)(1)仪器名称是 。
(2)溶液中主要含有 ,滤渣中含有 。
(3)滤渣的化学式为 。
(4)离子方程式为_____ 。
(5)质量分数为 (用a、b表示)。
24.(12分)(1)化学方程式为: 。
(2)原因是 。
(3)不良后果是 。
(4)作用是 。
(5)化学方程式为: 。
(6)化学方程式为: 。
25.(12分) (1)还需要 。
(2)还需要 (填编号)。
(3)简要叙述直到制得纯Na2C03溶液的实验步骤(仪器安装可省略)。
① ;
② ;
③ 。
(4)最大值是 。
26.(12分)(1)化学方程式为 。
(2)目的是 。
(3)原因 。
(4)必须进行……… ,
方法是 。
(5)原因是 。
27. (6分) ①通过计算说明干燥后得到的固体是什么物质?
②求原氧化铜的质量
28.(10分)
镁 铝 铁单元测试题参考答案
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| B | B | C | A | B | A | D | C | B | C |
| 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 |
| BD | A | AC | AC | B | AB | C | CD | BD | C |
21. Cu2+、SO42-、CO32-; Al3+、Mg2+、Cl- ;MgCl2 AlCl3
22. Mg(OH)2 CaCO3 Ca2+ + HCO3- + OH- = CaCO3↓+ H2O
2Ca2+ + 2HCO3- + 4OH- =2 CaCO3 ↓ + 2H2O+ Mg(OH)2↓
2NaR + Ca2+ = 2Na+ + CaR2 2NaR + Mg2+ = 2Na+ + MgR2
23.(1)托盘天平(2分) (2)MgCl2、AlCl3 Cu、Si(每空各2分)
(3)Mg(OH)2(2分) (4)AlO2-+CO2+2H2O====Al(OH)3↓+HCO3-(2分)
(5)9b / 17a ×100%(2分)
24.(1)MnO2+2H2SO4+4NaCl=2Na2SO4+Cl2↑+MnCl2 +2H2O
(2)AlCl3易升华,遇冷AlCl3蒸气可变成AlCl3固体
(3)使得到的AlCl3量少或不纯,甚至爆炸。
(4)①防止空气中的水进入;②吸收Cl2;③平衡内外压。
(5)2Al + 3Cl2 == 2AlCl3
(6)AlCl3 + 3H2O == Al(OH)3 + 3HCl
25. (1)烧杯 量筒 (2)④⑤
(3)① 量取一定量的NaOH溶液,分成两等份 ② 制取CO2,向其中一份NaOH溶液中通入过量的CO2气体 ③将两份溶液混合摇匀。
(4)设NaOH溶液的质量为100g,NaOH的质量为xg,要NaHCO3不析出
CO2 + NaOH = NaHCO3
44 40 84
44x/40 x 84x/40
84x/40 / (100 + 44x/40) = 8.4 / 108.4
x = 3.85g 即NaOH溶液的质量分数最大值为3.85%
26. (1)3Fe+4H2O = Fe3O4+4H2↑有条件 (2)防止暴沸
(3)过量的铁与生成的Fe3+反应生成Fe2+,故加入KSCN溶液后颜色无明显变化
(4)验纯 关闭K3、打开K2在X处点燃氢气,挤压矿泉水瓶
(5)氢气是否干燥并不影响该实验
27.(3分)①n(Fe)=0.35mol ,n(H2SO4)= 0.25mol , 铁粉充分反应生成FeSO40.25mol,说明反应中铁粉有剩余,所得固体为铜和铁的混合物。
(3分)② 16.1g
28. n(Si)= n(SiO2)= 0.1mol 2分
设钠有xmol,铝有ymol 由Na守恒:x = y+0.2+0.1 2分
Cl-守恒 x+3y=0.7 2分
x=0.4 1分 y=0.1 1分故总质量为14.7g 2分