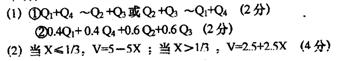高三化学限时练习题1
化学限时练习一
班级_______姓名________________学号________得分____________
一.选择题(每小题1—2个正确答案。每小题5分,共50分)
1.关于反应K35ClO3+6H37Cl=KCl+3Cl2↑+3H2O的有关叙述中,正确的是( )
A. KCl中含有35Cl B. 生成物Cl2的相对分子质量为73.3
C.该反应转移的电子数为6e- D. 氧化剂和还原剂的物质的量之比为1:6
2.0.2 mol KMnO4在一定温度下加热生成a mol O2,将剩余的固体与足量浓盐酸混合加热又生成b mol Cl2,此时锰元素均以Mn2+的形式存在。若a-b=m,则m的值可能是( )
A.0.35 B.0.45 C.0.55 D.0.60
3.下列溶液中: ①石灰水 ②H2S溶液 ③KMnO4溶液 ④溴水 ⑤酸化的Ba(NO3)2溶液 ⑥品红溶液,不能区别SO2和CO2气体的是 ( )
A.只有① B.①③ C. ①②③⑤ D.②③④⑤
4.赤铜矿的主要成分是Cu2O,辉铜矿的主要成分是Cu2S,将赤铜矿与辉铜矿混合加热发生以下反应:Cu2S+2Cu2O==6Cu+SO2↑,关于该反应的说法中,正确的是( )
A.该反应的氧化剂只有Cu2O B.Cu2S在反应中既是氧化剂,又是还原剂
C.Cu既是氧化产物又是还原产物 D.每生成19.2gCu,反应中转移1.8mol电子
 5.2006年3月2日英国《泰晤士报》报道说,英国食品标准局在对英国与法国贩售的芬达汽水、美年达橙汁等230种软饮料检测,发现含有高量的致癌化学物质——苯,报道指出汽水中如果同时含有苯甲酸钠(防腐剂,C6H5COONa)与维生素C(抗氧化剂,结构式如图)可能会相互作用生成苯、苯与血癌(白血病)的形成也有密不可分的关系。下列说法一定不正确的是(
)
5.2006年3月2日英国《泰晤士报》报道说,英国食品标准局在对英国与法国贩售的芬达汽水、美年达橙汁等230种软饮料检测,发现含有高量的致癌化学物质——苯,报道指出汽水中如果同时含有苯甲酸钠(防腐剂,C6H5COONa)与维生素C(抗氧化剂,结构式如图)可能会相互作用生成苯、苯与血癌(白血病)的形成也有密不可分的关系。下列说法一定不正确的是(
)
A、苯是非极性分子
B、苯在一定条件下能发生取代反应和加成反应
C、维生素C在碱性溶液中能稳定存在
D、维生素C可溶于水
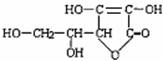
 6.桶烯(Barrelene)结构简式如右图所示,有关说法不正确的是( )
6.桶烯(Barrelene)结构简式如右图所示,有关说法不正确的是( )
A、桶烯分子中所有的原子在同一平面内
B、桶烯在一定条件下能发生加聚反应
C、桶烯与苯乙烯(C6H5CH=CH2)互为同分异构体
D、桶烯中的一个氢原子被氯原子取代,所得产物只有两种
7.断裂一个给定的键时所消耗的能量称为离解能,提供下列烷烃的C—H键的离解能:
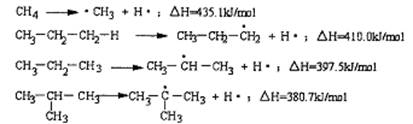
根据提供数据判断下列说法不正确的是( )
A、离解能愈小,C—H键易断裂,氢原子越易被取代
B、在光照条件下丙烷与氯气取代反应生成CH3CH2CH2Cl与CH3CHClCH3的物质的量之比为1:1
C、异丁烷与氯气发生取代反应,(CH3)3CCl占一氯代物的物质的量分数大于10%
D、C2H6中C—H的离解能介于410.0 kJ /mol~435.1kJ/mol
8.下列实验方案设计正确的是( )
A、分解高锰酸钾制氧气后,残留在试管内壁上的黑色物质可用稀盐酸洗涤
B、失去标签的硝酸银溶液、稀盐酸、氢氧化钠溶液、氯化铝溶液可选用碳酸铵溶液作鉴别试剂
C、用铜丝代替铂丝做焰色反应
D、在裂化汽油中加入酸性高锰酸钾、振荡后若紫色褪去即可证明其中含甲苯等苯的同系物
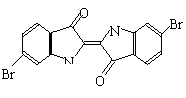 9.泰雅紫是古代地中海沿岸出产的一种贵重燃料,罗马帝王用法律规定,只有皇族与教主可穿这种紫色衣袍。当时人们是从小的紫蜗牛中提取它的,制备1.5g泰雅紫需要多达12000只紫蜗牛,现知其结构为如右图所示的含溴有机化合物,下列说法不正确的是( )
9.泰雅紫是古代地中海沿岸出产的一种贵重燃料,罗马帝王用法律规定,只有皇族与教主可穿这种紫色衣袍。当时人们是从小的紫蜗牛中提取它的,制备1.5g泰雅紫需要多达12000只紫蜗牛,现知其结构为如右图所示的含溴有机化合物,下列说法不正确的是( )
A、泰雅紫分子的分子式为:C16H8N2Br2O2
B、泰雅紫不存在同分异构体
C、泰雅紫属于烃的衍生物
D、检验泰雅紫中溴元素可直接加入硝酸银溶液,看是否有浅黄色沉淀
10.“酸碱质子理论”认为凡是能够给出质子(H+)的分子或离子都是酸,凡是能够接受质子的分子或离子都是碱,物质酸性(碱性)的强弱取决于分子或离子给出(接受)质子能力的大小。按照“酸碱质子理论”,下列说法正确的是( )
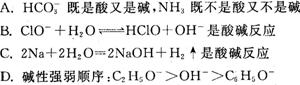
二.实验题
11. (14分)为了证明在实验室制备Cl2的过程中会有水蒸气和HCl挥发出来,甲同学设计了如下图所示的实验装置,按要求回答问题。
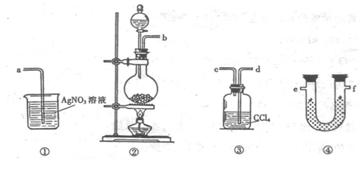
 ⑴请根据甲同学的意图,连接相应的装置,接口顺序:
⑴请根据甲同学的意图,连接相应的装置,接口顺序:
b接 , 接 , 接a。
⑵U形管中所盛试剂的化学式为 。
⑶装置③中CCl4的作用是 。
⑷乙同学认为甲同学实验有缺陷,不能证明最终通入AgNO3溶液中的气体只有一种。为了确保实验结论的可靠性,证明最终通入AgNO3溶液的气体只有一种,乙同学提出在某两个装置之间再加装置⑤。你认为装置⑤应加在 之间(填装置序号)。瓶中可以放入 。
⑸丙同学看到甲同学设计的装置后提出无需多加装置,只需将原来烧杯中的AgNO3溶液换成其他溶液。你认为可将溶液换成 ,如果观察到
______________________________的现象,则证明制Cl2时有HCl挥发出来。
12.(8分)根据初中化学知识,硫酸铜溶液与氢氧化钠溶液反应可得到蓝色沉淀,进一步将沉淀加热可生成黑色物质。小明做了这个实验:他在试管中倒入2mLCuSO4溶液,再加入一定量的氢氧化钠溶液,结果得到的沉淀并不是蓝色的,而是浅绿色的;将此浊液加热直至沸腾,观察不到有黑色CuO产生的现象。这是为什么呢?小明通过查找资料得知,该浅绿色沉淀物可能是溶解度极小的碱式硫酸铜,其化学式为Cu(OH)6SO4。
(1)请帮小明写出生成浅绿色沉淀的有关反应的化学方程式
(2)请帮小明设计—个实验,证明该浅绿色沉淀中含有硫酸根离子
________________________________________
__________________________________________________________________________。
三.填空题
13.(10分)氰(CN)2的结构简式为N≡C—C≡N,其化学性质与卤素(X2)很相似,化学上称之为拟卤素。(CN)2和水反应可生成HCN和HCNO;(CN)2的氧化性比Br2弱,比I2强。
(1)下列有关反应的化学方程式不正确的是 (填选项标号)。
A.(CN)2和NaOH溶液反应:(CN)2+2NaOH====NaCN+NaCNO+H2O
B.MnO2和HCN反应:MnO2+4HCN △ Mn(CN)2+(CN)2↑+2H2O
C.向KCN溶液中加入碘水:I2+2KCN====2KI+(CN)2
D.在NaBr和KCN混合溶液中通入少量Cl2:Cl2+2NaBr====2NaCl+Br2
(2)HCN的电子式为 。
(3)处理含CN-(其中C为+2价)的工业废水常用ClO-氧化,生成的CNO-(其中C为+4价)元素,反应的离子方程式如下:
aCN-+bClO-+2cOH-====dCNO-+eN2↑+fCO32-+bCl-+cH2O
上述化学方程式可能的配平系数有多组,请回答:
①方程式中e : f的值为 (填选项标号)。
A.1 B.![]() C.2 D.不能确定
C.2 D.不能确定
②若d=e=1, 则b= 。
14.(8分)已知醇、醛在一定条件下能发生缩合反应,示例如下:
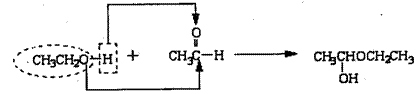 |
已知:
①1827年人们就发现有机物A,它的分子式为C13H18O7,与一分子水作用,水解生成B和C;
②B能发生银镜反应,B也可由淀粉水解得到,B的分子式为C6H12O6;
③C遇氯化铁溶液能发生显色反应,1molC与足量钠反应可生成1molH2;
④C在适当的条件下用适当氧化剂演化,可得D,D的分子式为C7H6O3,相对分子质量D比C大14;
⑤D有两个取代基,但不是间位,它与Br2在催化剂作用下发生一溴取代,产物有四种,D能与碳酸氢钠溶液反应;
⑥D与乙酸酐[(CH3CO)2O]反应,可得到常见药物E和乙酸,E能与碳酸氢钠反应放出二氧化碳。
试回答下列问题:
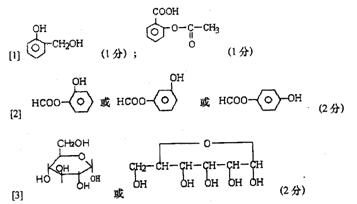
⑴写出结构简式:C E
⑵写出与D互为同分异构体,含有苯环且含有酯结构的结构简式: (只需写一种);
⑶B通常以六元环状结构存在,写出B的环状结构简式: 。
四.计算题
15.(10分)丁烷在一定条件下可以按两种方式裂化:C4H10→C2H6+C2H4;C4H10→CH4+C3H6,现对发生裂化反应后的裂化气(不含丁烷)进行研究。
⑴探究裂化气的热值: 已知:
| 气体 | CH4 | C2H6 | C2H4 | C3H6 |
| 燃烧热(kJ/mol) | Q1 | Q2 | Q3 | Q4 |
①若44.8L(标准状况)裂化气充分燃烧放出热量QkJ,则Q的取值范围介于:
~ (用Q1、Q2、Q3、Q4表示,下同)。
②若将44.8L气体(标准状况)缓缓通过盛有足量溴的四氯化碳溶液中,发现洗气瓶增重33.6g,则44.8L(标准状况)气体完全燃烧放出的热量Q= kJ。
⑵测量与H2加成反应后气体总体积与氢气的体积分数关系:
另取裂化气与H2混合得5L混合气体,已知其中H2的体积分数ψ(H2)=X,在一定条件下使其充分反应,反应后气体的体积为VL。请列出V与X的函数关系式。
参考答案
1、B 2、AB 3、A 4、B 5、C 6、A 7、B 8、B 9、BD 10、BD
11. ⑴ b接e,f接d,c接a。 ⑵CuSO 4 ⑶吸收Cl2
(4)①③;湿润的KI淀粉试纸(或润湿的有色布条,或品红溶液)
(5)紫色石蕊试液(答案合理给分);紫色石蕊试液变红而不褪色。
12.(1)4CuSO4+6NaOH===Cu4(OH)6SO4↓+3Na2SO4(2分)
(2)将浅绿色的浊液过滤,并把得到的绿色沉淀用蒸馏水多次洗涤,至洗涤液中用BaCl2溶液检验不出SO![]() 后(2分),用足量稀盐酸溶解绿色沉淀,此时再用BaCl2溶液检验,溶液中有大量白色沉淀生成,表示浅绿色沉淀中有SO
后(2分),用足量稀盐酸溶解绿色沉淀,此时再用BaCl2溶液检验,溶液中有大量白色沉淀生成,表示浅绿色沉淀中有SO![]() (2分)
(2分)
13. (1)CD;⑵ ⑶①B ;②6
14.
15.