高三化学限时练习题
化学限时练习二
班级_________姓名_________学号________得分__________
一.选择题(每小题1—2个正确答案。每小题5分,共50分)
( )1.用NA表示阿伏加德罗常数的值,下列说法中正确的是:
A.1 mol苯分子中含有的碳碳双键数为3NA
B.标准状况下,2.24 L乙醛完全燃烧所得CO2分子数为0.2 NA
C.常温常压下,16 g CH4分子中共价键总数为4NA
D.28g乙烯和聚乙烯的混合物完全燃烧所得CO2分子数为2 NA
( )2.关于有机物C3H6O3的下列叙述一定正确的是:
A.若能与金属钠和碳酸氢钠反应,则其结构中同时含有-OH和—COOH
B.若该物质中含有两个—CH3,则它可以是碳酸酯
C.若该物质中所有原子所处的化学环境相同,则其结构中只有C—O键和C—H键,且为六元环结构
D.若1mol C3H6O3与足量钠反应只产生1mol氢气,说明一分子C3H6O3中含有2个—OH和一个—CHO
( )3.制备氰氨基化钙的化学方程式为CaCO3+2HCN=CaCN2+CO↑+H2↑+CO2↑,在反应中:
A.氢元素被氧化,碳元素被还原 B.HCN既是氧化剂又是还原剂
C.CaCN2是氧化产物,H2为还原产物 D.CO是氧化产物,H2为还原产物
![]()
![]() (
)4.有一未完成的离子方程式:
+XO3—+6H+=3X2+3H2O,据此判断:X元素的最高化合价为:
(
)4.有一未完成的离子方程式:
+XO3—+6H+=3X2+3H2O,据此判断:X元素的最高化合价为:
A.+7 B.+5 C.+4 D.+1
( )5.苹果汁是人们喜爱的饮料,由于其中含有亚铁离子,在榨取后不久往往会变为棕黄色,生产上常在其中加入维生素C以防止其变色,这是利用了维生素C的:
![]() A.氧化性 B.还原性 C.酸性 D.碱性
A.氧化性 B.还原性 C.酸性 D.碱性
( )6.在SiO2+3C SiC+2CO↑的反应中,氧化剂和还原剂的质量比为:
A.5:3 B.1:2 C.2:1 D.7:6
( )7.能正确表示下列反应的离子方程式是:
A.碳酸氢铵溶液中加入NaOH溶液共热
NH4++OH- ![]() NH3
↑+H2O
NH3
↑+H2O
B.用碳酸钠溶液吸收少量二氧化硫 2CO32-+SO2+H2O ==2HCO3-+SO32-
C.FeBr2溶液中加入过量的氯水 2Fe2++2Br-+2Cl2 ==Br2+4Cl-+2Fe3+
D.硫酸镁溶液和氢氧化钡溶液反应 SO42-+Ba2+ ==BaSO4↓
( )8.在c(S2-)=0.1mol·L-1的溶液中,可以大量共存的离子组是:
A.Al3+、NO3-、NH4+、Cl- B.Na+、SO42-、K+、CH3COO-
C.AlO2-、K+、OH-、NO3- D.Na+、NO3-、K+、ClO-
( )9.下列离子方程式书写正确的是:
A.向CaCl2溶液中通入少量CO2气体:Ca2++CO2+H2O===CaCO3↓+2H+
B.制备氢氧化铁胶体 Fe3++3H2O![]() Fe(OH)3(胶体)+3H+
Fe(OH)3(胶体)+3H+
C.NaHS水解:HS-+H2O![]() H3O++S2-
H3O++S2-
D.饱和石灰水跟盐酸反应:H++OH-=====H2O
( )10.下列离子方程式正确的是:
A.向苯酚钠溶液中通少量的CO2:2C6H5O-+CO2+H2O→2C6H5OH+CO32-
B.Ca(HCO3)2溶液中加入过量澄清石灰水:Ca2++HCO3-+OH-=CaCO3↓+H2O
C.KI溶液和KIO3溶液混合并加入稀硫酸:IO3-+I-+6H+ = I2+3H2O
D.向KHSO4溶液中滴人Ba(OH)2溶液使pH=7:
SO42-+H++Ba2++OH-=BaSO4↓+H2O
二.实验题
11.利用图示装置,选用适当试剂完成下述实验或得出相应实验结论:
(1)验证氧化性:![]()
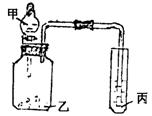
所用试剂:甲____________,乙_____________,丙_____________
(2)所用试剂:甲:盐酸;乙:石灰石;丙:苯酚钠溶液
实验现象:丙中_______________________________________________,
实验结论:______________________________________________.
(3)请利用该装置自行设计一个实验,简述丙中实验现象及根据此现象所得出的实验结论:
所用试剂:甲___________;乙_________;丙_________.
丙中现象:____________________________________________________;
实验结论:____________________________________________________.
三.填空题
12.在含有n molCa(OH)2的澄清石灰水中, 加入含NaHCO3 x mol的碳酸氢钠溶液,写出下列情况下反应的离子方程式。
①当x≤n时:
②当x≥2n时:
 |
13.已知
又知卤代烃在碱性条件下易发生水解,但烯烃中双键在酸性条件下才能与水发生加成反应。
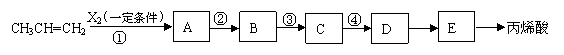 |
现用石油产品丙烯及必要的无机试剂合成丙烯酸,设计的合成流程如下:
回答下列问题:
(1)若反应①为取代反应,则反应②、④的化学方程式分别为:
②
④
(2)若反应①为化合反应,则反应②、④的化学方程式分别为:
②
④
四.计算题
14.配平下列反应方程式,并标出电子转移的方向和数目。
(1)(
)![]() ( )
( )![]() (
)
(
)![]() ( )
( )![]()
(2)如氨气和二氧化氮共1.5mol,且氧化产物比还原产物的质量多2.8克,则:二氧化氮物质的量为________________.
15.某有机物A可能属于烷烃、单烯烃、环烷烃、炔烃、二烯烃、芳香烃、饱和一元醇、饱和一元醛、饱和一元羧酸或酯。已知1molA含n mol碳原子,在恰好完全燃烧时消耗1.5 n mol氧气。
(1) A可能是 (填物质的类别,下同)。
(2) 4000C,101.3k Pa时,0.2 mol 该有机物A与0.6 mol 氧气在密闭容器中燃烧,恢复到常温、常压后气体的质量减少了10.8 g。求A的化学式。
附加题:已知在酸性条件下有以下反应关系:
①KBrO3能将KI氧化成I2或KIO3,其本身被还原为Br2;
②Br2能将I-氧化为I2;
③KIO3能将I-氧化为I2,也能将Br-氧化成Br2,其本身被还原为I2。
现向含有lmolKI的硫酸溶液中加入含a molKBrO3的溶液,a的取值不同,
所得产物也不同。
(1)试将讨论的结果填入表中:
| 编号 | a的取值范围 | 产物的化学式(或离子符号) |
| ① | I2 、、Br- | |
| ② | 1/6 < a < 1/5 | |
| ③ | I2、、IO3-、、Br2 | |
| ④ | a ≥ 6/5 |
(2)对表中③组:当n(I2) = n(IO3-)时,求a的值。
参考答案
1BC 2BC 3BC 4A 5B 6B 7B 8BC 9BD 10B
11.(1)浓盐酸![]() 、KBr溶液
、KBr溶液
(2)溶液变混浊 酸性:HCl>![]() >
>![]()
(3)水 ![]() 溴水 溴水褪色 乙炔能使溴水褪色(只要答案合理亦可)
溴水 溴水褪色 乙炔能使溴水褪色(只要答案合理亦可)
12.Ca2++HCO3-+OH-==CaCO3+H2O Ca2++2HCO3-+2OH-==CaCO3+CO32-+2H2O
13.(1) 
CH2==CHCH2Cl +H2O CH2=CH—CH2OH+HCl
(2) 略
14.(1)( 8 )![]() (6)
(6)![]() (7)
(7) ![]() (12 )
(12 )![]()
(2)二氧化氮物质的量为___0.6_mol_或_0.7_mol_.
15.(1)单烯烃或环烷烃或饱和一元醇
(2)①0.2 mol A中n(H2O)=10.8 g/18 g/mol==0.6 mol 每摩A中含有6 mol H
∴ A的化学式可能为C3H6 C2H6O
附加题:(1)
| 编号 | a的取值范围 | 产物的化学式(或离子符号) |
| ① | 0 < a ≤ 1/6 | I2 、、Br- |
| ② | 1/6 < a < 1/5 | I2 、Br2、、、 Br- |
| ③ | 1/5 ≤ a < 6/5 | I2、、IO3-、、Br2 |
| ④ | a ≥ 6/5 | IO3- 、Br2 |
(2) a = 8/15