高三化学限时练习题3
化学限时练习三
班级_________姓名_________学号________得分__________
一.选择题(每小题1—2个正确答案。每小题5分,共50分)
( )1.氯化碘(ICl)的性质类似卤素,有很强的化学活动性。ICl跟Zn、H2O的反应:①2ICl+2Zn=ZnCl2+ZnI2 ②ICl+H2O=HCl+HIO 下列叙述中正确的是
A.在反应①中,ZnI2既是氧化产物又是还原产物
B.在反应①中,ZnCl2既是氧化产物又是还原产物
C.在反应②中,ICl既是氧化剂又是还原剂
D.在反应②中,ICl既不是氧化剂,又不是还原剂
( )2.用硫酸酸化的三氧化铬(![]() ),遇酒精后,其颜色由红变为蓝绿色,用这种现象可测得司机是否酒后驾车.反应如下:
),遇酒精后,其颜色由红变为蓝绿色,用这种现象可测得司机是否酒后驾车.反应如下:
![]()
![]() ,在此反应中,还原剂和氧化剂的物质的量之比是
,在此反应中,还原剂和氧化剂的物质的量之比是
A.2∶3 B.3∶2 C.1∶1 D.3∶1
( )3.下列各组离子在相应的条件下一定能大量共存的是
A.在碱性溶液中:CO32—、K+、C1—、Na+
B.与铝粉反应放出氢气的无色溶液中:NO3—、Mg2+、Na+、SO42—
C.在c(H+)/c(OH—)==1×1013的溶液中:NH4+、Ca2+、C1—、K+
D.在中性溶液中:Fe3+、C1—、NO3—、A13+
( )4.下列离子方程式不正确的是
![]() A.碳酸钠溶液呈碱性:CO32-+H2O HCO3-+OH-
A.碳酸钠溶液呈碱性:CO32-+H2O HCO3-+OH-
B.将少量二氧化碳气体通入次氯酸钠溶液:SO2+2ClO-+H2O=SO32-+2HClO
C.氯化铝溶液中加入过量氨水:Al3++4NH3·H2O=AlO2-+4NH4+
D.氯气通入澄清石灰水中:Cl2+2OH-=Cl-+ClO-+H2O
( )5.可以鉴别甘油、乙醛、乙酸和甲酸四种无色水溶液的试剂是
A.新制Cu(OH)2悬浊液 B.FeCl3溶液
C.KMnO4溶液 D.浓溴水
( )6.一些烃的燃烧热(kJ/mol)如下表,下列表达正确的是
| 化合物 | 燃烧热/kJ/mol | 化合物 | 燃烧热/kJ/mol |
| 甲烷 | 891.0 | 正丁烷 | 2878.0 |
| 乙烷 | 1560.8 | 异丁烷 | 2869.6 |
| 丙烷 | 2221.5 | 2-甲基丁烷 | 3531.3 |
| 乙烯 | 1411.0 | 乙炔 | 1300.0 |
A.热稳定性:正丁烷>异丁烷
B.乙烷燃烧的热化学方程式为:
![]() C2H6(g)+ O2(g) 2CO2(g)+3H2O(l) ;ΔH=-1560.8 kJ/mol
C2H6(g)+ O2(g) 2CO2(g)+3H2O(l) ;ΔH=-1560.8 kJ/mol
C.等物质的量的乙烯和乙炔完全燃烧,乙烯放出的热量多,故用氧烯焰来切割或焊接金属
D.相同质量的烃,碳的质量分数越大,燃烧放出的热量越多
( )7.某金属硝酸盐在受热分解时生成了金属氧化物、二氧化氮与氧气,且产物中NO2与O2的体积比为6∶1(同温同压下测得),则该硝酸盐分解时金属化合价的变化情况是
A.升高 B.降低 C.不变 D.不能确定
( )8.最新研究表明生命起源于火山爆发,是因为火山爆发产生的气体中含有1%的羧基硫(COS),已知羧基硫分子中所有原子均满足八电子结构,结合周期表知识,有关说法正确的是
A.羰基硫的属于非极性分子 B.羰基硫的电子式为:
C.羰基硫沸点比CO2低 D.羰基硫分子中三个原子处于同一直线上
( )9.最新科技报道,美国夏威夷联合中心的科学家发现了新型氢粒子,这种新粒子是由3个氢原子核(只有质子)和2个电子构成,对于这种粒子,下列说法正确的是
A.这种粒子含有3个质子 B.它的组成可以表示为H3
C.这种粒子含有3个中子 D.是氢的一种新的同位素
( )10.法国里昂的科学家发现一种只由四个中子构成的粒子,这种粒子称为“四中子”,也有人称为“零号元素”。下列有关“四中子”粒子的说法错误的是
A.该粒子不显电性 B.该粒子质量数为4
C.该粒子质量比已发现的氢原子大 D.在周期表中与氢元素占同一位置
二.实验题
11. pH<7的溶液,中含有三种常见金属阳离子,用x溶液进行如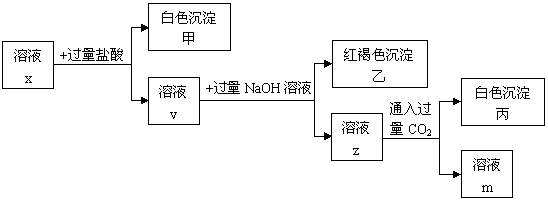 下实验:
下实验:
(1)根据有白色沉淀甲生成,判断x溶液中有 阳离子。
(2)根据有白色沉淀丙生成,判断x溶液中有 阳离子;由溶液z生成沉淀丙的离子方程式为 。
(3)x溶液中一定含有的阴离子是 。
(4)根据上述实验(填“能”或“不能”)确定x溶液中的第3种金属阳离子,理由是 。
三.填空题
12.在足量的稀氯化亚铁溶液中,加入1~2滴液溴,振荡后溶液变为黄色。
(1)甲同学认为这不是发生化学反应所致,使溶液变黄色的物质是: (填粒子的化学式,下同);乙同学认为这是发生化学反应所致,使溶液变黄色的物是
(2)现提供以下试剂:A.酸性高锰酸钾溶液 B.稀硝酸 C.四氯化碳 D.硫氰化钾溶液
请判断甲和乙中哪位同学的推断是正确的,并用合适的方法加以验证,写出选用的试剂(限上述提供的试剂)及实验中观察到的现象。
(3)若选用淀粉碘化钾溶液来判断哪位同学的推断是正确的,你认为是否可行? ,理由是:
13.短周期的四种元素X、Y、Z、W,原子系数依次增大,Z原子最外层电子数是X、Y、W三种原子的最外层电子数之和,Z与X、Y、W三种元素形成原子个数之比为1:1的化合物分别是A.B.C,其中化合物C在空气中容易变白,请回答:
(1)写出Z的原子结构示意图_____________________________________________。
(2)写出化合物YZ2电子式:______________________________________________,
写出化合物C的电子式:______________________________________________。
(3)写出化合物C在空气中变白的化学方程式:
____________________________________________________
四.计算题
14. ![]() 是近年来被科学家发现的一种高温超导材料,其中Y、Ba、O三种元素都有固定的化合价,分别为+3、+2、-2,而Cu是+2和+3的混合价态.现用碘量法测定:取一定质量的
是近年来被科学家发现的一种高温超导材料,其中Y、Ba、O三种元素都有固定的化合价,分别为+3、+2、-2,而Cu是+2和+3的混合价态.现用碘量法测定:取一定质量的![]() 样品,用稀盐酸溶解,在氮气保护下加过量的KI固体,样品中的
样品,用稀盐酸溶解,在氮气保护下加过量的KI固体,样品中的![]() 和
和![]() 分别氧化KI生成
分别氧化KI生成![]() ,用
,用![]() 溶液滴定得到的
溶液滴定得到的![]() ,终点时消耗
,终点时消耗![]() 溶液21.00 mL.有关反应如下:
溶液21.00 mL.有关反应如下:![]() ,
, ![]() ,
,
![]() .另取一份质量相等的
.另取一份质量相等的![]() 样品,用稀盐酸溶解,煮沸,使其中的
样品,用稀盐酸溶解,煮沸,使其中的![]() 全部转化为
全部转化为![]() ,冷却后用碘量法滴定,终点时消耗
,冷却后用碘量法滴定,终点时消耗![]() 溶液15.00 mL.试求:
溶液15.00 mL.试求:
(1)![]() 和
和![]() 的物质的量之比(2)x值
的物质的量之比(2)x值
15.取3.320g只含羧基、不含其它官能团的固态芳香族羧酸置于4.000 L氧气中点燃,羧酸完全燃烧。室温下,测得反应后气体体积增加0.224 L。将反应后的气体通过足量的固体Na2O2后,气体体积减少1.792 L。(所有气体体积均为标准状况下体积) 试回答:
(1)3.320g羧酸中n(C)=___ __;n(H)=___ __;n(O)=___ __。
(2)写出符合题给条件的相对分子质量最小的羧酸的结构简式(任写一种) 。
参考答案
1AD 2B 3AC 4BC 5A 6B 7A 8BD 9A 10D
11.(1) Ag+ (2)Al3+ AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-
(3)NO3- (4) 不能 H+和NO3-能把 Fe2+ 氧化为Fe3+
12.(1)Br2;Fe3+
(2)乙正确,在溶液中滴加四氯化碳,振荡,四氯化碳无色(或在溶液中滴加硫氰化钾溶液,溶液变红色)
(3)不可以,因为Br2和Fe3+都能把I—氧化成I2
13.(1)![]() (1分)
(1分)
(2)![]()
![]() (各2分)
(各2分)
(3)2Na2O2+2H2O ==4NaOH+O2↑(2分) 2Na2O2+2CO2 ==2Na2CO3+O2 (2分)
14(1)2∶3 (2)7.1
15.(1) 0.160mol 0.120mol 0.080mol
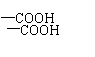 |
(2) ![]()
参考答案
1AD 2B 3AC 4BC 5A 6B 7A 8BD 9A 10D
11.(1) Ag+ (2)Al3+ AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-
(3)NO3- (4) 不能 H+和NO3-能把 Fe2+ 氧化为Fe3+
12.(1)Br2;Fe3+
(2)乙正确,在溶液中滴加四氯化碳,振荡,四氯化碳无色(或在溶液中滴加硫氰化钾溶液,溶液变红色)
(3)不可以,因为Br2和Fe3+都能把I—氧化成I2
13.(1)![]() (1分)
(1分)
(2)![]()
![]() (各2分)
(各2分)
(3)2Na2O2+2H2O ==4NaOH+O2↑(2分) 2Na2O2+2CO2 ==2Na2CO3+O2 (2分)
14(1)2∶3 (2)7.1
15.(1) 0.160mol 0.120mol 0.080mol
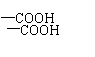 |
(2) ![]()