高三化学第一学期期中考试试题
本试卷分第Ⅰ(选择题)和第Ⅱ卷(非选择题)两部分。满分100分,时间90分钟。
相对原子质量:H:1 C:12 N:14 O:16 S:32 Na:23 Cu:64
第Ⅰ卷(共50分)
一、选择题(本题共10小题,只有一个选项符合题意,每小题2分,共20分)
1.设NA表示阿伏加德罗常数,下列叙述中,正确的是: ( )
A.假设1mol氯化铁完全转化为氢氧化铁胶体,则分散系中胶体微粒数为NA
B.46g二氧化氮和四氧化二氮的混合气体中含原子数为3NA
C.78g过氧化钠固体中所含阴、阳离子总数为4NA
D.在铜与硫的反应中,1mol铜原子参加反应失去的电子数为2NA
2.将质量分数为2w,物质的量浓度为C1的硫酸加水稀释到质量分数为w,物质的量浓度为C2,则C1、C2满足 ( )
A.C1=2C2 B.C1<2C2 C.C1>2C2 D.2C1=C2
3.取体积相同的KI 、Na2S和FeBr2溶液,分别通入足量氯气当反应恰好完全时,三种溶液消耗氯气的物质的量相同,则KI 、Na2S、FeBr2溶液的物质的量浓度之比为 ( )
A.2:1:2 B.2:1:3 C.6:3:2 D.3:7:1
4.下列事实与氢键有关的是: ( )
A.水加热到很高的温度都难以分解
B.水结成冰体积膨胀
C.CH4、SiH4、GeH4、SnH4熔点随相对分子质量增大而升高
D.HF、HCl、HBr、HI的热稳定性依次减弱
5.下列各组混合物的分离或提纯方法不正确的是 ( )
A.渗析法分离![]() 胶体和
胶体和![]() 溶液的混合物
溶液的混合物
B.分液法分离CCl4和NaCl溶液的混合物
C.结晶法提纯![]() 和
和![]() 混合物中的
混合物中的![]()
D.加热法分离碘和氯化铵的混合物
6.某同学为了探索镁粉与溴水反应的机理,做了如下四组实验:
①将镁粉投入冷水中,未见任何现象;
②将镁粉投入溴水中,观察到只是开始时产生极少量的气泡,但溴水的颜色全逐渐褪色;
③将镁粉投入液溴中,未观察到任何明显现象;
④向含足量镁粉的液溴中滴加几滴水,观察到溴的红棕色很快褪去。关于镁与溴水的反
应机理的论述中正确的是: ( )
A.镁粉只直接与溴水中的溴反应
B.产生极少量的气泡是由于镁粉和水反应得到
C.镁粉只与溴水中的酸反应
D.镁粉在水的催化下与溴反应
7.将1.92g铜粉投入到一定量的浓硝酸中反应,当铜完全作用时,生成的气体颜色越来越浅,共收集到气体672ml(标况下),将盛有此气体的容器倒扣在水槽中,通入标准状况下的一定体积的氧气,恰好使气体完全溶于水,则所通入氧气的体积为 ( )
A.504ml B.336ml C.224ml D.168ml
8.A、B为短周期元素,二者能组合形成多种我们所熟知的化合物。在这些化合物中,A与B的原子个数比为A:B=1:2。已知A的原子序数为n ,B的原子序数是①n+2 ②n+3 ③n+4④n+5 ⑤n+8 ⑥n-5 ⑦ n-7⑧n-8中的几种,其中不符合题目要求的是 ( )
A.①④ B.②⑧ C.③⑤ D.⑥⑦
9.FeS2结构类似于Na2O2,与酸反应时生成H2S2,H2S2类似于H2O2,易分解。实验室用稀盐酸制取H2S时,某学生误将FeS2颗粒当作FeS使用,当FeS2反应完后,不可能生成的物质是:
A.H2S B.S C.FeS D.FeCl2
|
A.无色透明的溶液中: K+、Ba2+ 、I-、 MnO4-
B.含有大量NO3-的溶液中: NH4+ 、Fe2+ 、SO42- 、H+
C.c(HCO3-)=0.1mol/l的溶液中: K+ 、Na+、 Br-、 CO32-
D.强碱性溶液中: ClO- 、 S2- 、 HSO3-、 Na+
二、选择题(本题共10小题,只有一个选项符合题意,每小题3分共30分)
11.核电荷数小于18的某元素X,其原子的电子层数为n,最外层电子数为(2n+1),原子核内质子数为(2n2-1)。下列关于元素X的说法不正确的是: ( )
A.其最高化合价为+3价 B.可形成化学式为KXO3的盐
C.其氢化物可以用来做喷泉实验 D. 其最高化合价氧化物的水化物为强酸
12.下列反应的离子方程式书写正确的是 ( )
A.次氯酸钙溶液中通入少量SO2气体:Ca2+ +2ClO -+SO2+H2O = CaSO3↓+2HClO
B.澄清石灰水与少量苏打溶液混合: Ca2+ +OH -+ HCO3-= CaCO3↓+H2O
C.碘化亚铁溶液中通入少量氯气: 2I -+ Cl2= 2Cl- + I2
D.氯化铝溶液中加入过量氨水: Al3+ +4NH3·H2O = Al(OH)4- +4NH4+
13.美国科学家发表论文,宣布发现了铝的“超级原子”结构——Al13和Al14。已知这类“超级原子”最外层电子数之和为40个时处于相对稳定状态。则正确的是 ( )
A.Al13和Al14互为同位素
B.Al13超原子中Al原子通过离子键结合
C.Al14最外层电子数之和为42与ⅡA族元素的性质相似
D.Al13和Al14互都具有较强的还原性,容易失去电子生成阳离子
14.右图是硫酸试剂瓶标签上的内容。据此下列说法中,正确的是: ( )
 A.该硫酸可以用来干燥碘化氢
A.该硫酸可以用来干燥碘化氢
B.1molZn与足量的该硫酸反应能产生2gH2
C.配制200ml 4.6mol/l 的稀需取该硫酸50ml
D.若不小心将该硫酸溅到皮肤上,应立即用氢氧化钠溶液冲洗
15.下列说法正确的是: ( )
①经分析某物质只含有一种元素,则该物质一定是单质;
②质子数相同,电子数也相同的粒子,不可能是一种分子和一种离子;
③碱性氧化物一定是金属氧化物;
④NO2不是酸酐、Na2O2不属于碱性氧化物;⑤两种盐反应一定生成两种新盐。
A.①③④ B.②③④ C.②③⑤ D.①③⑤
16.下列关于实验操作的叙述中正确的是: ( )
A.从试剂瓶中取出的任何药品,若有剩余应再放回原试剂瓶中
B.用容量瓶配某盐溶液,定容摇匀后发现凹液面最低处低于刻度线,再加水定容
C.配制硫酸时,可先在量筒中加入一定体积的水,再在搅拌条件下慢慢加入浓硫酸
D.萃取后,分液漏斗中的下层液体从下口流出,上层液体从上口倒出
17.以Mg条和Al片为电极,用导线连接同时插入NaOH溶液中,下列正确的是:( )
A.Mg条做负极,电极反应:Mg-2e=Mg2+
B.Al片做负极,电极反应:Al+4OH--3e=AlO2-+2H2O
C.电子从Mg电极沿导线流向Al电极
D.Al片上有气泡产生
18.A是一种常见的单质,B、C为中学常见的化合物,A、B、C均含有元素X,它们有如图所示的转化关系(部分产物及反应条件已略去)。下列正确的是: ( )
![]() A.X元素可能为铝
A.X元素可能为铝
B.反应①和②互为可逆反应
C.X元素可能是金属,也可能是非金属
D.反应①和② 一定为氧化还原反应
19.向含有1molKAl(SO4)2的溶液中逐滴加入氢氧化钡溶液,充分反应。下列说法不正确的是( )
A.当Al3+ 恰好完全沉淀时,消耗氢氧化钡1.5mol
B.当SO42- 恰好完全沉淀时,Al3+ 全部转化为四羟基合铝酸根
C.当向溶液中加入1.5mol氢氧化钡时,反应可用下列离子方程式表示:
2Al3+ +3SO42- +3Ba2++6OH-= 2Al(OH)3↓+ 3BaSO4↓
D.随加入的氢氧化钡的物质的量不断增大,沉淀的物质的量不断增大
20.某化学小组为测定一定质量的某铜铝混合物中铜的质量分数,设计了如下实验方案:
方案Ⅰ:铜铝混合物
![]() 测定生成气体的体积
测定生成气体的体积
方案Ⅱ:铜铝混合物
![]() 测定剩余固体的质量
测定剩余固体的质量
下列有关判断中不正确的是 ( )
A.溶液A和溶液B均可以是盐酸或NaOH溶液
B.溶液A和溶液B选用稀硝酸
C.若溶液B选用浓硝酸,测得铜的质量分数偏小
D.实验室中方案Ⅱ更便于实施
|
三.填空题(以下每空2分,共50分)
21.(4分)某溶液由Na+、Cu2+、Ba2+ 、Fe3+、 AlO2-、CO32- 、SO42-、Cl-中的若干种离子组成。
取适量该溶液进行如下实验:
①向其中加入过量盐酸,有气体生成,并得到无色透明溶液;
②向①所得的溶液中加入过量氨水,产生白色沉淀,过滤;
③向②所得的溶液中加入过量氢氧化钡溶液,产生白色沉淀,过滤;
④向③所得的滤液中加入过量稀硝酸,再加入硝酸银溶液,产生白色沉淀。
根据上述实验回答下列问题:
(1)原溶液一定不存在的离子是:_____________________________________;
(2)原溶液一定存在的离子是:______________________________________。
22.(6分)根据题目要求回答下列问题:
(1)化学实验时,下列处理方法不正确的是__ ______ _(少选得一半的分,错选不得分)
A.金属钠失火,用泡沫灭火器扑灭
B.用瓷坩埚熔融氢氧化钠或碳酸钠固体
C.用滴有酚酞的水做喷泉实验,只验证了氨气的溶解性
D.不慎将酸溅到眼中,应立即用水冲洗,边洗边眨眼
E.温度计的水银球破裂后,掉在地上的水银应用洒硫粉的方法除去
F.实验桌上的酒精灯失火后,立即用湿抹布盖灭
G.配制FeCl2溶液先将FeCl2溶解在盐酸中,再加入蒸馏水稀释,最后加少量铁粉
(2)就教材中氢氧化铁胶体的制备实验中应该注意的事项,回答:向沸水中滴加饱和氯化铁溶液,稍微加热煮沸,不宜长时间加热。这样操作的原因是:
__________________________________________________________________。
(3)在100ml的混合溶液中硝酸和硫酸的物质的量浓度分别是0.4mol/l和0.1mol/l,向该混合溶液中加入1.92g铜粉,所得溶液中Cu2+的物质的量浓度为:________。
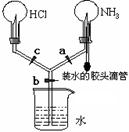 23.(4分)如图所示的装置,实验前a、b、c活塞均关闭。
23.(4分)如图所示的装置,实验前a、b、c活塞均关闭。
(1)要在该装置中产生喷烟现象,
其操作方法是:
。
(2)若要在该装置中产生双喷泉现象,其操作方法是:
。
24.(14分)根据下列题目要求,回答下列问题:
(1)硫酸是强酸,中学阶段将硫酸在水溶液中看作完全电离。事实上,硫酸的第一步电
离是完全的:H2SO4= H++
HSO4-,第二步电离并不完全:HSO4- ![]() H++
SO42- 。
H++
SO42- 。
①.则Na2SO4溶液呈__________(填弱酸性、中性或弱碱性),其理由是(用离子方程式表示)______________________________________________。
②.写出硫酸与氯化钡溶液反应的离子方程式:______________________________。
(2)在淀粉碘化钾溶液中加入少量次氯酸钠溶液,并加入少量的稀硫酸,溶液立即变蓝,有关反应的离子方程式是:_____________________________________________;
在上述溶液中加入足量的亚硫酸钠溶液,蓝色逐渐消失,有关反应的离子方程式是:___________________________________________________________。
(3)把氯化亚铁水溶液中的Fe2+氧化为Fe3+,而不引进金属阳离子或其它原溶液中不含有的阴离子,所用的两种方法的离子方程式分别为:
①.______________________________________________________;
②.______________________________________________________。
25.(16分)某化学小组的同学进行研究性学习时,决定自己动手探究NO2能否支持燃烧的问题。
(1)甲组同学设计的方案是:向烧瓶中加入适量的浓硝酸并加热,当烧瓶中有红棕色气体产生之后,将燃着的木条伸入烧瓶中,发现木条火焰熄灭。
①.写出浓硝酸受热分解的化学方程式:__________________________________。
②.根据甲组同学设计的方案,能不能得出NO2不支持燃烧的结论?___________(填能或不能)。推断的理由是:____________________________________________
___________________________________________________________________。
③.当烧瓶中充满红棕色气体时,将带火星的木条伸入烧瓶中,木条复燃了。有同学得出NO2能支持木条燃烧的结论。你认为这一结论是否正确?_____________(填正确或不正确)。理由是:________________________________________________
___________________________________________________________________。
(2)乙组同学通过查资料得知,某些不活泼金属的硝酸盐受热时也能产生NO2气体。
例如:2Cu(NO3) 2![]() 2CuO +4NO 2↑+O 2↑,2AgNO3
2CuO +4NO 2↑+O 2↑,2AgNO3![]() 2Ag +2NO
2↑+O 2↑。他们根据此原理设计如图甲所示的实验装置(加热、夹持
2Ag +2NO
2↑+O 2↑。他们根据此原理设计如图甲所示的实验装置(加热、夹持
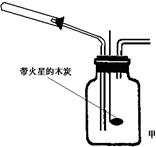 仪器未画出),并分别用硝酸铜和硝酸银进行实验,实
仪器未画出),并分别用硝酸铜和硝酸银进行实验,实
验中发现当红棕色气体进入集气瓶后,带火星的木炭
均能复燃,乙同学由此得出NO2支持燃烧的结论。
①.乙组同学使用该装置进行实验时,从环保的角度考
虑。应采取的措施是:____________________________。
②.指导老师认为乙组同学进行的两个实验中,有一个实验
所得结论是不可靠的。你认为不可靠的实验选用的反应物是:
____________,该实验所得结论不可靠的原因是:
________________________________________________________________。
26.(6分)
(1)宇宙飞船上的氢氧燃料电池,其电池反应为:2H2+O2=2H2O试写出电解质溶液若为盐酸时的正极反应式:__________________________________________。
(2)已知4g甲烷气体充分燃烧生成CO 2(气体)和H2O(液)时,放出Q kJ的热量。写出甲烷燃烧热的热化学方程式:_____________________________________________。
(3)已知下列热化学方程式:
①.Fe2O3(s) + 3CO(g) = 2Fe(s) + 3CO2(g) △H= -Q1kJ/mol
②.3Fe2O3(s) + CO(g) = 2Fe3O4 (s) + CO2(g) △H= -Q2kJ/mol
③. Fe3O4(s) + CO(g) = 3FeO(s) + CO2(g) △H= -Q3kJ/mol
利用盖斯定律计算:FeO(s) + CO (g)= Fe(s) + CO2(g) 的焓变△H=______________。
参考答案
一、选择题(本题共10小题,每小题只有一个选项符合题意,每小题2分,共20分)
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| B | C | C | B | D | D | B | C | C | C |
|
二、选择题(本题共10小题,每小题只有一个选项符合题意,每小题3分,共30分)
| 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 |
| A | C | C | C | B | D | B | D | D | B |
21.(1) Cu2+、Ba2+ 、Fe3+;⑵. AlO2-、CO32- 、SO42-、Na+ 。
22.(1)A、B、C ⑵.长时间加热能破坏生成的胶体。⑶. 0.225mol/l。
23.(1) 压缩胶头滴管,打开活塞a,c.(2)压缩胶头滴管,依次打开活塞a,c,最后打开活塞b。
24.(1) HSO4- ![]() H++ SO42- 。
H++ SO42- 。
①.弱碱性,SO42-+H2O![]() OH-
+HSO4-。
OH-
+HSO4-。
②. Ba2+ +HSO4-= H++ BaSO4↓。
⑵. 2H+ +2I-+ClO- = Cl-+H2O+ I2 SO32-+H2O+ I2=2I-+ SO42- + 2H+
⑶. 2H+ +2Fe2+ + H2O2 = 2H2O+2Fe3+ 或
12H+ +12Fe2+ +2O3 = 6H2O+12Fe3+ 或
4H+ +4Fe2+ +O2 = 2H2O+4Fe3+ 或
2Fe2+ +Cl2 = 2Cl-+ 2Fe3+四者之中的两个即可
25.⑴.①. 4HNO3![]() 2H2O +4NO
2↑+O 2↑。
2H2O +4NO
2↑+O 2↑。
②. 不能。推断的理由是:水蒸气浓度较大使燃着的木条熄灭。
③. 正确。理由是:NO 2和O 2的组成比例与空气相同,木条复燃说明NO 2能支持燃烧。
⑵. ①.措施是:增加尾气处理装置。
②. AgNO3 原因是:混合气体中氧气的百分含量比空气的大,木条复燃并不能说明NO 2能支持燃烧。
26.⑴. O2+4e-+4H+ = 2H2O。
⑵. CH4 (g) + 2O2 (g) = 2H2O (l) + CO2(g) △H= -4Q kJ/mol 。
⑶.△H= 1/6(2 Q3+ Q2-3 Q1) kJ/mol 。