高三化学第一轮复习卤素测试卷
时间:90分钟 分值:108分
第I卷(选择题,共54分)
1、某城市以“液氯泄漏”作为应急预警演习的项目,演习时下列防护措施合理的是( )
①及时向上风口和地势较高处转移疏散人群;②及时戴上用浓烧碱溶液湿润过的口罩;③用高压水枪向泄露口附近喷洒稀碱液并设法控制氯气泄漏;④及时戴上用稀纯碱溶液湿润过的口罩;⑤及时用毛巾包裹活性炭捂住口鼻;⑥就近向地下商场转移。
A.②③④⑤ B.①②④⑤ C.①③④⑤ D.①③④⑥
2、将0.01mol Cl2通入含0.03mol Br-和0.03mol I-的混合液中,再加CCl4振荡,则CCl4层的颜色是( )
A、紫色 B、橙红色 C、棕色 D、紫黑色
3、下列物质能直接用金属和氯气反应得到的是 ( )
① CuCl2 ②FeCl2 ③FeBr2 ④MgCl2 ⑤FeI3 ⑥ FeI2
A.①③⑥ B. ①④⑥ C.①②③④⑥ D.①③④⑥
4、下列关于氯水的叙述,正确的是( )
A.新制氯水中只含Cl2和H2O分子
B.新制氯水可使蓝色石蕊试纸先变红后褪色
C.光照氯水有气泡逸出,该气体是Cl2
D.氯水放置数天后PH值将变大
5、经氯气消毒的自来水,若用于配置以下溶液:① NaOH ② AgNO3 ③Na2CO3 ④FeSO4 ⑤ KI ⑥ Na2S ⑦ Na2SO3,会使配置的溶液变质的是( )
A.全部 B.②④⑤⑥⑦ C.②⑤ D.④⑥
6、实验室制氯气时有如下操作,操作顺序正确的是( )
①连接好装置,检查气密性 ②缓缓加热,加快反应,使气体均匀逸出
③在烧瓶中加入二氧化锰粉末 ④往分液漏斗中加入浓盐酸,再缓缓滴入烧瓶中 ⑤用向上排空气法收集氯气,尾气导入吸收剂中
A ①②③④⑤ B ④③①②⑤ C ①③④②⑤ D ①④③②⑤
7、G、Q、X、Y、Z均为氯的含氧化合物,现不了解其化学式,只知其一定条件下具有如下的转换关系(未配平):(1)![]() (2)
(2)![]() 电解
电解![]()
(3)![]() (4)
(4)![]()
这五种化合物氯的化合价由低到高的顺序是( )
A、Q、G、Z、Y、X B、G、Y、Q、Z、X
C、G、Y、Z、Q、X D、Z、X、G、Y、Q
8、能说明M的非金属性比N强的事实是( )
A、N的气态氢化物比M的气态氢化物稳定
B、HxM的酸性比HyN的酸性强
C、单质M的熔沸点比单质N的溶沸点高
D、M能将N从它的盐溶液中置换出来
9 、砹是原子序数最大的卤族,推测砹及砹的化合物不可能具有的性质是: ( )
A、砹是有色的固体 B、HAt很稳定
C、AgAt难溶于水. D、砹易溶于某些有机溶剂
10、泽维尔用飞秒(时间单位:1飞秒=10-15秒)激光技术研究了氰化碘(ICN)的分解反应 ICN→I+CN,发现该变化可在200飞秒内完成。已知(CN)2和卤素的性质相似。以下有关ICN的叙述中正确的是( )
A.ICN不能和NaOH溶液反应 B.ICN是一种共价化合物
C.将ICN加入到氯水中可生成I2 D. ICN的晶体是离子晶体
11、今有甲、乙、丙三瓶等体积的新制氯水,浓度均为 ![]() 。如果在甲瓶中加入少量的
。如果在甲瓶中加入少量的![]() 晶体(m mol),在乙瓶中加入少量的
晶体(m mol),在乙瓶中加入少量的![]() 晶体(m mol),丙瓶不变,片刻后,甲、乙、丙三瓶溶液中HClO的物质的量的浓度大小关系是(溶液体积变化忽略不计)
晶体(m mol),丙瓶不变,片刻后,甲、乙、丙三瓶溶液中HClO的物质的量的浓度大小关系是(溶液体积变化忽略不计)
A.甲=乙>丙 B.甲>丙>乙 C.丙>甲=乙 D.乙>丙>甲
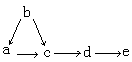 12、a、b、c、d、e是含有一种相同元素的5种物质,可发生如下转化:其中a是单质,b是气体,c、d是氧化物,e是最高价氧化物对应的水化物。则a不可能是( )
12、a、b、c、d、e是含有一种相同元素的5种物质,可发生如下转化:其中a是单质,b是气体,c、d是氧化物,e是最高价氧化物对应的水化物。则a不可能是( )
A、Cl2 B、N2 C、S D、C
13、在一种PH=1的溶液中可能存在NO3-、I-、Cl-、Fe3+中的一种或几种,向该溶液中滴入溴水,单质溴被还原,由此推断该溶液( )
A、含NO3-、Fe3+,无I-,可能有Cl-
B、含I-,不含NO3-、Fe3+,可能有Cl-
C、含I-、Fe3+、Cl-,肯定不含NO3-
D、含I-、NO3-,肯定不含Fe3+
14.碘元素有多种价态,可以形成多种含氧阴离子IxOyn—。由2个IO62—正八面体共用一个面形成的IxOyn—的化学式为
A.I2O94— B.I2O106— C.I2O118— D.I2O1210—
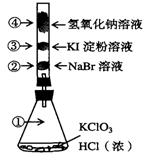 15、已知常温下氯酸钾与浓盐酸反应放出氯气,现按下图进行卤素的性质实验。玻璃管内装有分别滴有不同溶液的白色棉球,反应一段时间后,对图中指定部位颜色描述正确的是
15、已知常温下氯酸钾与浓盐酸反应放出氯气,现按下图进行卤素的性质实验。玻璃管内装有分别滴有不同溶液的白色棉球,反应一段时间后,对图中指定部位颜色描述正确的是
| ① | ② | ③ | ④ | |
| A | 黄绿色 | 橙色 | 蓝色 | 白色 |
| B | 无色 | 橙色 | 紫色 | 白色 |
| C | 黄绿色 | 橙色 | 蓝色 | 无色 |
| D | 黄绿色 | 无色 | 紫色 | 白色 |
16. 已知三角锥形分子E和直线形分子G反应,生成两种直线形分子L和M(组成E、G、L、M分子的元素原子序数均小于10),如下图,则下列判断错误的是( )
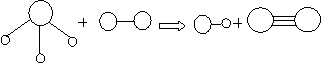
E G L M
A G是最活泼的非金属单质 B L是极性分子
C E能使紫色石蕊试液变蓝色 D M化学性质活泼
17、在体积为VL的干燥烧瓶中,用排空气法充入HCl气体后,测得瓶中气体对O2的相对密度为1.082,此气体进行喷泉实验,喷泉停止后,进入烧瓶的体积是( )
A、0.25VL B、0.5VL C、0.75VL D、VL
18、在加热的条件下,氟气与等物质的量的烧碱反应,生成氟化钠、水和另一种气体物质,该气体物质的化学式是( )
A.H2 B.HF C.O2 D.OF2
第II卷(非选择题共54分)
19.(12分)下面是关于药物华素片(西地碘片)使用说明书中的部分内容:
| 华素片(西地碘片)使用说明书] [品名和组成] 品名:西地碘片 商品名:华素片 英文名:Gydiodine Tablets 华素片(西地碘片)的主要活性成分是分子碘,含量1.5mg/片,将碘利用分子分散技术制成分子太西地碘,并含适量薄荷脑等。 [贮藏]遮光、密闭、在凉处保存。 [有效期]二年 |
(1)根据上述说明和所学化学知识回答:
①华素片中含有的活性成分是______(写分子式);
②请推断华素片______(“是”或“不是”)白色.
(2)某学生为验证华素片中确实含有上述成分,完成实验如下,请填空:
①取一粒药片放入研钵中研碎,再将药粉装入试管并加入约2 mL蒸馏水;向该试管中再加入约2 mL______(填选项字母),并用力振荡;
A.酒精 B.热裂汽油
C.四氯化碳 D.甘油
②描述加入该液体后可能观察到的现象__________;
③选用该液体做实验的原因是__________.
(3)请再设计另一种方法,验证华素片中的成分,(注意叙述实验原理、操作方法和实验结论)_________________________
20.(18分)下图所示为制取氯气的实验装置:
烧瓶中盛放的固体是MnO2,请回答下列问题:
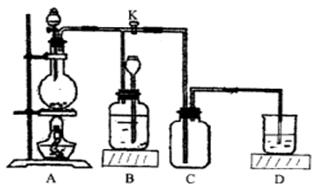
(1)盛放药品前,怎样检验此装置的气密性_________________
(2)分液漏斗中盛放的液体是___________,打开活塞K,将分液漏斗中的液体加入烧瓶中,关闭分液漏斗的活塞,点燃酒精灯,烧瓶中反应的化学方程式为___________________
(3)D中盛放的液体是_______;其作用为________
(4)B中盛放的液体是__________;收集氯气完毕,所进行的操作为__________.B装置的作用是________.
(5)欲收集到干燥纯净的氯气应对此装置进行一些改进.试画出改进的装置图,并标出装置中所盛放的药品:____________________________
21、(10分)下图是中学中常见的物质间化学反应关系图,其中A的焰色呈黄色,E、F为有刺激性气味的气体,G为含两种强酸的溶液,H为既难溶于水也难溶于酸的白色固体。
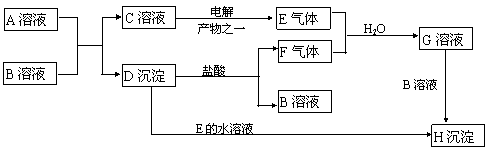 |
请回答:
(1) 写出下列物质的化学式:A H
(2) 写出C→E的化学方程式:
(3) 写出下列反应的离子反应方程式:
D→F+B:
E+F+H2O→G:
22.(14分)饱和氯水与石灰石的反应是制取较浓HClO溶液的方法之一。2005年的《化学教育》报道了如下实验研究:
实验一、定性研究:
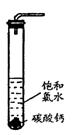 ①在试管中加入过量的块状碳酸钙,再加入约20mL饱和氯水,充分反应,有少量气泡产生,溶液浅黄绿色褪去;
①在试管中加入过量的块状碳酸钙,再加入约20mL饱和氯水,充分反应,有少量气泡产生,溶液浅黄绿色褪去;
②过滤,将滤液滴在有色布条上,发现其比氯水的漂白性更强;
③为了确定反应产物,将滤液分为三份,分别进行以下实验:
第一份与石灰水混合,立即产生大量白色沉淀;
第二份与稀盐酸混合,立即产生大量无色气体;
将第三份加热,看到溶液变浑浊且有大量无色气体产生。
经检测,上述实验中产生的无色气体均为CO2。
请回答:
(1)反应后所得的溶液漂白性增强的原因
(2)写出步骤③中第一份及第三份滤液发生的离子方程式:
第一份:
第三份:
(3)依据上述实验可推知,②的滤液中的溶质除CaCl2、HCIO外,还含有______ __ ___;
实验二、定量研究:
在圆底烧瓶底部,有一用塑料网包住的过量块状碳酸钙和150mL饱和氯水,按如图所示装置实验,待不再产生气泡后,将塑料网中剩余的石灰石提出液面,密封后再加热、煮沸烧瓶中的液体,直到量筒中的气体不再增加。
请回答:
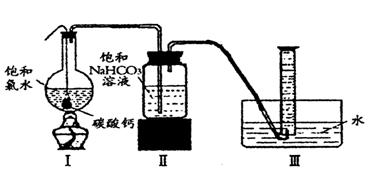 |
(4)为减少用装置Ⅲ收集气体过程中CO2因溶解而造成的损失,且水槽中仍然为水,请你对装置Ⅲ进行改进,最简单的方法是
(5)用改进后的装置进行上述实验,测得塑料网内的碳酸钙质量减少Ag,总共收集到标准状况下的CO2气体BL,发现![]() 明显小于
明显小于![]() 。若不考虑实验操作和CO2的溶解等因素造成的误差,从化学反应原理来看,导致这一大小关系的原因是____________
。若不考虑实验操作和CO2的溶解等因素造成的误差,从化学反应原理来看,导致这一大小关系的原因是____________
;
(6)实验后发现,装置Ⅱ中的液体增多了,其原因是_______________ _
《卤素》单元测试卷参考答案
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 |
| 答案 | C | A | B | B | A | C | B | D | B |
| 题号 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 |
| 答案 | B | B | A | B | A | A | D | C | D |
19.(1)①I2; ②不是
(2)①C ②加入四氯化碳后可看到试管中物质分为两层,下层为紫色的四氯化碳层. ③四氯化碳与水不互溶;而且碘在四氯化碳中的溶解度比在水中的溶解度要大得多.
(3)由于碘遇淀粉可呈现出特殊的蓝色,可利用此反应验证碘的存在.取一粒华素片放入研钵中研碎,再将药粉装入试管并加入约2mL蒸馏水;向该试管中再加入几滴淀粉溶液,如看到试管中物质呈现出特殊的蓝色,则证明有单质碘存在.
20.(1)将D装置中导管出口浸没在水面下,关闭分液漏斗活塞,打开K,加热A装置,D装置中有气泡冒出.关闭K,长颈漏斗中液面上升(B瓶中液面下降),说明装置不漏气.
(2)浓盐酸,4HC1+MnO2![]() MnCl2+C12↑+2H2O.
MnCl2+C12↑+2H2O.
(3)氢氧化钠溶液;吸收多余的氯气.
(4)饱和食盐水;关闭活塞K,撤去酒精灯.贮存多余的氯气,防止氯气污染环境.
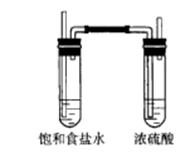 (5)应在B、C装置之间连接如图装置
(5)应在B、C装置之间连接如图装置
21、(1) A 、Na2SO3 H、BaSO4
电解
(2) 2NaCl + 2H2O===== 2NaOH +H2↑+Cl2↑
(3) BaSO3 + 2H+ ==== Ba2+ +SO2↑+ H2O
SO2 +Cl2+ 2H2O === 4H+ +SO42-+2Cl-
22.(1)CaCO3消耗了氯水中的HCl,使Cl2+H2O![]() HCl+HClO平衡向右移动,HClO浓度增大
HCl+HClO平衡向右移动,HClO浓度增大
(2)Ca2+ + HCO3-+ OH-=== CaCO3↓+H2O
Ca2+ + HCO3-=== CaCO3 + CO2↑+ H2O
(3)Ca(HCO3)2(写名称正确同样得分)
(4)在导管末端再连接长导管,使导管的出口接近量筒底部
(5)碳酸钙与氯水反应生成的Ca(HCO3)2再受热时,除生成CO2外,还生成了CaCO3
(6) 从圆底烧瓶蒸出的水蒸气在广口瓶中冷凝、聚集