高三化学第三次月考试题
原子量:H:1 Fe:56 N:14 O:16 Na:23 Cu:64 K:39 Zn:65 Ba:137 Cl:35.5 S:32 Mg:24
第Ⅰ卷
一. 选择题:(本题包括7小题,每题2分,共14分。每小题只有1个正确选项符合题意。)
1. 取三张蓝色石蕊试纸置于表面皿上,然后按顺序滴加65%的硝酸,98.3%的硫酸和新制氯水,三张试纸最终呈现的颜色是( )
A. 白、红、白 B. 红、黑、红
C. 红、红、红 D. 白、黑、白
2. 成语包含了透彻完整的思想内容,寓意深刻,生动形象,简练明了,是我国古代历史文化的宝贵遗产。下列有关金属的成语中,与碱金属有关的是( )
A. 百炼成钢 B. 火树银花
C. 点石成金 D. 沙里淘金
3. 将SO2通到显红色的酚酞试液中,发现红色消失,主要是因为SO2( )
A. 有漂白性 B. 有还原性
C. 有氧化性 D. 溶于水后显酸性
4. 下列说法中正确的是( )
A. 氮气化学性质不如磷活泼,故氮元素非金属性弱于磷
B. 氮族元素的单质与卤素单质类似,随核电荷数递增,熔沸点升高
C. 空气中含有NO2,下雨时溶于水中生成HNO3,淋洒到地面上,形成硝酸盐类,可促进作物生长,所以空气中NO2含量越多越有利。
D. 虽然3NO2+H2O=2HNO3+NO,但NO2不是硝酸的酸酐。
5. 下列反应的离子方程式正确的是( )
A. ![]() 溶液与足量澄清石灰水反应:3Ca2++2H2PO4-+ 4OH-== Ca3(PO4)2↓+
4H2O
溶液与足量澄清石灰水反应:3Ca2++2H2PO4-+ 4OH-== Ca3(PO4)2↓+
4H2O
B. AlCl3溶液中加入过量的氨水:Al3++4NH3·H2O==AlO2- +4 NH4++2H2O
C. NH4HSO3与等物质的量NaOH混合:NH4++ HSO3-+2OH-== SO32-+NH3↑+2H2O
D. ![]() 溶液中通入过量的 SO2:Ca2++2ClO-+ SO2+H2O==CaSO3↓+2HClO
溶液中通入过量的 SO2:Ca2++2ClO-+ SO2+H2O==CaSO3↓+2HClO
6. 密闭容器中,300℃时将100mL由H2O、CO2、H2和CO组成的混合气体与足量的Na2O2在连续电火花作用下充分反应后,容器内压强只有原来的五分之一,则原混合气体中各组分的体积比不可能是( )
A. 1∶1∶1∶1 B. 3∶1∶2∶4
C. 1∶3∶5∶1 D. 2∶2∶3∶3
7. 下列方法不能用于检验氨气的是( )
A. 气体使湿润的酚酞试纸变红
B. 气体使湿润的红色石蕊试纸变蓝
C. 气体与浓硫酸反应生成铵盐
D. 气体遇浓盐酸产生白烟
二. 选择题:(本题包括9小题,每题3分,共27分。每小题有一个或两个选项符合题意。)
8. 白磷在高压下隔绝空气加热后急速冷却,可得钢灰色固体——黑磷,其转化过程如下:
白磷![]() 黑磷,黑磷性质稳定,结构与石墨相似。下列叙述正确的是( )
黑磷,黑磷性质稳定,结构与石墨相似。下列叙述正确的是( )
A. 黑磷与白磷互为同分异构体 B. 黑磷能导电
C. 白磷转化为黑磷是物理变化 D.黑磷能在空气中自燃
9. 下列各组反应中,无论反应物的量多少肯定能得到Al(OH)3的是( )
A. 把CO2通入到NaAlO2溶液中 B. 把NH3通入到硫酸铝溶液中
C. 把Na投入到NaAlO2溶液中 D. 把Ba(OH)2投入到明矾溶液中
10. 将足量稀盐酸加到下列固体混合物中,只能发生一种反应的是( )
A. Mg、AlCl3、NaAlO2 B. KNO3、NaCl、CH3COONa
C. NaClO、Na2SO3、BaCl2 D. Ba(NO3)2、FeSO4、NH4HCO3
11. 将盛有12mLNO2 和O2 混合气体的量筒倒立于水槽中,充分反应后,还剩余2mL无色气体,则原混合气体中O2 的体积和剩余的气体分别是( )
A. 1.2mL、NO B. 2.4 mL、O2
C. 3.6 mL、NO D. 4 mL、O2
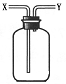
12. 现有简易洗气瓶(如下图),正放在桌面上,可分别实现下列实验目的,其中适用于从y口进入的是( )
① 瓶内盛一定量液体干燥剂,用于干燥气体
② 瓶内盛一定量液体洗涤剂,用于除去气体中的某些杂质
③ 瓶内盛水,用于测量难溶于水的气体体积
④ 瓶内贮存难溶于水的气体,加入水使气体排出
⑤ 用于收集密度大于空气的气体
⑥ 用于收集密度小于空气的气体
A. ①③⑥ B. ③④⑥ C. ③⑤ D. ③⑥
13. 铜和镁的合金a g完全溶于浓硝酸,若反应中硝酸被还原只产生b mol的NO2气体和c mol的N2O4气体,在反应后的溶液中,加入足量的氢氧化钠溶液,生成沉淀的质量为(以g为单位)( )
A. a+46b+92c B. a+34b+68c
C. a+17b+34c D. 不能确定
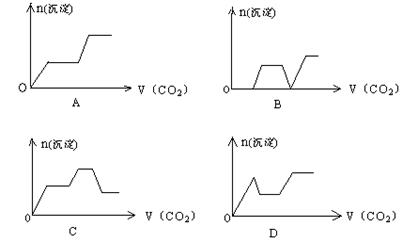
14. 将足量的CO2不断通入KOH、Ba(OH)2、KAlO2的混合溶液中,生成沉淀与通入CO2的量的关系可表示为( )
15. 在加入铝粉能放出氢气的溶液中,下列各组离子不可能共存的( )
A. NH4+、NO3-、Cl- 、Na+ B. Na+、Ba2+、Mg2+、HCO3-
C. NO3-、Mg2+、K+、Cl- D. NO3-、K+、AlO2-、OH-
16. 等质量的钠、钾、锌分别投入到含等量氯化氢的稀盐酸中充分反应,产生氢气的量的多少不会出现下列情况中的( )
A. Zn>Na>K B. Na>Zn>K
C. Na>K>Zn D. Na>K=Zn
第Ⅱ卷
三. 填空题:
17. BGO是我国研制的一种闪烁晶体材料,曾用于诺尔奖获得者丁肇中的著名实验,它是锗酸铋的简称。若知:① 在BGO中,锗处于其最高价态,② 在BGO中,铋的价态与铋跟氯形成某种共价氯化物时所呈的价态相同,在此氯化物中铋具有最外层8电子稳定结构,③ BGO可看成是由锗与铋两种元素的氧化物所形成的复杂氧化物,且在BGO晶体的化学式中,这两种氧化物所含氧的总质量相同。请填空:
(1)锗和铋的元素符号分别是 和 。
(2)BGO晶体的化学式是 。
(3)BGO晶体中所含铋氧化物的化学式是 。
18. 常温下,某混合气体可能由He、N2、O2、NH3、H2、NO、HCl和CO2气体中的两种或几种混合而成。取200mL该混合气体进行如下实验:① 将混合气体通过浓硫酸,体积减少40mL;② 将剩下的气体通过盛有Na2O2的容器,反应完毕后,体积减少40mL;③将剩余气体引燃后,再冷却至室温,气体体积减少105 mL,最后剩余气体15 mL,其中5 mL是O2;整个反应过程中,气体颜色均没有变化,问:
(1)原混合气体中一定有____________,混合前各有多少毫升____________。
(2)原混合气体中一定没有____________。
(3)原混合气体中可能有____________,混合前共多少毫升____________。
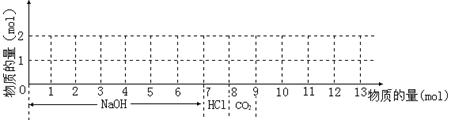
19. 若含有1molMg2+和1molAl3+的混合溶液,现按下图横坐标依次加入NaOH溶液、盐酸,通入CO2气体,纵坐标为混合沉淀的物质的量。请画出沉淀的量随反应的变化曲线,并写出各步反应的离子方程式。
20. A、B、C、D、E是五种中学化学常见的单质,已知A、B、C、D在常温下均为气态,E为金属。其中D能分别跟A、B、C在一定条件下化合,生成对应的化合物为X、Y、Z,其中常温下,Y为液体,X、Z为气体。有关的转化关系如下图所示(反应条件均已略去)。
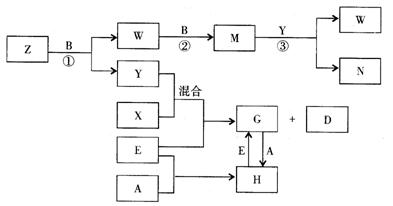
回答下列问题:
(1)A的化学式为_______________;
(2)写出反应③的化学反应方程式_________________________;
(3)Z和W在催化剂作用下反应生成C和Y,这是一个很有实际意义的反应,可以消除W对环境的污染,该反应的化学方程式为___________________;
(4)将过量的E加到N的稀溶液中,若过程中转移电子的数目为3.01×![]() ,则参加反应的E的质量为________g;
,则参加反应的E的质量为________g;
(5)将Z与N反应后的产物溶于水中,则常温该溶液的pH_____7,其原因是(用离子方程式表示)_______________________。
四. 实验题:
21. 实验室有一瓶Na2SO3固体,可能含有NaCl、Na2SO4、KNO3、K2CO3、K2SO4中的一种或几种杂质,通过下列实验确定该样品的成分及Na2SO3质量分数。
称此样品6.30g,加入6.0mol/L的硫酸至过量,产生无色气体560mL(标准状况),向逸出气体后的溶液中加入稍过量的BaCl2溶液,得到白色沉淀9.32g,透过蓝色钴玻璃观察,滤液的焰色反应无紫色。请根据实验填写下列空白:
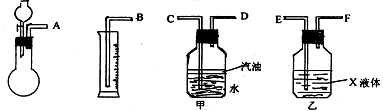
① 若用下图所示仪器组装进行上述实验,气流从左到右各仪器的正确连接顺序为(填编号字母)_______接 , 接 , 接 ,液体X是 ,汽油的作用是 。
② 操作时,怎样才能正确地测出放出气体的体积 。
③ 若实验中加入硫酸溶液的体积为5.00mL,则样品中Na2SO3的质量分数是 。
一定含有的杂质是____________。
五. 计算题
22. 实验室有甲、乙两瓶无色溶液,其中一瓶是稀盐酸,另一瓶是碳酸钠溶液。为测定甲、乙两瓶溶液的成分及物质的量浓度,进行以下实验:
取25mL甲溶液,向其中缓慢滴入乙溶液15mL,共收集到224mL(标准状况)气体。
取15mL乙溶液,向其中缓慢滴入甲溶液25mL,共收集到112mL(标准状况)气体。
(1)判断:甲是 溶液;
(2)求甲、乙两溶液的物质的量浓度各为多少?
【试题答案】
一、二、选择题:
1. D 2. B 3. D 4. D 5. A 6. A 7. C 8. B 9. AB 10. B
11. AD 12. D 13. C 14. C 15. B 16. A
三. 填空题:
17.(1)Ge、Bi (2)![]() 或
或![]() (3)
(3)![]()
18.
(1)NH3、H2 、CO2 40mL、70mL、80mL
(2)HCl、O2、NO
(3)He、N2 10mL
19. 根据有关离子方程式作图,如下图:
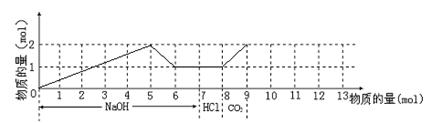
① ![]()
② ![]()
③ ![]()
④ ![]()
⑤ ![]()
20.
(1)Cl2
(2)3NO2+H2O=NO+2HNO3
(3)6NO+4NH3=5N2+6H2O
(4)14g
(5)<,产物为硝酸铵,在水溶液中铵根会水解,使溶液显酸性
四. 实验题:
21. ① A;E;F;D;C;B;浓硫酸;防止产生的气体溶于水
② 视线与量筒内液面持平;调整量筒高度,使甲瓶中液面与量筒液面在同一位置上。
③ 50%;NaCl、Na2SO4
五. 计算题
22.(1)HCl
(2)盐酸0.8mol/L;Na2CO31mol/L