高三化学第二次模拟试卷
命题人:胡玉凯(十三中)
说明:本试卷分第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分。共4页,25道题,满分值:100分,考试时间:90分钟。考生只交第Ⅰ卷的答题卡和第Ⅱ卷的答题纸。可能用到的相对原子质量:H:1 Na:23 Mg:24 Al:27 Fe:56 K:39 Cu:64 Ag:108 C:12 O:16 S:32 Cl:35.5 Br:80 N:14 Ne:20 Mn:55
第Ⅰ卷(选择题)
一、选择题(本题包括20小题,共60分,每小题只有一个正确答案)
1、下列关于物质的量的叙述中,错误的是
A.0.012 Kg 12C 中含有约 6.02×1023 个碳原子
B.1 mol SO2 在标准状况下的体积约为 22.4 L
C.1 mol 水中含有 2 mol 氢和 1 mol 氧 D.1 mol Ne 含有约 6.02×1024 个电子
2、在12g石墨晶体中,正六边形的数目约为
A.6.02×1023个 B.1.204×1024个
C.1.806×1023个 D.3.01×1023个
3、下列有关气体体积的叙述中,正确的是
A.在一定的温度和压强下,各种气态物质体积大小由构成气体分子大小决定
B.在一定的温度和压强下,各种气态物质体积的大小由构成气体的分子数决定
C.不同的气体,若体积不同,则它们所含的分子数一定不同
D.气体摩尔体积是指1 mol任何气体所占的体积约为22.4L
4、关于容量瓶的四种叙述:①是配制准确浓度的仪器;②不宜贮藏溶液;③不能用来加热;④使用之前要检查是否漏水。这些叙述中正确的是
A.①②③④ B.②③ C.①②④ D.②③④
5、下列物质加入溴水,经振荡,因发生化学反应而使溴水褪色的是
①Na2S ②NaOH ③乙酸 ④镁粉 ⑤裂化汽油 ⑥甲苯
A.①②③⑤ B.②④⑤⑥ C.①②④⑤ D.②③④⑥
6、常温下将1mol的钠、铁、铝分别投入到体积、物质的量浓度相等的盐酸溶液中,产生的氢气体积在相同条件下
A 钠可能最多 B 铁可能最多 C 铝一定最多 D 无法判断
7 、根据下列各组元素的原子序数,可组成化学式为AB2型化合物且为原子晶体的是
(A)14和6 (B)14和8 (C)12和17 (D)6和8
8、已知反应X+Y=M+N为放热反应,下列说法正确是
A.X能量一定高于M B.Y能量一定高于N
C.X和Y的总能量一定高于M和N的总能量
D.因为该反应是放热反应,故不必加热反应就可以发生
9、将一小粒钠投入到盛有5mL饱和石灰水中的试管中,不可能观察到的现象是
A 钠熔成小球并在液面上游动 B 有气体产生
C 溶液底部有银白色物质生成 D 溶液变浑浊
10、将 0.2 mol MnO2 和 50 mL 12 mol·L-1 盐酸混合缓缓加热 ( HCl无损失),反应完全后余下的溶液中加入足量的 AgNO3 溶液,下列判断生成AgCl 沉淀的物质的量正确的是
A.等于 0.3 mol B.大于 0.3 mol
C.大于 0.3 mol,小于 0.6 mol D.以上结论都不正确
11. 已知在25℃,101kPa下,l g C8H18(辛烷)燃烧生成二氧化碳和液态水时放出48.40kJ热量。表示上述反应的热化学方程式正确的是
A.C8H18(1)+12.5O2(g)=8CO2(g)+9H2O(g) ;△H=-48.40kJ·mol-1
B.C8H18(1)+12.5O2(g)=8CO2(g)+9H2O(1) ;△H=-5518kJ·mol-1
C.C8H18(1)+12.5O2(g)=8CO2(g)+9H2O(1) ;△H=+5518kJ·mol-1
D.C8H18(1)+12.5O2(g)=8CO2(g)+9H2O(1) ;△H=-48.40kJ·mol-1
12.在反应5NH4NO3![]() 2HNO3+4N2+9H2O中,发生氧化反应与发生还原反应的氮原子个数之比是
2HNO3+4N2+9H2O中,发生氧化反应与发生还原反应的氮原子个数之比是
A.1:3 B.5:3 C.5:8 D.5:4
13.下列离子方程式正确的是
A.溴化亚铁溶液中通入足量的氯气:2Fe2++Cl2=2Fe3++2Cl-
B.氨水中加入明矾溶液:3OH-+Al3+=Al(OH)3↓
C.铝片投入氢氧化钠溶液:2Al+2OH-+2H2O=2AlO2-+3H2↑
D.氯气溶于水:Cl2+H2O=2H++Cl-+ClO-
14.常温下,某溶液中由水电离产生的c[H+]、C(OH-)满足c(H+)·c(OH+)=
10-24,则下列各组离子在该溶液中一定可以大量共存的是
A.K+ Na+ AlO2- Cl- B.Na+ Cl- SO42- HCO3-
C.NH4+ Na+
NO3- SO42- D.Ba2+ Na+
Cl- NO3-
15.下列物质性质递变规律正确的是
A.酸性:HFO4>HClO4>HbrO4>HIO4 B.稳定性:HF>HCl>HBr>HI
C.酸性:HF>HCl>HBr>HI D.还原性:I—>Br—>Cl—>S2—
16. 阴离子Xn-含中子N个,X原子的质量数为A,则WgX元素的气态氢化物中含质子的物质的量是
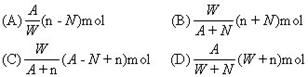
17. 已知a为第ⅡA族元素,b为第ⅢA族元素,它们的原子序数分别为m和n,且a,b为同一周期元素,则下列关系错误的是
A.n=m+1 B.n=m+11 C.n=m+25 D.n=m+10
18.将8gNa2O2 与Na2O 、NaOH、Na2CO3 的混合物与20g质量分数为36.5%的盐酸恰好完全反应,蒸干溶液,所得固体质量为:
A、8g B、10.8g C、11.7g D、15.3g
19. 下列各组顺序的排列不正确的是
A.酸性强弱:H3AlO3<H2SiO3<H2CO3<H3PO4
B.热稳定性:HCl>H2S>PH3>AsH3
C.离子半径:Na+>Mg2+>Al3+>F-
D.碱性强弱:KOH>NaOH>Mg(OH)2>Al(OH)3
20. 将Na2O2逐渐加入到含有Al3+,Mg2+,NH4+的混合溶液中并加热,产生的沉淀和气体的物质的量与加入Na2O2的物质的量的关系如图所示。则原溶液中Al3+,Mg2+,NH4+的物质的量分别为: ( )
 A、2mol,
3mol, 8mol.
A、2mol,
3mol, 8mol.
B、3mol, 2mol, 8mol.
C、2mol, 3mol, 4mol.
D、3mol, 2mol, 4mol.
第Ⅱ卷(非选择题,共40分)
二、填空题(本题共5小题,共34分)
21. (6 分 )(1)在标准状况下,700 L NH3 的物质的量为 ,全部溶解在 1 L H2O 中,所得溶液的质量分数为 ,如果该氨水的密度为 0.85 g·cm-3 ,则氨水的体积为 ,其物质的量浓度为 。
(2)在 V L Al2(SO4)3 溶液中,测得含 Al3+ 的质量为 a g ,则 Al2(SO4)3 溶液的物质的量浓度为 ,SO42- 的物质的量浓度为 。
22.(6分)在酸性条件下,许多氧化剂可使KI溶液中的I-氧化,例如KIO3(IO3-→I2)、H2O2(H2O2→H2O)、FeCl3(Fe3+→Fe2+)、K2Cr2O7(Cr2O72-→Cr3+)。请根据题目要求填空:
(1)写出在醋酸存在的条件下KIO3溶液与KI溶液反应的离子方程式 ;
(2)在酸性条件下(足量),各取1 L浓度为1 mol·L-1的KI溶液分别与上述列举四种溶液进行完全反应,则需要溶质的物质的量之比为n(KIO3):n(H2O2):n(FeCl3):n(K2Cr2O7)= : : :
23、(8分)A、B、C、D、E都是短周期元素,原子序数依次增大,B、C同周期,A、D同主族。A、B能形成两种液态化合物甲和乙,原子个数比分别为2∶1和1∶1。根据以上信息回答下列问题:
⑴甲、乙两分子中含有非极性共价键的物质的电子式是_________________,C元素在周期表中的位置是__________________。
⑵C和D的离子中,半径较小的是__________(填离子符号)。
⑶将D的单质投入甲中,待D消失后再向上述溶液中加入金属E的单质,此时发生反应的离子方程式是_____________________________________。
24. (6分)已知:H+(aq)+OH-(aq)=H2O(l);ΔH=-57.3 kJ·mol-1。现将一定量的稀盐酸、浓硫酸、稀醋酸分别和1 L 1 mol·L-1的NaOH恰好完全反应,其反应热分别为ΔH1、ΔH2、ΔH3,则ΔH1、ΔH2、ΔH3的大小关系为 ,原因是
。写出稀醋酸和NaOH反应的离子方程式: 。
25.(8分)制取氟氧氯化合物X,可采用特制的耐氟仪器。制备X的反应物是10%的HClO4溶液和F2,使它们缓缓反应,产率不很高。化合物X中元素的质量分数是:Cl 30%;O 54%;F 16%,且X的最简式式量与相对分子质量相同。有关物质的资料如下:
①无水KF为固体,易吸收F2、HF和H2O;
②化合物X的熔点-167.5℃,沸点-15.9℃,易分解,若接触有机物容易爆炸;
| |
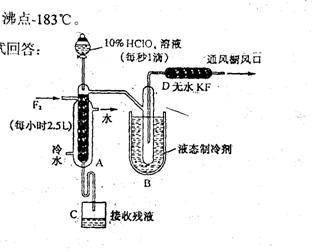 ③F2
沸点-188.14℃,O2沸点-183℃。
③F2
沸点-188.14℃,O2沸点-183℃。
实验装置如下图所示。试回答:
(1)X的化学式是 。
(2)HClO4与F2生成X的化学方程为 。
(3)D装置的作是 。
(4)B中致冷液选用液氧的理由是 。
三、计算题(6分)
26、在10mL硫酸和硫酸钾的混合溶液中,硫酸的物质的量浓度为1.6mol/L,硫酸钾的物质的量浓度为3.0mol/L。欲使硫酸的浓度变为2.0mol/L,硫酸钾的浓度变为0.30mol/L,现用98%的浓硫酸(ρ=1.84 g·cm—3)和蒸馏水进行配制。试求需要取用浓硫酸的体积。
高三化学答案
选择题1 C 2 D 3 B 4 A 5 C 6 A 7 B 8 C 9 C 10 C 11 B 12 B 13 C 14 D 15 B 16 C 17 D 18 C 19 C 20 C
21、(每空 1 分;共 6分,不写单位的不给分)
(1) 31.25 mol 34.7% 1.80 L 17.35 mol·L-1
(2)mol·L-1 mol·L-1
22、(6分)(1)IO-3+5I-+6CH3COOH 3I2+3H2O+6CH3COO-(3分)
(2)6 : 15 : 30 : 5(3分)
23、(8分)⑴![]() 第二周期、第ⅦA族 ⑵ Na+
第二周期、第ⅦA族 ⑵ Na+
⑶ 2Al+2OH-+2H2O=2AlO2-+3H2↑
24. (6分)大小关系为:△H3>△H1> △H2
原因是: 醋酸是弱酸,电离过程是吸热的,其中和热是最小的,浓硫酸溶于水是放热的,故中和热是最大的
离子方程式:CH3COOH+OH-==CH3COO-+H2O
25 、(8分)(1)FClO4 (2) HClO4 +F2 = HF + FClO4
(3)吸收产生的F2、HF有害气体及空气中的水蒸气
(4)便于X与F2的分离(此时X为固体,F2为气体)
26、(6分)根据K2SO4守恒,可求得最后液体的体积;
V(aq)=![]() =0.10L(2分)
=0.10L(2分)
最后液体中n(H2SO4)=0.10L×2.0moL/L=0.016moL
原溶液中n(H2SO4)=0.01L×1.6moL/L=0.016mol(1分)
需加入n(H2SO4)=0.20moL-0.016moL=0.184moL(1分)
则需加入98%的硫酸体积为:
V[H2SO4(aq)]=![]() =10.0 ml (2分)
=10.0 ml (2分)