高三化学第五次大练习试题
可能用到的相对原子量: Fe 56 S 32 Na 23 C 12
O 16 Cu 64 Cl 35.5
一.单项选择题(本题包括22个小题,其中1~12小题每题各2分共24分,13~22小题每题各3分共30分)
1.下列反应中生成物总能量高于反应物总能量的是
A 氧化钙溶于水 B 乙醇燃烧
C 铝粉与氧化铁粉末反应 D 碳酸钙受热分解
2.某非金属单质A和氧气发生化合反应生成B。B为气体,其体积是反应掉氧气体积的两倍(同温同压)。以下对B分子组成的推测一定正确的
A 有2个A原子 B 有2个氧原子 C 有1个氧原子 D 有1个A原子
3.下列表述正确的是
①人造刚玉熔点很高,可用作高级耐火材料,主要成分是二氧化硅
②化学家采用玛瑙研钵摩擦固体反应物进行无溶剂合成,玛瑙的主要成分是硅酸盐
③提前建成的三峡大坝使用了大量水泥,水泥是硅酸盐材料
④夏天到了,游客佩戴由添加氧化亚铜的二氧化硅玻璃制作的变色眼镜来保护眼睛
⑤太阳能电池可采用硅材料制作,其应用有利于环保、节能
A.①②③ B.②④ C.③④⑤ D.③⑤
 4.最近意大利罗马大学的FulvioCacace等人获得了极具理论研究意义的N4分子。N4分子结构如右图所示,已知断裂1moIN-N吸收167kJ热量,生成1molN≡N放出942kJ根据以上信息和数据,下列说法正确的是
4.最近意大利罗马大学的FulvioCacace等人获得了极具理论研究意义的N4分子。N4分子结构如右图所示,已知断裂1moIN-N吸收167kJ热量,生成1molN≡N放出942kJ根据以上信息和数据,下列说法正确的是
A.N4属于一种新型的化合物 B.N4与N2互为同素异形体
C.N4沸点比P4(白磷)高 D. N4 的摩尔质量是56g
5.某温度下,体积一定 的密闭容器中进行如下可逆反应:
X(g)+Y( g) ![]() Z( g)+W(s); ⊿H>0
Z( g)+W(s); ⊿H>0
下列叙述正确的是( )
A. 加入少量W,逆反应速率增大 B. 当容器中压强不变时,反应达到平衡
C. 升高温度,平衡逆向移动 D. 平衡后加入X,X的转化率一定增大
6.下列物质能通过化合反应直接制得的是
①FeCl2 ②H2SO4 ③NH4NO3 ④HCl
A.只有①②③ B.只有②③ C. 只有①③④ D.全部
7.下列说法正确的是
A.H与D,16O与18O互为同位素;H216O、D216O、H218O、D218O互为同素异形体;
甲醇、乙二醇和丙三醇互为同系物
B.非金属元素之间只能形成共价化合物
C.HI的相对分子质量大于HF,所以HI的沸点高于HF
D.氨水所含的粒子数小于氯水所含的粒子数
8.拟用如下方法区别有关物质,这些方法正确的是( )
①用品红溶液区分CO2和SO2两种气体 ②用盐酸酸化的BaCl2溶液区分Na2SO3和Na2SO4溶液 ③用湿润的淀粉碘化钾试纸区分NO2和溴蒸气 ④用溴水区分苯和CCl4两种液体 ⑤用NaOH溶液区分NH4Cl 和 (NH4)2SO4两种溶液 ( )
A.①②④ B.①②③ C.②③④ D.①②⑤
9.下列关于晶体的叙述中,不正确的是 ( )
A.金刚石网状结构中,由共价键形成的碳原子环中,最小的环上有6个碳原子
B.氯化钠晶体中,每个Na+周围与其邻近且等距离的Na+共有6个
C.氯化铯晶体中,每个Cs+周围紧邻8个Cl-
D.干冰晶体中,每个CO2分子周围紧邻12个CO2分子
10.下列各组热化学方程式程中,化学反应的△H前者大于后者的是
①C(s)+O2(g)=CO2(g);△H1 C(s)+1/2O2(g)=CO(g);△H2
②S(s)+O2(g)=SO2(g);△H3 S(g)+O2(g)=SO2(g);△H4
③H2(g)+1/2O2(g)=H2O(g);△H5 2H2(g)+O2(g)=2H2O(l);△H6
④CaCO3(s)=CaO(s)+CO2(g);△H7 CaO(s)+H2O(l)=Ca(OH)2(s);△H8
A ① B ④ C ②③④ D ①②③
11. 根据相关化学原理,下列判断正确的是
A 若X是原子晶体,Y是分子晶体,则熔点:X<Y
B 若A2+2D-=2A-+D2,则氧化性:D2>A2
C 若R2-和M+的电子层结构相同,则原子序数:R>M
D 若弱酸HA的酸性强于弱酸HB,则同浓度钠盐溶液的碱性:NaA<NaB
12.关于下列装置图的叙述中,不正确的是
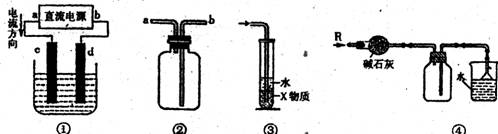
A.装置①中,c为阳极、d为阴极
B 装置②可用于收集H2、NH3、C02、C12、HCl、N02等气体
C装置③中X若为苯,可用于吸收氨气或氯化氢,并防止倒吸
D.装置④可用于干燥、收集氨气,并吸收多余的氨气
13.某溶液中加入铝片有氢气产生,则在该溶液中下列离子组一定能大量共存的是
A Na+、S2O32-、SO42-、Cl-
B Ba2+、Mg2+、CI-、NO3-
C NH4+、Ba2+、HCO3-、Cl-
D Na+、K+、SO42-、Cl-
14.阿伏加德罗常数约为6.02×1023mol-1,下列说法中一定正确的
A. 1.0L 1.0mol·L—1CH3COOH溶液中,CH3COOH分子数约为6.02×1023
 B. Na2O2与H2O反应生成1.12LO2(标准状况),反应中转移的电子数约为2×6.02×1022
B. Na2O2与H2O反应生成1.12LO2(标准状况),反应中转移的电子数约为2×6.02×1022
C 32g S8单质中含有的S-S键个数约为6.02×1023
D 含FeS2120克的黄铁矿在沸腾炉里完全燃烧时共失去的电子数约为44×6.02×1023
15.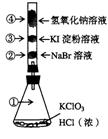 已知常温下氯酸钾与浓盐酸反应放出氯气,现按下图进行卤素的性质实验。玻璃管内装有分别滴有不同溶液的白色棉球,反应一段时间后,对图中指定部位颜色描述正确的是
已知常温下氯酸钾与浓盐酸反应放出氯气,现按下图进行卤素的性质实验。玻璃管内装有分别滴有不同溶液的白色棉球,反应一段时间后,对图中指定部位颜色描述正确的是
| ① | ② | ③ | ④ | |
| A | 黄绿色 | 橙色 | 蓝色 | 白色 |
| B | 无色 | 橙色 | 紫色 | 白色 |
| C | 黄绿色 | 橙色 | 蓝色 | 无色 |
| D | 黄绿色 | 无色 | 紫色 | 白色 |
16.将SO2通入CuSO4和NaCl的浓溶液中,溶液颜色变浅,析出白色沉淀,取该沉淀分析,知其中含Cl:35.7%,Cu:64.3%,SO2在上述反应中作用是
A.酸性 B.漂白剂 C.氧化剂 D. 还原剂
17.某一密闭绝热容器中盛有饱和Ca(OH)2溶液,当加入少量CaO粉末,下列说法正确的是
①有晶体析出 ②c[Ca(OH)2]增大 ③pH不变 ④c(H+)c(OH-)的乘积不变 ⑤c(H+)一定增大
A ① B ①③ C ①②④ D ①⑤
18. 下列离子方程式书写正确的是( )
![]() A.NaHSO3溶液显弱酸性是因为:HSO3- +H2O
A.NaHSO3溶液显弱酸性是因为:HSO3- +H2O ![]() SO32-
+H3O+
SO32-
+H3O+
B.尼泊金酸( )与碳酸氢钠溶液反应:
![]()
![]()
+2HCO3- → + 2CO2↑+ 2H2O
C.NH4HCO3溶液中加入过量Ca(OH)2溶液:
NH4 + + HCO3 -+ +2 OH- =NH3·H2O + H2O
D.电解氯化镁溶液时电极反应的离子方程式是:
2Cl-+2H2O![]() 2OH-+H2↑+Cl2↑
2OH-+H2↑+Cl2↑
19.通常人们把拆开1 mol某化学键所吸收的能量看成该化学键的键能。键能的大小可用于估算化学反应的反应热(△H),化学反应的△H等于反应中断裂旧化学键的键能之和与反应中形成新化学键的键能之和的差。已知单质硅、SiO2均为空间四面体结构,Si—O、 O=O、Si—Si键能分别为a kJ·mol—1、b kJ·mol—1、c kJ·mol—1,则反应Si(s) + O2(g) 高温 SiO2(s)的△H约为
A.(c+b-2a) kJ·mol—1 B.(c+b-4a) kJ·mol—1
C.(2c+b-2a) kJ·mol—1 D.(2c+b-4a) kJ·mol—1
20.英国媒体05年4月15日报道,高露洁牙膏中含有的消毒剂三氯生遇含氯自来水能生成哥罗芳(三氯甲烷),哥罗芳能导致肝病甚至导致癌症。已知三氯生的结构简式如下。有关说法正确的是
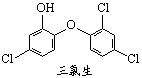 A.三氯生的分子式为:C12H6Cl3O2
A.三氯生的分子式为:C12H6Cl3O2
B.哥罗芳不存在同分异构体
C.三氯生是苯酚的同系物
D.三氯生易溶于水
21.①氧化钠②氢氧化钠③过氧化钠④亚硫酸钠。1mol上述固体物质分别长期放置于空气中,最后质量增加的情况(不考虑水解因素) ( )
A. ① = ② > ③ > ④ B.① > ③ > ④ > ②
C. ②> ① = ③ > ④ D.④ > ② > ③ > ①
22.电瓶车所用电池一般为铅蓄电池,这是一种典型的可充电电池,电池总反应式为
![]()
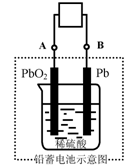 Pb+PbO2+4H++2SO42-
2PbSO4+2H2O,
Pb+PbO2+4H++2SO42-
2PbSO4+2H2O,
则下列说法正确的是
A.放电时:电流方向由B到A
B.放电时:正极反应是Pb-2e-+SO42-![]() PbSO4
PbSO4
C.充电时:铅蓄电池的负极应与充电器电源的正极相连
D.充电时:阳极反应是PbSO4-2e-+2H2O![]() PbO2+SO42-+4H+
PbO2+SO42-+4H+
二.实验问答题(本题包括两小题,共18分)
23.(4分) 下列实验操作或对实验事实的描述不正确的是 (填序号)
① 用热的浓HCl洗涤附着有MnO2的试管;② 浓硫酸不小心沾在皮肤上,先用抹布擦干净,再用大量的水冲洗;③试管内壁上附着着硫可用CS2或NaOH溶液来洗涤;④ 将乙烯、乙炔分别通入溴水中,乙烯使溴水的褪色速度快;⑤ 蒸馏石油时,冷凝管中的冷水应上进下出;⑥ 向蛋白质溶液中加入浓的无机盐(如Na2SO4、CuSO4)溶液,可使蛋白质盐析而分离提纯;⑦ 在试管中放入几片碎滤纸,滴几滴90%的浓硫酸,再将滤纸捣成糊状,微热并冷却后先滴入过量的NaOH溶液再加入几滴CuSO4溶液,加热至沸腾,可观察到红色沉淀生成;⑧ 配制一定浓度的溶液时,若定容时不小心加水超过容量瓶的刻度线,应立即用滴管吸去多余的部分。
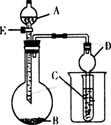 24.(14分)某校研究性学习小组设计了如下所示装置进行下列有关实验。实验时将分液漏斗中A逐滴加入烧瓶中(图中铁架台.铁夹等已略去)。
24.(14分)某校研究性学习小组设计了如下所示装置进行下列有关实验。实验时将分液漏斗中A逐滴加入烧瓶中(图中铁架台.铁夹等已略去)。
(1)若A为浓硫酸, B为第三周期元素组成的片状单质,其在常温下难溶于水反应,C为品红溶液,实验中观察到溶液红色褪去,则B为 (填化学式);此时烧瓶中发生的化学反应方程式为 。然后向烧杯中加入沸水,又可观察到的现象是 。
⑵若B块状大理石,A为稀盐酸,若C为Na2 CO3饱和溶液,实验中观察到小试管内溶液变浑浊,则烧杯中反应的离子方程式为 。若C为苯酚钠溶液,则可观察到的现象是 ,再向烧杯里加入沸水后,又能观察到的现象是 。此实验证明的三种酸的强弱顺序为 。
⑶若B为生石灰,实验中观察到C溶液中生成白色沉淀,该沉淀既能溶于烧碱,又能溶于稀盐酸。则A是 (填名称);烧瓶中发生的化学反应方程式为 。C中生成的沉淀与烧碱反应的离子方程式为 。
三.填空及推断题(包括2小题,共16分)
25.(A)(4分)⑴.请将5种物质:N2O、FeSO4、Fe(NO3)3、HNO3和Fe2(SO4)3分别填入下面对应的横线上,组成一个未配平的化学方程式。
________+________→________+________+________+H2O
(2)请将反应物的化学式及配平后的系数填入下列相应的位置中:
![]() __________
+
__________
+ ![]() __________
→
__________
→
(B)(4分)下表中的实线表示元素周期表的部分边界。①~⑤分别表示元素周期表中对应位置的元素。
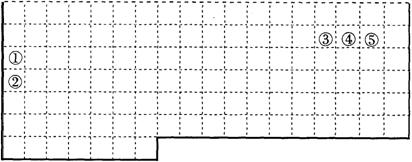
(1)请在上表中用实线补全元素周期表边界。
(2)由元素③形成的单质的结构式为_______。由元素③形成气态氢化物的空间构型为_______。
(3)由元素①、④形成的化合物中含非极性共价键的物质的电子式是 。
(4)在元素①的单质、元素②的单质和元素①②形成的合金这三种物质中,熔点最低的是_____。
A 元素①的单质 B 元素②的单质
C 元素①②形成的合金 D 无法判断
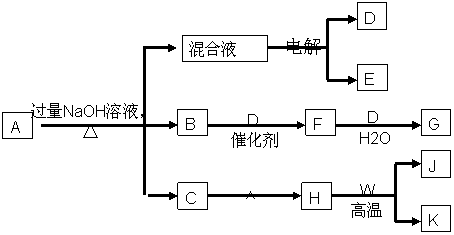
26. (8分)有一化合物A ,其水溶液为浅绿色,可发生如下的转化关系。其中B、D、E为无色气体,W、K为常见的金属单质, C为难溶于水的红褐色固体。在混合液中加入BaCl2可生成不溶于稀HNO3的白色沉淀,H和W反应可放出大量的热
。
(1)、写出下列物质的化学式:A C F
(2)、写出下列反应的化学方程式
H+W→J+K
F→G
(3)、电解混合液的阳极电极反应式为
四.有机推断题(供14分)
27.已知![]() (注:R,R’为烃基)
(注:R,R’为烃基)
A为有机合成中间体,在一定条件下发生消去反应,可能得到两种互为同分异构体的产物,其中的一种B可用于制取合成树脂、染料等多种化工产品。A能发生如下图所示的变化。
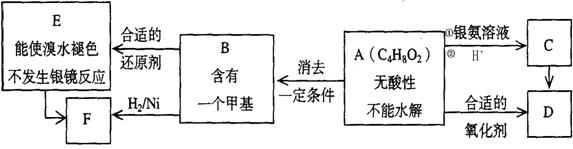
试回答
(1)写出符合下述条件A的同分异构体结构简式(各任写一种):
a.具有酸性______________________;b.能发生水解反应______________________;
(2)A分子中的官能团的名称是______ _______;
(3)A→C 的反应类型是_____________,E→F的反应类型是___________;
A 氧化反应 B 还原反应 C 加成反应 D 取代反应
(4)写出化学方程式:A→B_________________________________________。
(5)写出E生成高聚物的化学方程式:____________________________________。
(6)C的同分异构体Cl与C有相同官能团,两分子Cl脱去两分子水形成含有六元环的C2,写出C2的结构简式:___________________________
五.计算题(共6分)
28.自然界存在的某天然碱(纯净物)的化学组成可表示为:aNa2CO3·bNaHCO3·cH2O(a.b.c为正整数)。若取3.32g天然碱样品与300℃加热分解至完全(300℃时Na2CO3 不分解),产生CO2112ml(标准状况)和水0.45g,试通过计算确定该天然碱的化学式。
2007届高三第五次大练习化学答题纸
一.单项选择题(本题包括22个小题,其中1~12小题每题各2分共24分,13~22小题每题各3分共30分)
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 |
| 答案 | |||||||||||
| 题号 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 | 21 | 22 |
| 答案 |
二.实验问答题(本题包括两小题,共18分)
23. 下列实验操作或对实验事实的描述不正确的是 (填序号)
24. (1) B为 (填化学式)
此时烧瓶中发生的化学反应方程式为 。
可观察到的现象是 。
⑵则烧杯中反应的离子方程式为 。
现象是 ,又能观察到的现象 。此实验证明的
三种酸的强弱顺序为 。
⑶ A是 (填化学式);
化学反应方程式为 。
C中生成的沉淀与烧碱反应的离子方程式为
三.填空及推断题(包括2小题,共16分)
25.(A) ⑴.________+________→________+________+________+H2O
(2)请将反应物的化学式及配平后的系数填入下列相应的位置中:
![]() __________
+
__________
+ ![]() __________
→
__________
→
(B)下表中的实线表示元素周期表的部分边界。①~⑤分别表示元素周期表中对应位置的元素。

(1)请在上表中用实线补全元素周期表边界。
(2)结构式为 ,空间构型为 。
(3)电子式是 。
(4)____ _。
26.(1)、写出下列物质的化学式:A C F
(2)、写出下列反应的化学方程式
H+W→J+K
F→G
(3)、电解混合液时阳极电极反应式为
四.有机推断题(供14分)
27.试回答
(1)写出符合下述条件A的同分异构体结构简式(各任写一种):
a.具有酸性______________________;b.能发生水解反应______________________;
(2)A分子中的官能团的名称是______ _______;
(3)A→C 的反应类型是_____________,E→F的反应类型是___________;
A 氧化反应 B 还原反应 C 加成反应 D 取代反应
(4)写出化学方程式:A→B_________________________________________。
(5)写出E生成高聚物的化学方程式:____________________________________。
(6)C的同分异构体Cl与C有相同官能团,两分子Cl脱去两分子水形成含有六元环的
C2,写出C2的结构简式:________________________ ___
五.计算题(共6分)
28.
高三第五次大练习化学答题纸
一.单项选择题(本题包括22个小题,其中1~12小题每题各2分共24分,13~22小题每题各3分共30分)
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 |
| 答案 | D | C | D | B | B | D | D | A | B | C | D |
| 题号 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 | 21 | 22 |
| 答案 | C | D | C | A | D | D | A | D | B | B | D |
二.实验问答题(本题包括两小题,共18分)(方程式2分,其余各1分)
23. 下列实验操作或对实验事实的描述不正确的是 ⑤⑥⑧
24. (1) B为 Mg (填化学式)
Mg + 2H2SO4 = MgSO4 + SO2 + H2O 。
可观察到的现象是 红色褪去 。
⑵则烧杯中反应的离子方程式为 CO2+H2O+2Na++CO32- = 2NaHCO3 。
现象是 溶液变浑浊 ,又能观察到的现象 溶液变澄清 。此实验证明的三种酸的强弱顺序为 HCl>H2CO3 >苯酚 。
⑶ A是 浓氨水 (填名称);
化学反应方程式为
CaO+NH3·H2O=Ca(OH)2+NH3 。
C中生成的沉淀与烧碱反应的离子方程式为 Al(OH)3 + OH- = AlO2-+H2O
三.填空及推断题(包括2小题,共18分)
25.(A)(1)FeSO4+HNO3→Fe(NO3)3+Fe2(SO4)3+N2O+H2O 2分
(2)24FeSO4+30HNO3→
2分
(B)(1)方程式2分,其余各1分
(2) N≡N 三角锥
(3)Na
2O2(4)C
26. (1). A (NH4)2Fe(SO4)2 C Fe(OH)3 F NO
(2). 2Al+Fe2O3=== Al2O3+2 Fe 4NO+3O2+2H2O==4HNO3
Fe+4H++NO3-==Fe3++NO+2H2O
(3). 4OH--4e- == O2+2H2O
四.有机推断题(供12分)
[1] 27.(1)a、CH3CH2CH2COOH 2分 b、CH3CH2COOCH3 2分
(2)羟基、醛基(或-OH和-CHO) 各1分
(3)a; b、c
各1分
(4)CH3CH(OH)CH2CHO→CH3CH=CHCHO+H2O
2分
(5)nCH3CH=CHCH2OH→![]() 2分
2分
五.计算题(共7分) 2Na2CO3·NaHCO3·2H2O

