高三化学科11月月考试题
6.把元素R的气态氢化物HnR在高温下分解为固态物质和H2,若在同温同压下,气体产物的体积与原气体体积相等,并且分解前后两种气体质量之比为17∶1,则下列叙述正确的是
A.R的离子各电子层电子数分别为2、8、8
B.R的最高价氧化物的水化物酸性比磷酸弱
C.R的最高价氧化物中含氧50%
D.R的含钠化合物(NanR)不能与氯水发生置换反应
7、在元素周期表短周期中的X和Y两种元素可组成化合物XY3,下列说法正确的是
A.XY3晶体一定是离子晶体
B.若Y的原子序数为n,X的原子序数一定是n±4
C.X和Y可属于同一周期,也可属于两个不同周期
D.X和Y一定不属于同一主族
8、下列有关碱金属铷(Rb)的叙述中,正确的是
A.铷燃烧的产物只有氧化铷 B.硝酸铷是离子化合物,易溶于水
C.在钠、钾、铷三种单质中,铷的熔点最高 D.氢氧化铷是弱碱
9、取a g某物质在氧气中完全燃烧,将其产物跟足量的过氧化钠固体完全反应,反应后固体的质量恰好也增加了a g。下列物质中不能满足上述结果的是
A.H2 B.CO C.C6H12O6 D.C12H22O11
10、下列物质中不会因见光而分解的是
A.NaHCO3 B.HNO3 C.AgI D.HClO
11、对于某些离子的检验及结论一定正确的是
A、加入稀盐酸产生无色气体,将气体通入澄清石灰水中,溶液变浑浊,一定有CO32¯
B、加入氯化钡溶液有白色沉淀产生,再加盐酸,沉淀不消失,一定有SO42¯
C、加入氢氧化钠溶液并加热,产生的气体能使湿润红色石蕊试纸变蓝,一定有NH4+
D、加入碳酸钠溶液产生白色沉淀,再加盐酸白色沉淀消失,一定有Ba2+
12、下列有关叙述中正确的是
A.液态氟化氢中存在氢键,所以其分子比氯化氢更稳定
B.C和Si同主族,所以CO2和SiO2 都是由极性键构成的非极性分子
C.S8和SiO2都是共价化合物,NH4Cl和CaC2都是离子化合物
D.若IIA族某元素的原子序数为m,则同周期ⅢA族元素的原子序数有可能为m+11
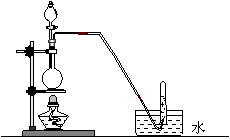 13.下列气体的制备可采用右图装置的是
13.下列气体的制备可采用右图装置的是
A.铜与浓硝酸反应制NO2
B.铜与稀硝酸反应制NO
C.乙醇与浓硫酸反应制乙烯
D.氯化钠与浓硫酸反应制HCl
26.(17分)已知X、Y、Z、W是元素周期表中短周期中的四种非金属元素,它们的原子序数依次增大,X元素的原子形成的阳离子就是一个质子,Z、W在元素周期表中处于相邻的位置,它们的单质在常温下均为无色气体,Y原子的最外层电子数是内层电子数的2倍。试回答:(1)写出下列元素的元素名称:
X 、Y 、Z 、W 。
(2)X单质和Z单质在一定条件下反应生成化合物E,该反应的化学方程式为(请注明反应条件) 。E分子的空间构型为 ,电子式为 。E在催化剂存在的条件下可用于还原汽车尾气中的 ,以减少对大气的污染。
(3)仅由X、Z、W三种元素组成的某种盐是一种速效肥料,但长期施用会使土壤酸化,有关的离子反应方程式为 。
(4)这四种元素可组成原子个数比为5∶1∶1∶3的化合物(按X、Y、Z、W的顺序),该化合物的水溶液与足量热NaOH溶液反应的离子方程式 。
(5)将8g单质Y在足量W单质中燃烧,所得气体通入lL lmol·L-1NaOH溶液中,完全吸收后,溶液中的各离子浓度由大到小的顺序是 。
27.(15分)已知某纯碱试样中含有NaCl杂质,为测定试样中纯碱的质量分数,可用右图中的装置进行实验。
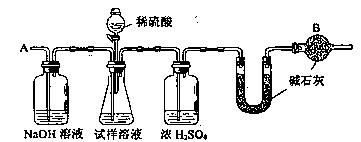
主要实验步骤如下:
① 按图组装仪器,并检验装置的气密性
② 将a g试样放入锥形瓶中,加适量蒸馏水溶解,得到试样溶液
③ 称量盛有碱石灰的U型管的质量,得到b g
④ 从分液漏斗滴入6mol·L—1的硫酸,直到不再产生气体时为止
⑤ 从导管A处缓缓鼓入一定量的空气
⑥ 再次称量盛有碱石灰的U型管的质量,得到c g
⑦ 重复步骤⑤和⑥的操作,直到U型管的质量基本不变,为d g
请填空和回答问题:
⑴在用托盘天平称量样品时,如果天平的指针向右偏转,说明_____________________。
⑵ 装置中干燥管B的作用是___________________________________________。
⑶ 如果将分液漏斗中的硫酸换成浓度相同的盐酸,测试的结果_________________,
如果将试剂瓶中的NaOH溶液换成饱和NaHCO3溶液,测试的结果 (填偏高、偏低或不变)。
⑷ 步骤⑤的目的是__________________________________________。
⑸ 步骤⑦的目的是__________________________________________。
⑹ 试样中纯碱的质量分数的计算式为___________________。
⑺ 还可以用其它实验方法测定试样中纯碱的质量分数。请简述一种不同的实验方法。
28、(16分)已知a、I、e为三种由短周期元素构成的粒子,它们都有10个电子,其结构特点如下:
| 粒子代码 | a | I | e |
| 原子核数 | 单核 | 四核 | 双核 |
| 粒子的电荷数 | 一个单位正电荷 | 0 | 一个单位负电荷 |
物质A由a、e构成,B、C、D、K都是单质,反应①~⑤都是用于工业生产的反应,各有关物质之间的相互反应转化关系如下图所示:请填写下列空白:
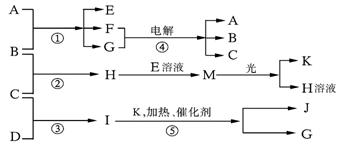
(1)写出下列物质的化学式:
A、 D、 F、____________________
J、 K、
(2)写出下列反应的离子方程式:
a、H+E(溶液)→M 。
b、反应④ 。
(3)在通常状况下,若1 g C气体在B气体中燃烧生成H气体时放出92.3 kJ热量,则2 mol H气体完全分解生成C气体和B气体的热化学方程式为
。
29.(12分)将3.20g Cu溶于B mol/L过量的硝酸溶液30.0 mL中,假设硝酸的还原产物只有NO2和NO,反应结束后,将所剩溶液加水稀释至1000 mL,测得c(NO3-)=0.200 mol/L。
(1)试求稀释后溶液的pH=
(2)生成的气体中NO2和NO的物质的量(可以含有B的代数式表示)。
n (NO2) = n (NO) =
(3)用NaOH溶液吸收氮的氧化物是防止NOx污染的一种方法。原理为:
2NO2+2NaOH=NaNO3+NaNO2+H2O,NO+NO+2NaOH=2NaNO+H2O
若生成的混合气体能被NaOH溶液完全吸收,试讨论B的取值范围
考试题参考答案
一、选择题
6 A 7 C 8 B 9 D 10 A 11 C 12 D 13 B
26、⑴氢 碳 氮 氧
⑵N2+3H2 ![]() 2NH3 三角锥形 ⑶ 即铵根离子的水解
2NH3 三角锥形 ⑶ 即铵根离子的水解
⑷ 须考虑铵根离子与氢氧根的反应 ⑸ Na+ > CO32- > HCO3-> OH- > H+
27、⑴、样品轻、砝码重 ⑵ 防止空气中的水和二氧化碳进入U型管中
⑶、偏高、偏高 ⑷ 将锥形瓶产生的二氧化碳赶入到U型管中
⑸、确保装置中的二氧化碳已完全被吸收 ⑹、略
⑺、取样品溶解,向其中加入足量溶液中,过滤、洗涤、烘干并称量沉淀的质量
28、⑴、NaOH N2 NaCl NO O2 ⑵ H+ + ClO- = HClO
⑶ 2CL- + 2H2O = CL2 + H2 +2OH-
⑷、应注意是氯化氢的分解及反应热的数值与物质的量的关系
26.⑴、 pH=-lgc(H+)=1 (3分)
(2) (NO2)=(0.045B-0.350)mol,n(NO)=(0.150-0.015B)mol
(3) 8.3≤B<10。(上、下限只算出一个且正确给1分)。