高三化学科上册第二次月考试题
化学科试题
(总分:150, 时间:120分钟)
可能用到的原子量:Na 23,Mg 24,Al 27,N 14,S 32,Ag 108
第一卷 70分
一、单项选择题(每小题3分,共30分)
1. 某元素X,Y是短周期元素,两者能组成化合物X2Y3,则这两种元素的原子序数之差不可能是( )
A.1 B.3 C.5 D.6
2. 不能用化学平衡移动原理说明的事实是( )
A.合成氨在高压下进行是有利的
B.温度过高对合成氨不利
C.使用催化剂能使合成氨速率加快
D.及时分离从合成塔中出来的混合气,有利于合成氨
3. 已建立化学平衡的某可逆反应,当条件改变使化学平衡向正反应方向移动时,下列叙述正确的是:①生成物的质量分数一定增加;②生成物产量一定增加;③反应物的转化率一定增大;④反应物的浓度一定降低;⑤正反应速率一定大于逆反应速率;⑥一定使用催化剂。
A.①②③ B.③④⑤ C.②⑤ D.④⑥
4.镁粉在焰火、闪光粉、鞭炮中是不可少的原料。工业上制造镁粉是将镁蒸气在某种气体中冷却,有下列气体:①空气、②CO2、③Ar、④H2、⑤N2,其中可作为冷却气体的是( )
A. ①和② B. ②和③ C. ③和④ D. ④和⑤
5翰林汇55544. 在20oC时,100g水溶解mgNa2CO3达到饱和状态;同时在100g水中溶解ng Na2CO3·10H2O 也达到饱和状态,则m与n的关系是 ( )
A. m = n B. m>n C. m<n D.无法判断
6.将一块钠投入到盛有煤油和水的试管中(煤油和水均足够多),可以观察到的现象是( )
A. 钠浮在试管中的液面上 B. 钠沉人试管中溶液的底部
C. 钠在煤油里燃烧起来 D. 钠处于水和煤油的交界处
7.将过氧化钠和过量的碳酸氢钠在密闭容器中混合充分加热后,最终残留固体物质是( )
A. Na2CO3 B. Na2O和Na2O2
C. Na2O2 D. Na2O2和Na2CO3
8.下列离子方程式中, 正确的是( )
A.在氯化铝溶液中加入过量氨水 Al3++4NH3.H2O = AlO2-+4NH4++2H2O
B.在硫酸铜溶液中通入H2S Cu2++H2S = CuS↓+2H+
C. 碳酸氢钠水解 HCO3-+
H2O![]() H3O++ CO32-
H3O++ CO32-
D.在碳酸氢钙溶液中加入过量氢氧化钠溶液 Ca2++HCO3-+OH-=CaCO3↓+H2O
9.将Cu片放入0.1mol/LFeCl3溶液中,反应一定时间后取出Cu片,溶液中
c(Fe3+)︰c(Fe2+)=2︰3,则Cu2+与Fe3+的物质的量之比为 ( )
A.3︰2 B.3︰5 C.4︰3 D.3︰4
10.由铁、锌、铝、镁四种金属中的两种组成的混合物10g,与足量的盐酸反应产生的氢气在标准状况下为11.2L,则混合物中一定含有的金属是( )
A. 锌 B. 铁 C. 铝 D. 镁
二、选择题(每小题4分,共40分。每小题有1或2个选项符合题意,多选或错选0分,漏选2分。)
11.稀土金属在科技发展中的地位正越来越多的受到重视。我国拥有世界上最大的稀土矿,品位甚高,以RE表示稀土元素,可以向含RE的硫酸盐溶液中加入粉状Na2SO4,使稀土元素转入沉淀,反应为RE2(SO4)3+Na2SO4+xH2O![]() RE2(SO4)3·Na2SO4·xH2O↓,下列有关叙述正确的是(
)
RE2(SO4)3·Na2SO4·xH2O↓,下列有关叙述正确的是(
)
A.该反应不是复分解反应 B.该反应一定在强碱性溶液中进行
C.产生的沉淀属于复盐 D.产生的沉淀物一定是难溶物质
12.有一块铝铁合金,将其溶解于足量盐酸中,再加入过量NaOH溶液,在空气中静置至红褐色沉淀不再增加时,将沉淀滤出再灼烧至恒重,得到残留物的质量与原合金质量相同,则合金中铝的质量分数是( )
A. 22.2% B. 30% C. 75.5% D. 80.6%
13.金属K与Na金属性相近,用K与Na盐共熔时,很难将Na从混合物中分离。若调整温度到一定程度,则可用Na与KCl反应制取金属K。已知四种物质的熔、沸点如下:
K Na KCl NaCl
熔点℃ 63.65 97.8 770 801
沸点℃ 774 882 1500(升华) 1431
根据平衡移动原理,可推知,用Na与KCl反应制K的适宜温度是( )
A. 97.8℃~770℃ B. 770℃~774℃
C. 774℃~882℃ D. 1413℃~1500℃
14. 能影响水的电离平衡,并使溶液中c(H+)>c(OH-)的措施是
A.将水加热煮沸,测得pH=6 B.向纯水中投入一小块金属钠
C.向水中加入NH4Cl固体 D.向水中加入Na2CO3固体
15. 在一固定体积的密闭容器中,加入2 mol X和1 mol Y,发生如下反应:2X+Y![]() 3Z+R(均为气态),当反应达到平衡时,Z的浓度为m mol·L-1,若维持容器体积的温度不变,按下列四种配比作为起始反应物进行,达到平衡时,Z的浓度仍为m mol·L-1的是
3Z+R(均为气态),当反应达到平衡时,Z的浓度为m mol·L-1,若维持容器体积的温度不变,按下列四种配比作为起始反应物进行,达到平衡时,Z的浓度仍为m mol·L-1的是
A.4 mol X+2 mol Y
B.3 mol Z+1 mol R
C.2 mol X+1 mol Y+3 mol Z+1 mol R
D.1 mol X+0.5 mol Y+1.5 mol Z+0.5 mol R
16. 锂电池是新一代高能电池,目前已研究成功多种锂电池。某种锂电池的总反应式为: Li+MnO2=LiMnO2。下列说法中错误的是
A.Li是负极,MnO2是正极
B.放电时负极的反应:Li-e—=Li+
C.放电时正极的反应:MnO2—-e—=MnO2
D.电池放电时,产生高锰酸根离子
17. 下列物质中只含有一个![]() 键的是( )
键的是( )
A. O2 B. C2H2 C. C2H4 D. H2O2
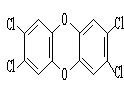 18.1999年比利时发生奶粉受二噁英污染事件。二噁英是一类芳香族化合物的多氯代衍生物的总称,结构稳定,难以被自然分解,是公认的最危险的致癌物质之一。2,3,7,8—四氯二苯并二噁英是其中的一种,结构如右图。下列说法中不正确的是
18.1999年比利时发生奶粉受二噁英污染事件。二噁英是一类芳香族化合物的多氯代衍生物的总称,结构稳定,难以被自然分解,是公认的最危险的致癌物质之一。2,3,7,8—四氯二苯并二噁英是其中的一种,结构如右图。下列说法中不正确的是
A.它的分子式为C12H4O2Cl4 B.它的一溴取代物有2种
C.它能发生加成反应 D.此分子中共平面的原子最多有18个
19.按下列过程,最终能够实现的是( ) 加热,蒸发
![]()
![]()
![]() ①Fe
FeCl2溶液 FeCl3溶液
FeCl3晶体
①Fe
FeCl2溶液 FeCl3溶液
FeCl3晶体
|
|
|
![]()
![]()
![]() ②FeSO4溶液
Fe(OH)2 Fe(OH)3
Fe2(SO4)3溶液
②FeSO4溶液
Fe(OH)2 Fe(OH)3
Fe2(SO4)3溶液
|
![]()
|
|
|
|
|
|
|
A.①② B.③④ C.②④ D.①④
20.相同质量的Na、Mg、Al与过量稀硫酸反应,在相同状况下产生H2的质量比为( )
A. 36:69:92 B.92:69:36 C. 1:1:1 D. 3:2:1
第二卷 80分
三、(本题共3小题,21题12分,22题12分,23题9分,共33分)
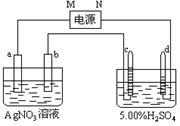 21.(12分)右图中电极a、b分别为Ag电极和Pt电极,电极c、d都是石墨电极。通电一段时间后,Pt电极质量增加,在c、d两极上共收集到336mL(标准状态)气体。回答:
21.(12分)右图中电极a、b分别为Ag电极和Pt电极,电极c、d都是石墨电极。通电一段时间后,Pt电极质量增加,在c、d两极上共收集到336mL(标准状态)气体。回答:
(1)直流电源中,M为 极。
(2)Pt电极上生成的物质是 ,其质量为 g。
(3)电源输出的电子,其物质的量与电极b、c、d分别生成的物质的物质的量之比为:
2∶ ∶ ∶ 。
(4)AgNO3溶液的浓度(填增大、减小或不变。下同) , H2SO4溶液的浓度 ,H2SO4溶液的pH 。
(5)若H2SO4溶液的质量分数由5.00%变为5.02%,则原有5.00%的H2SO4溶液为 g。
22.(12分)1,2 — 二溴乙烷可作汽油抗爆剂的添加剂,常温下它是无色液体,密度2.18 g·cm-3,沸点131.4℃,熔点9.79℃,不溶于水,易溶于醇、醚、丙酮等有机溶剂。在实验室中可以用右图所示装置制备1,2- 二溴乙烷。其中分液漏斗和烧瓶a中装有乙醇和浓硫酸的混合液,试管d中装有液溴(表面覆盖少量水)。
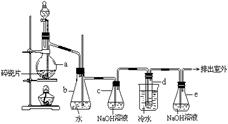 填写下列空白:
填写下列空白:
(1)写出本题中制备1,2-二溴乙烷的两个化学反应方程式_________________________。
(2)安全瓶b可以防止倒吸,并可以检查实验进行时试管d是否发生堵塞.请写出发生堵塞时瓶b中的现象: 。
(3)容器c中NaOH溶液的作用是: ____。
(4)某学生在做此实验时,使用一定量的液溴,当溴全部褪色时,所消耗乙醇和浓硫酸混合液的量,比正常情况下超过许多。如果装置的气密性没有问题,试分析其可能的原因:(写二种)__________
23.(9分)有两个实验小组的同学为探究过氧化钠与二氧化硫的反应,都用如下图所示的装置进行实验。通入SO2气体,将带余烬的木条插入试管C中,木条复燃。
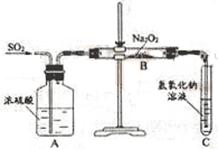
请回答下列问题:
(1) 第1小组同学认为Na2O2与SO2反应生成了Na2SO3和O2,该反应的化学方程式是:
。
(2) 请设计一种实验方案证明Na2O2与SO2反应生成的白色固体中含有Na2SO3。
。
(3) 第2小组同学认为Na2O2与SO2反应生成了Na2SO3和O2外,还有Na2SO4生成。为检验是否有Na2SO4生成,他们设计了如下方案:

上述方案是否合理? 。请简要说明理由:
① ;② 。
四、(本题共3小题,24题7分,25题10分,26题10分,共27分)
24.(7分)短周期元素的A、B、C在元素周期表中的位置如图所示,已知A、B、C三种元素的原子核外电子数之和等于B的质量数,B原子核内质子数和中子数相等。据此填空:
| A | C | |
| B |
(1)A的氢化物分子式为 ;
(2)B的元素符号为 ,原子结构示意图为 ,在周期表中位于第 周期 族;
(3)C的单质分子式为 ,C的单质溶于水所得溶液叫 。
25.(10分)A、B、C、D四种化合物其焰色反应均为紫色,A、B、C和盐酸反应均得到D,将固体C加热可制得A,若在A的溶液中通入一种无色无味气体,又可制得C,若B与C的溶液混合可制得A,试推断
(1)A是________,B是_________,C是_________,D是__________。
(2)完成有关方程式:
C![]() A ________________________;A→C __________________________;
A ________________________;A→C __________________________;
B+C—→A _______________________________________________。
26.(10分)常温下,将0.01molNH4Cl和0.002molNaOH溶于水配成1L溶液,
(1)该溶液中存在的三个平衡体系是___________________、_____________________、__________________________________。
(2)溶液中共有 种不同的粒子。
(3)这些粒子中浓度为0.01mol/L的是 ,浓度为0.002mol/L的是 。
(4)物质的量之和为0.01mol的二种粒子是_____________。
(5) 和 两种粒子数量之和比OH-多0.008mol。
五、(本题共2小题,27题6分,28题14分,共20分。)
27.我国发射“神六”所用的“长征”2号火箭的主要燃料是偏二甲肼和四氧化二氮作为液体燃料。已知偏二甲(基)肼的相对分子质量为60,其中含碳40%,含氢13.33%,其余为氮;又知其分子中有一个氮原子不与氢原子相连。
(1)通过计算写出偏二甲肼的化学式:________;
(2)在发动机中偏二甲(基)肼在四氧化二氮中充分燃烧,写出该反应的化学方程式(反应中所有的氮元素均转化为N2)__________________________ 。
28.(14分)闪电是一种自然现象,地球上每年平均发生315160余次闪电。
(1)每当雷鸣电闪之时,空气可能会发生如下反应:
①N2+O2![]() 2NO ②
③
④
2NO ②
③
④
(2)设某次闪电产生的能量为1.50×107kJ,已知每摩尔氧气和氮气化合时要吸收180.74kJ 的能量,闪电时有1/1000的能量用于这一反应,求:
①此次闪电所产生的NO的物质的量是多少?
②此次闪电的生成物相当于给土地施了多少kg尿素[CO(NH2)2]?
高三第一次测试化学科答题卷
姓名:__________班级:________座号:_______分数:_______
把一、二题答案填入下表:
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 |
三、(本题共3小题,21题12分,22题12分,23题9分,共33分。)
21.
(1)_______ (2) ________ ______ (3) ______ _____ _____
(4) _______ ______ ________ (5) _______
22.
(1)______________________________,______________________________
(2)_____________________________________________________________
(3)_____________________________________________________________
(4)__________________________________________________________________
_______________________________________________________
23.
(1)_____________________________
(2) _________________________________________。
(3) ________ , ___________________________________________________
_____________________________________________________。
四、(本题共3小题,24题7分,25题10分,26题10分,共27分。)
24.
(1)________ (2) ____ ____________ _______ _______
(3)_______ ___________
25.
(1) A是________,B是_________,C是_________,D是__________。
(2)完成有关方程式:
C![]() A ________________________;A→C __________________________;
A ________________________;A→C __________________________;
B+C—→A _______________________________________________。
26.
(1)_______________________________,__________________________________
_________________________________
(2)________ (3)______ ________ (4)_____________ (5) _______ ______
五、(本题共2小题,27题6分,28题14分,共20分。)
27.
(1) ____________
(2)_______________________________________________
28.
(1) ② _______ ③ ______ ④
(2)
[答案]
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| D | C | C | C | C | D | A | B | D | C |
| 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 |
| AC | B | C | C | BD | CD | AC | BD | C | A |
三、(33分)
21. (12分)(1)正 (2)Ag 2.16(2分) (3)2 0.5 1
(4)不变 增大 减小 (5)45.18(2分)(其余每空1分)
22. (每点2分,共12分)(1)
CH2=CH2+Br2→CH2BrCH2Br
(2) b中水面会下降,玻璃管中的水柱会上升,甚至溢出。
(3)除去乙烯中带出的酸性气体(或答除去CO2、SO2)。
(4)原因:①乙烯发生(或通过液溴)速度过快。②实验过程中,乙醇和浓硫酸的混合液没有迅速达到170℃(答“控温不当”亦可)。……………………………..
23.(9分)(1) 2Na2O2+2SO2=2Na2SO3+O2 (2分)
(2) 取白色固体,加稀硫酸,产生能使品红溶液褪色的气体。(2分)
(3) 不合理(1分);稀硝酸能将亚硫酸钡氧化为硫酸钡;如果反应后的固体中还残留Na2O2,它能溶于水后能将亚硫酸根氧化成硫酸根 (4分)
四、
24.(每空1分,共7分)(1)NH3 (2)S ;略;三 ⅥA (3)F2 氢氟酸
25.(10分)⑴A.K2CO3 B.KOH C.KHCO3 D.KCl(每线1分,共4分))
⑵2KHCO3![]() K2CO3+CO2↑+H2O K2CO3+
CO2+ H2O ==2 KHCO3
K2CO3+CO2↑+H2O K2CO3+
CO2+ H2O ==2 KHCO3
KOH+ KHCO3== K2CO3+H2O (每线2分,共6分)
26. (每空1分,共10分)(1)NH3·H2O![]() NH4++OH-;
NH4++OH-;
NH4++H2O![]() NH3·H2O+H+; H2O
NH3·H2O+H+; H2O![]() H++OH-
H++OH-
(2)七 (3)Cl-;Na+ (4)NH4+、NH3·H2O (2分) (5)NH4+;H+
五、(20分) 点燃
27. (每空3分,共6分)(1)C2H8N2 (2)C2H8N2 + 2N2O4 → 2CO2 + 4H2O + 3N2
28.(14分)(1)②2NO+O2=2NO2
③3NO2+H2O=2HNO3+N 或 4NO2+O2+2H2O=4HNO3
④3O2![]() 2O3 (每式2分,共6分)
2O3 (每式2分,共6分)
(2)①(4分)设生成NO的物质的量为x
N2(g)+O2(g)![]() 2NO(g) ;
△H=180.74kJ/mol
2NO(g) ;
△H=180.74kJ/mol
2 mol 180.74kJ
x 1.5×107×1/1000kJ
x=165.98mol=1.66×102mol
②(4分)由2NO ~ CO(NH)2 N原子守恒
∴CO(NH2)2的物质的量=1/2×1.66×102mol
CO(NH2)2的质量=1/2×1.66mol×102×60g/mol=4.98×103g=4.98kg